
- •4. Общие закономерности строения и химического поведения оксосоединений
- •4.1 Оксосоединения
- •3. Технические способы получения формальдегида
- •3.1 Каталитическое окисление метанола:
- •3.2 Каталитическое окисление метана:
- •11. Специфические методы для ароматического ряда
- •1. Реакции нуклеофильного присоединения
- •1.1 Присоединение магнийалкилов:
- •2.1 Образование иминов и оксимов:
- •2.2 Образование гидразонов:
- •5. Реакции окисления альдегидов и кетонов
- •5.2.1 Окисление циклических кетонов:
- •6. Реакции окисления-восстановления (диспропорционирования)
- •8.4.1 Синтез коричного альдегида:
- •8.4.2 Синтез бензаль- и дибензальацетона:
- •4.2 Карбоновые кислоты и их производные
- •4.2.1 Монокарбоновые кислоты
- •1. Реакции карбоновых кислот с нуклеофильными реагентами
- •4. Реакции α-водородного атома
- •4.2.2 Производные карбоновых кислот
- •1. Взаимодействие с хлоридом фосфора (V):
- •2. Взаимодействие с тионилхлоридом:
- •1. Гидролиз:
- •1. Ацилирование аммиака:
- •1.1 Щелочной гидролиз:
- •1.2 Кислотный гидролиз:
- •3. Реакция аммонолиза:
- •4.2.3 Дикарбоновые кислоты
- •4.2.4 Непредельные карбоновые кислоты
- •4.2.4.1 Одноосновные кислоты этиленового ряда
- •2. Гидролиз акрилонитрила:
- •1. Из ацетона и синильной кислоты:
- •4.2.4.2 Непредельные дикарбоновые кислоты
- •4.2.5 Жиры
- •Особенности физических свойств гомо-функциональных производных углеводородов
- •Экологические проблемы производства и применения гомофункциональных производных углеводородов
4.2.5 Жиры
Природные животные жиры и растительные масла состоят главным образом из глицеридов (сложные эфиры глицерина и органических кислот, С10 – С18). Наблюдаемые различия между жирами обусловлены исключительно органическими кислотами. Запасные жиры – один из метаболических энергетических резервов живых систем.
Кислоты жиров. Кислоты в природных жирах являются монокарбоновыми с нормальной цепью и четным числом атомов углерода. Исключение составляют изовалериановая кислота и ряд циклических кислот, содержащихся в некоторых редко встречающихся жирах.
Природные жиры классифицируют на основании содержащихся в них главных кислот (таблица 31).
Из всех непредельных кислот, содержащихся в природных жирах, наиболее распространена олеиновая кислота, две другие непредельные кислоты – линолевая и линоленовая – присутствуют в значительно меньшем количестве. В заметных количествах линолевая и линоленовая кислоты содержатся в растительных маслах; для животных организмов они являются незаменимыми кислотами. В природе непредельные кислоты встречаются только в цис-форме.
Таблица 31 – Классификация карбоновых кислот жиров
|
Кислота |
Число атомов углерода |
Формула | |
|
Предельные (жирные) кислоты | |||
|
Капроновая |
С6 |
| |
|
Каприловая |
С8 |
| |
|
Каприновая |
С10 |
| |
|
Лауриновая |
С12 |
| |
|
Миристиновая |
С14 |
| |
|
Пальмитиновая |
С16 |
| |
|
Стеариновая |
С18 |
| |
|
Арахиновая |
С20 |
| |
|
Непредельные кислоты | |||
|
Олеиновая |
С18 |
| |
|
Линолевая |
С18 |
| |
|
Линоленовая |
С18 |
| |
|
Элеостеариновая |
С18 |
| |
|
Эруковая |
С22 |
| |
Пальмитиновая, стеариновая и миристиновая кислоты распространены так же, как и олеиновая. Стеариновая кислота содержится в большом количестве в запасных жирах некоторых млекопитающих и в жирах некоторых тропических растений, например, в масле какао.
Жиры «низших живых существ» (бактерий) отличаются по своему составу от жиров высших живых существ (млекопитающих) – состав последних обычно значительно сложнее.
Химические свойства жиров
Гидролиз. Среди реакций жиров особое значение имеет гидролиз, или омыление, которое можно осуществить как кислотами, так и основаниями:
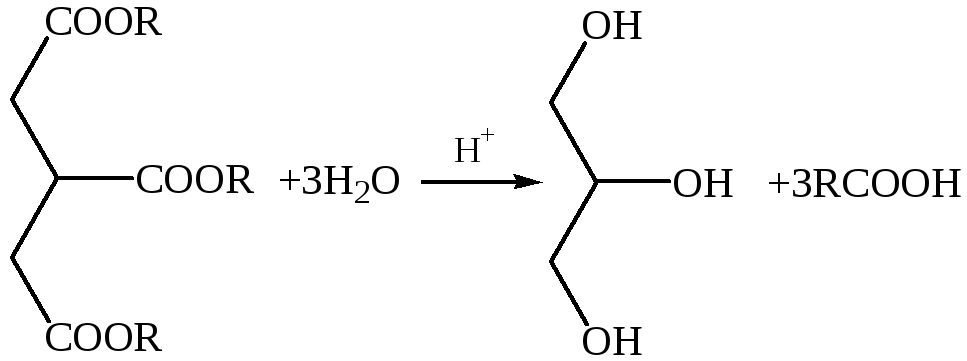
Омыление жиров идет постепенно, так что при омылении тристеарина получается сначала дистеарин, затем моностеарин и, наконец, глицерин и стеариновая кислота.
Катализаторами омыления жиров являются сульфокислоты, получаемые сульфированием смеси непредельных жирных кислот с ароматическими углеводородами. В семенах клещевины находится особый энзим – липаза, обладающий способностью ускорять омыление жиров. Использование липазы для каталитического омыления жиров широко применяется в технике.
Гидрогенизация жиров – процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жиров.
В настоящее время гидрирование растительных масел составляет целую отрасль промышленности, выпускающую пищевые и технические твердые жиры. При гидрировании водород присоединяется по месту двойной связи, превращая масло в твердый жир:
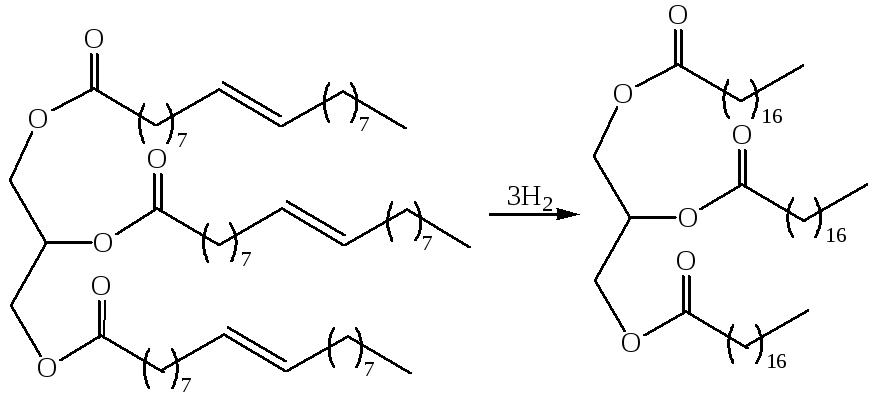
Твердые гидрогенизированные жиры имеют преимущества перед жидкими: они удобнее при транспортировке, более стойки при хранении. Твердые гидрогенизированные жиры (саломас) используются не только для технических целей, но и для производства маргарина.
Мыла и детергенты. Щелочное расщепление жиров с помощью едкого натра или едкого кали проводится главным образом при получении мыла. Мыла представляют собой щелочные соли высших жирных кислот:
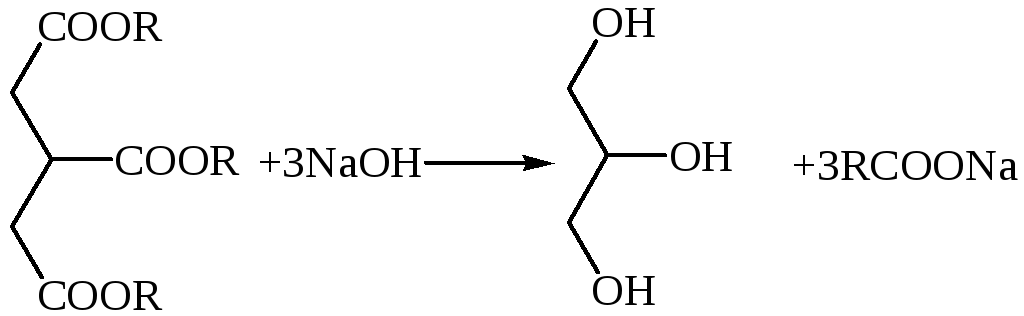
В промышленности в качестве исходных веществ для получения мыла применяются животные жиры, хлопковое, пальмовое, кокосовое масла, гидрогенизированные жиры. При нагревании их с едким натром образуется густой раствор («мыльный клей»), содержащий глицерин и соли жирных кислот. Затем к еще горячей жидкости прибавляют поваренную соль – «высаливают» натриевое мыло.
Все мыла, являясь щелочными солями слабых кислот, в воде частично гидролизуются с образованием свободной жирной кислоты и гидроокиси щелочного металла, поэтому их растворы имеют щелочную реакцию:
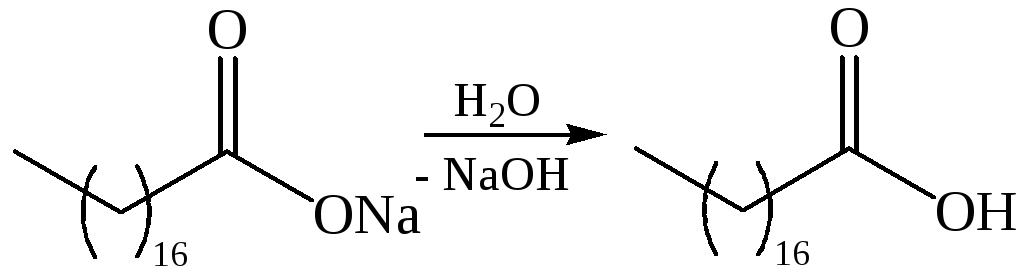
При добавлении натриевого мыла к жесткой воде находящиеся в ней кальциевые и магниевые соли замещают натрий, образуя нерастворимые мыла, поэтому моющая способность мыла в жесткой воде значительно снижается.
Моющие средства (детергенты), заменители мыла, представляют собой смесь натриевых солей эфиров серной кислоты и спиртов, например, лаурилового и цетилового (R–OSО3Na, где R от С10 до С18). Эти соединения можно использовать в жесткой воде. Значительные количества детергентов употребляются при флотации руд и в других отраслях промышленности.
Мыла и детергенты представляют собой эмульгирующие вещества, превращающие смесь масла и воды в устойчивую эмульсию. Моющая способность мыла и детергентов зависит от их эмульгирующих свойств, а также от их способности понижать поверхностное натяжение. Дестабилизация или стабилизация масляно-водных эмульсий мылами и детергентами называется детергенцией. Молекула любого детергента должна иметь гидрофильную группу, подобную карбоксильной группе, и длинную углеводородную цепь. В зависимости от природы и заряда гидрофильной группы различают анионные и катионные детергенты. Свойства мыла или детергента заметно изменяются в зависимости от природы противоположно заряженного иона, свободно перемещающегося в водной среде. Углеводородная часть молекулы мыла, или «хвост», имеет тенденцию растворяться в капле масла, в то время как карбоксильная группа, или «голова», притягивается к водной фазе. Вследствие этого поверхность каждой капли масла приобретает отрицательный заряд и стремиться оттолкнуться от других таких же капель масла, что приводит к образованию устойчивой эмульсии.
Синтетические моющие средства обычно включают мицелло-образующие поверхностно-активные вещества (ПАВ), обладающие моющим, смачивающим и антистатическим действием. Основа многих синтетических моющих средств – анионные ПАВ – алкилбензолсульфонаты, алкилсульфаты, алкилэтоксисульфаты, мыла, алкансулъфонаты, α-олефинсульфонаты натрия.
В связи с общемировой тенденцией к использованию синтетических моющих средств с ферментами и катионными мягчителями-антистатиками повысилась роль неионогенных ПАВ-оксиэтилированных спиртов, оксиэтилированных алкилфенолов, оксиэтилированных алкиламинов. В качестве вспомогательных ПАВ, усиливающих определенный эффект и смягчающих нежелательное дерматологическое действие, в синтетические моющие средства могут вводиться в небольших количествах алкил- и алкилэтоксифосфаты, таураты, сульфосукцинаты, соли α-сульфокарбоновых кислот, эфирокарбоксилаты, оксиалкиламиды жирных кислот и их этоксилаты, N-оксиды третичных аминов, блоксополимеры алкиленоксидов, амфогерные производные аминокислот, имидазолина и бетаина.
Некоторое распространение получили синтетические моющие средства на базе анионных и (или) неионогенных ПАВ с добавками катионных ПАВ или полимеров, способные в процессе полоскания вследствие адсорбции на волокнах снижать электростатический заряд и усадку ткани. Примеры таких катионных ПАВ – диалкилдиметиламмонийхлорид, 1-(2-алкил-аминоэтил)-2-алкил-3-метилимидазолинийметилсульфат, катионное произ-водное гидроксиэтилцеллюлозы.
