
- •4. Общие закономерности строения и химического поведения оксосоединений
- •4.1 Оксосоединения
- •3. Технические способы получения формальдегида
- •3.1 Каталитическое окисление метанола:
- •3.2 Каталитическое окисление метана:
- •11. Специфические методы для ароматического ряда
- •1. Реакции нуклеофильного присоединения
- •1.1 Присоединение магнийалкилов:
- •2.1 Образование иминов и оксимов:
- •2.2 Образование гидразонов:
- •5. Реакции окисления альдегидов и кетонов
- •5.2.1 Окисление циклических кетонов:
- •6. Реакции окисления-восстановления (диспропорционирования)
- •8.4.1 Синтез коричного альдегида:
- •8.4.2 Синтез бензаль- и дибензальацетона:
- •4.2 Карбоновые кислоты и их производные
- •4.2.1 Монокарбоновые кислоты
- •1. Реакции карбоновых кислот с нуклеофильными реагентами
- •4. Реакции α-водородного атома
- •4.2.2 Производные карбоновых кислот
- •1. Взаимодействие с хлоридом фосфора (V):
- •2. Взаимодействие с тионилхлоридом:
- •1. Гидролиз:
- •1. Ацилирование аммиака:
- •1.1 Щелочной гидролиз:
- •1.2 Кислотный гидролиз:
- •3. Реакция аммонолиза:
- •4.2.3 Дикарбоновые кислоты
- •4.2.4 Непредельные карбоновые кислоты
- •4.2.4.1 Одноосновные кислоты этиленового ряда
- •2. Гидролиз акрилонитрила:
- •1. Из ацетона и синильной кислоты:
- •4.2.4.2 Непредельные дикарбоновые кислоты
- •4.2.5 Жиры
- •Особенности физических свойств гомо-функциональных производных углеводородов
- •Экологические проблемы производства и применения гомофункциональных производных углеводородов
1. Реакции нуклеофильного присоединения
1.1 Присоединение магнийалкилов:
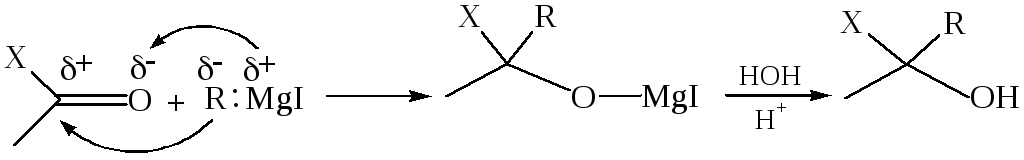
где Х = Н, Alk
Вследствие большой полярности связи Сδ––Мgδ+ магнийорганические соединения – довольно сильные нуклеофилы, поэтому реакция протекает очень легко. Образующийся продукт присоединения (алкоголят) при разложении водой превращается в соответствующий спирт.
1.2 Присоединение бисульфита натрия. Анион SО3– является сильным нуклеофилом, поэтому реакция альдегидов с NаHSО3 протекает очень легко в отсутствие катализаторов при энергичном встряхивании с насыщенным водным раствором соли:

Бисульфитные производные легко кристаллизуются, не растворяются в избытке бисульфита, легко регенерируют исходное карбонильное соединение при нагревании с разбавленной кислотой или содой. Поэтому эту реакцию используют:
как качественную на альдегиды;
для выделения альдегидов из смесей или с целью их очистки.
В ряду кетонов эта реакция возможна только для наименее пространственно затрудненных соединений типа метилкетонов.
1.3 Присоединение синильной кислоты. Синильная кислота – слабодиссоциирующее соединение и. соответственно, плохой источник цианид-иона как нуклеофила. Поэтому в этой реакции используют основные катализаторы, которые способствуют отщеплению протона и образованию цианид-аниона.
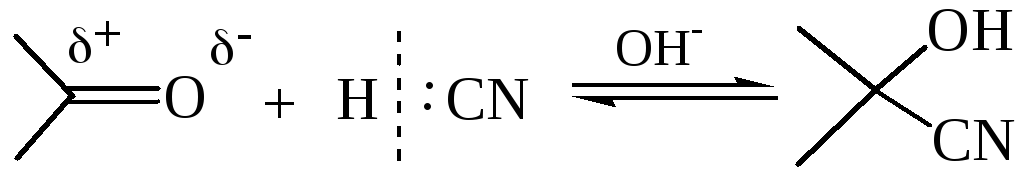
Присоединение цианид-иона к кетонам протекает труднее, чем к альдегидам, а с ароматическими кетонами типа Аr–СО–Аr цианид-ионы практически не реагируют. Синтетическая ценность этой реакции заключается в возможности удлинения углеродной цепи на один атом и получения гидроксикарбоновых кислот.
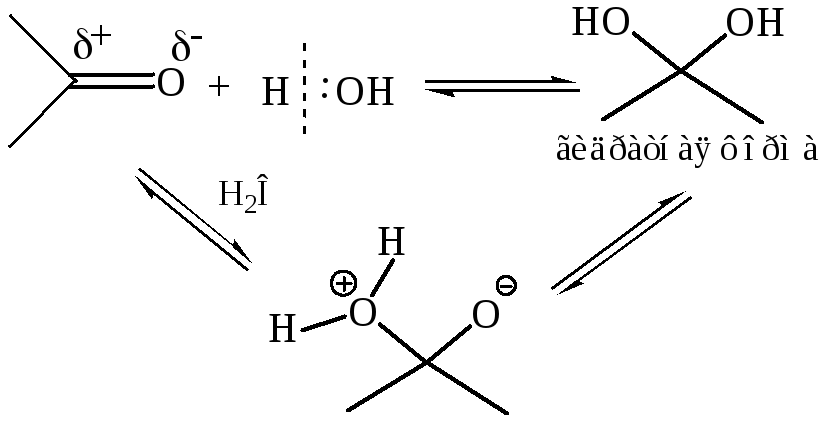
1.4 Присоединение воды. Вследствие того, что вода – слабый нуклеофил, реакция обратима, и положение равновесия определяется строением субстрата, т. е. реакционной способностью карбонильного соединения:
1.5 Присоединение спиртов. Эта реакция протекает по той же схеме, что и присоединение воды:
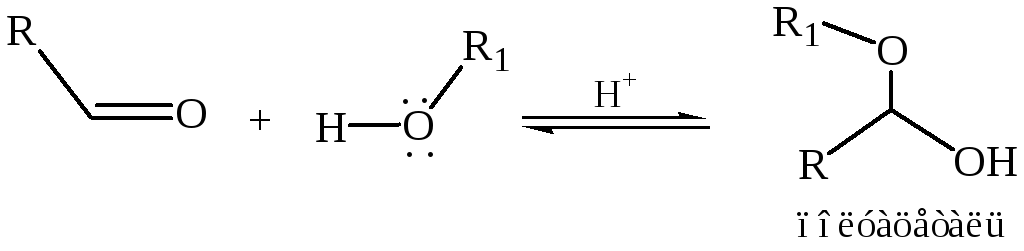
Спирт, как и вода, – слабый нуклеофил, поэтому образование полуацеталей характерно только для альдегидов. Полуацетали – обычно неустойчивые соединения, их нельзя выделить из спиртовых растворов. Если эту реакцию проводить в присутствии кислого катализатора при нагревании и избытке спирта, полуацеталь превращается далее в устойчивую форму – ацеталь:
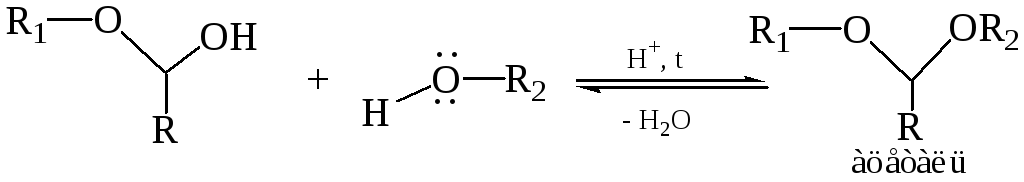
Образование ацеталя – SN1, реакция ОН-группы полуацеталя. Ацетали представляют собой простые гем-эфиры, однако, в отличие от обычных простых эфиров, связь С–О в ацеталях менее прочная, и они легко гидролизуются в кислой среде до исходных карбонильных соединений. Однако ацетали устойчивы к гидролизу основаниями, поэтому образование ацеталей – метод защиты альдегидной группы от действия оснований.
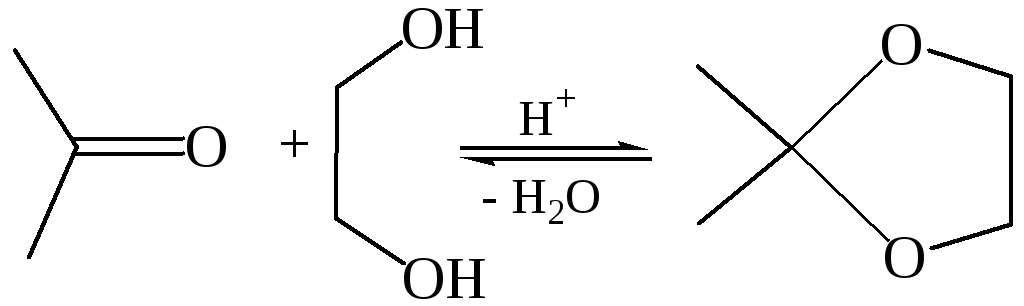
Кетоны, как менее реакционноспособные соединения, обычно не реагируют с простыми спиртами, однако с 1,2-диолами образуют циклические производные – кетали:
2. Реакции с N-нуклеофилами (реакции присоединения-отщепления). К числу N-нуклеофилов (азотистых оснований) относятся аммиак NН3 и ряд его производных с общей формулой NH2–X, например, NH2–R, NH2–NH2, NH2–NH–Аr, NH2–ОН и др. Обычно используют кислые катализаторы для активации субстрата и дегидратации аддукта. Однако в сильнокислой среде азотистые основания превращаются в соли и теряют нуклеофильные свойства, поэтому каждую конкретную реакцию следует проводить при оптимальном значении рН среды. Учитывая кислый катализ, механизм взаимодействия карбонильного соединения с азотистым основанием можно представить следующим образом:

Как видно из схемы, на лимитирующей стадии протекает типичная для карбонильных соединений AN реакция. Однако промежуточный аддукт неустойчив, так как энергия двух простых связей C–N и С–О (305,9 + 356,2 = 662,1 кДж/моль) больше энергии двойной связи C=N (615,9 кДж/моль). Следовательно, энергия аддукта относительно велика и поэтому легко протекает его дегидратация. Таким образом, реакции карбонильных соединений с N-нуклеофилами можно рассматривать как нуклеофильное замещение атома кислорода карбонильной группы (SN).
