
immunologia_N3-4_2010_block_210x297
.pdf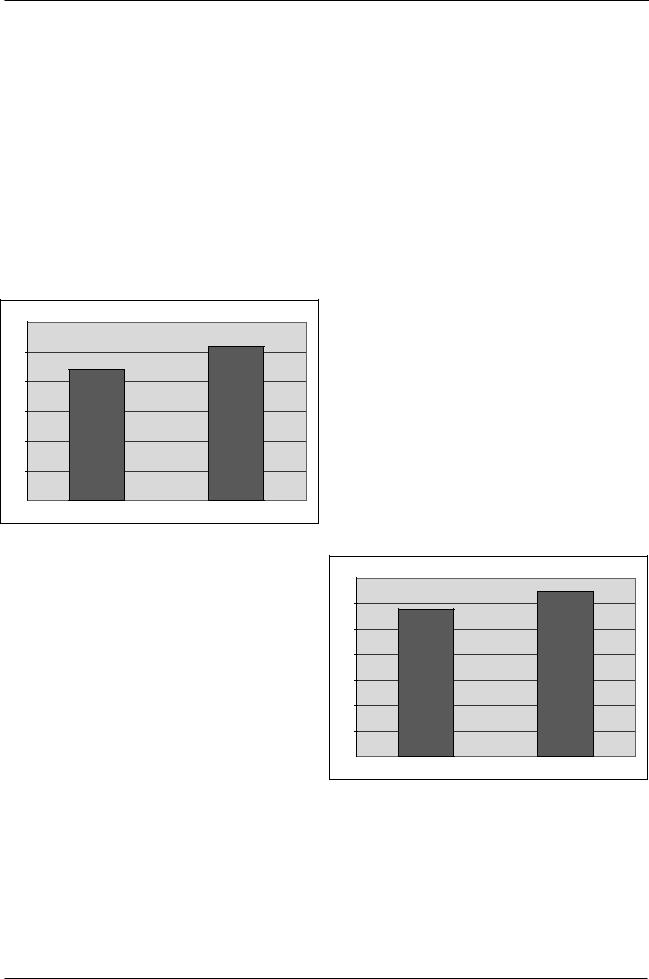
ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
S.typhimurium. Таким образом, бифидо- и лактобактерии, характерные для раннего детского возраста, в меньшей степени способны к продукции провоспалительных цитокинов, чем бифидо- и лактобактерии, характерные для людей старшего возраста. Вероятно, это обусловлено тем, что одной из важнейших функций нормальной микрофлоры детей раннего возраста является формирование механизмов иммунологической толерантности.
В этой связи представлялось крайне важным изучение возможного изменения показателя фонового уровня IL-12 у студентов, ежедневно принимающих пробиотический продукт Актимель.
Полученные результаты представлены на Рисунке 5.
ИЛL12 |
|
120 |
|
100 |
|
80 |
|
60 |
|
40 |
|
20 |
|
0 |
|
до приема Актимель |
после приема Актимель |
Рис. 5. Показатели фонового уровня IL-12 в периферической крови у студентов
до и после приема пробиотического продукта Актимель.
Как видно из рисунка 5, показатели концентрации IL-12 в сыворотке у студентов до приема пробиотического продукта Актимель находились в пределах (87,9±6,1 пкг/мл). К окончанию приема пробиотического продукта концентрация IL-12 в периферической крови достоверно увеличивалась и достигала показателей в 103,6±13,1 пкг/мл.
Резюме
Ежедневный прием пробиотического продукта Актимель достоверно повышает уровень IL-12 в периферической крови у студентов находящихся в условиях интенсивного учебного процесса.
3.2. Оценка изменения показателя фонового уровня IL-15 и IL-18 в периферической крови у студентов принимающих пробиотический продукт Актимель
Особое внимание заслуживает серия сообщений о важной роли IL-12 и IL-18 в формировании и функционировании иммунной системы. Изучение и получение новых данных о разных механизмах действия IL-18 in vitro и in vivo в
экспериментах на лабораторных животных позволяет судить о ведущей роли этого цитокина в формировании аллергического воспаления. Было отмечено, что уровень IL-18 коррилирует с уровнем эозинофилии и концентрацией растворимого рецептора IL-2 (sIL-2R) в сыворотке крови.
Особенный интерес к IL-18 связан с сообщением о том, что этот цитокин обладает способностью в содружестве из IL-12 индуцировать синтез IFN- . Установлено также, что IL-12 способствует дифференцированию Т-лимфоцитов из Тh0 в Тh1, стимулирует продукцию IFN- и усиливает экспрессию рецепторов к IL-18 на Т-лимфоцитах, В-лимфоцитах и натуральных киллерах (NK). Однако, IL-18 в содружестве из sIL-2R, может также способствовать синтезу Тh2 цитокинов и увеличению продукции IgЕ. Аналогичная взаимосвязь наблюдается при синергизме IL-12 и IL-15.
Кроме этого, стало известно, что IL-15 может индуцировать продукцию IFN- и уменьшать IL-4-индуцированную продукцию IgЕ. В то же время IL-15 способен индуцировать продукцию IL-10, что вместе с IL-12 снижает синтез INF- .
В этой связи представляется интересным изучение изменения показателя фонового уровня цитокинов (IL-15 и IL-18) у студентов принимающих пробиотический продукт Актимель и находящихся в условиях напряженного учебного процесса.
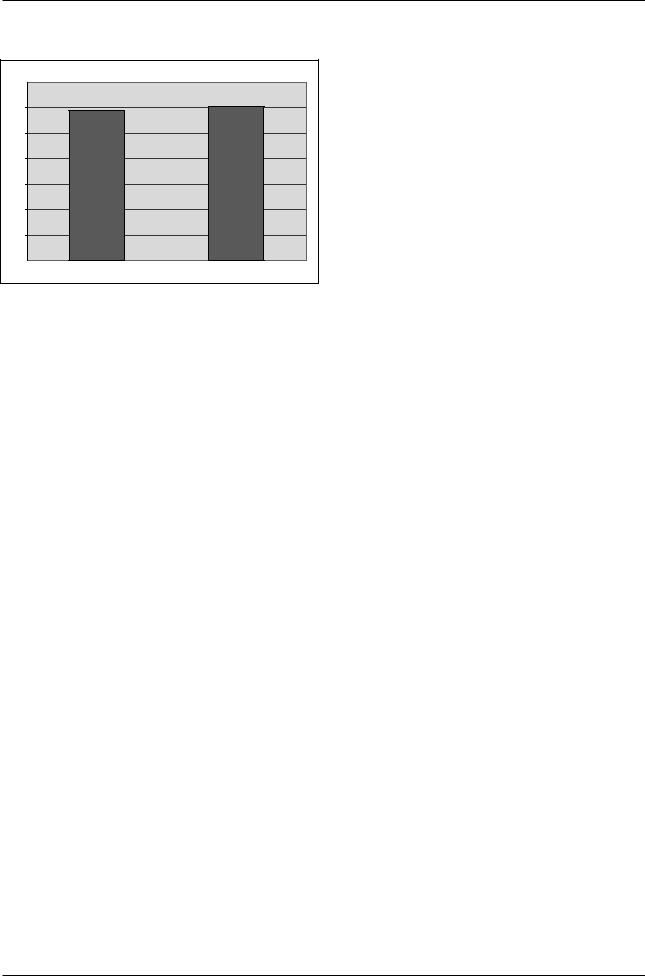
Полученные результаты фонового уровня IL15 представлены на Рисунке 6.
ИЛL15 |
|
350 |
|
300 |
|
250 |
|
200 |
|
150 |
|
100 |
|
50 |
|
0 |
|
до приема Актимель |
после приема Актимель |
Рис. 6. Показатели фонового уровня IL-15 в периферической крови у студентов
до и после приема пробиотического продукта Актимель.
Как видно из рисунка 6, показатели концентрации IL-15 в сыворотке у студентов до приема пробиотического продукта Актимель находились в пределах (288,8±12,0 пкг/мл). К окончанию приема пробиотического продукта концентрация IL-12 в периферической крови достоверно увеличивалась и достигала показателей в 323,1±14,3 пкг/мл.
11
ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
Результаты фонового уровня IL-18 представ- |
|
лены на Рисунке 7. |
|
ИЛL18 |
|
350 |
|
300 |
|
250 |
|
200 |
|
150 |
|
100 |
|
50 |
|
0 |
|
до приема Актимель |
после приема Актимель |
Рис. 7. Показатели фонового уровня IL-18
в периферической крови у студентов до и после приема пробиотического продукта Актимель.
Как видно из рисунка 7, показатели концентрации IL-18 в сыворотке у студентов до приема пробиотического продукта Актимель
находились в пределах (294,5±15,6 пкг/мл). К окончанию приема пробиотического продукта Актимель концентрация IL-18 в периферической крови достоверно не отличалась (302,9±15,5) пкг/мл.
Резюме
Ежедневный прием пробиотического продукта Актимель достоверно повышает уровень IL-15 в периферической крови у студентов находящихся в условиях интенсивного учебного процесса. Достоверного изменения концентрации IL-18 не наблюдалось.
4. Изучение показателей системного иммунитета у студентов до и после употребления продукта Актимель.
Определение исходного уровня иммунного статуса производили каждому студенту после набора в исследуемую группу, перед началом приема продукта Актимель и по окончании приема через 6 недель. Данные основных показателей иммунологического статуса до и после приема пробиотического продукта приведены в таблице 2.
Таблица 2.
Сравнительные иммунологические показатели у студентов до и после употребления продукта Актимель (M±m).
Параметры иммунограммы |
Референс |
Параметры до приема |
Параметры после приема |
||
показатели |
Актимель n=50 |
Актимель n=50 |
|||
|
|
||||
|
|
|
|
|
|
Лимфоциты |
% |
19-37 |
40,2±1,36 |
37,98 ± 1,12 |
|
Абс.число |
|
800-3600 |
2155±97,3 |
1947±83,58 |
|
|
|
|
|
|
|
CD3+-клетки |
% |
40-60 |
70,06±0,87 |
70,02±0,95 |
|
Абс.число |
|
600-1600 |
1497±71,1 |
1388±56,2 |
|
|
|
|
|
|
|
CD19+-клетки |
% |
15-30 |
12,86±0,5 |
15,28±0,54 |
|
Абс. число |
|
200-600 |
272,8±19,7 |
289,7±15,6 |
|
|
|
|
|
|
|
CD4+-клетки |
% |
30-40 |
39,1±0,87 |
40,4±0,89 |
|
Абс. число |
|
400-800 |
837±39,9 |
781,1±32,1 |
|
|
|
|
|
|
|
CD8+-клетки |
% |
15-20 |
27,5±1,0 |
27,6±0,9 |
|
Абс. число |
|
200-400 |
603,2±38,6 |
571±37,4 |
|
|
|
|
|
|
|
CD4:CD8 |
|
1,5-2,5 |
1,54±0,08 |
1,6±0,07 |
|
|
|
|
|
|
|
sIgА г/л |
|
0,8-3,7 |
2,34±0,14 |
1,9±0,13 |
|
|
|
|
|
|
|
IgE |
|
0-150 |
146,8±25,7 |
148,6±31,3 |
|
|
|
|
|
|
|
Кортизол |
|
190-690 |
719,2±14,8 |
807,2±13,8 |
|
|
|
|
|
|
|
Примечание: *достоверные отличия относительно показателей до приема Актимель (Р 0,05)
Из приведенных в таблице данных становится очевидным, что у студентов до приема пробиотического продукта изменения иммунологических показателей имеют разнообразный характер.
По сравнению с предлагаемыми референс показателями студенты исследуемой группы
в среднем характеризовались нормальными параметрами абсолютного и относительного уровня лимфоцитов периферической крови. При этом показатели количества Т-лимфоцитов (CD3+) в исследуемой группе студентов были несколько выше предлагаемых для сравнения референс показателей.
12

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
Как видно из таблицы 2, практически в пределах нормы находились количественные показатели Т-хелперов (CD4+) и В-лимфоцитов (CD19+).
Необходимо отметить, что исследуемой группе студентов до приема пробиотического продукта отмечалась тенденция к увеличению уровня цитотоксических Т-лимфоцитов (CD8+).
Однако, все эти изменения не приводили к снижению иммунорегуляторного индекса CD4+/ CD8+ по сравнению с референс-показателями , что не может свидетельствовать о наличии иммуносупрессии.
У студентов также не было отмечено достоверного изменения уровня концентрации sIgА и IgE, относительно аналогичных референс показателей.
Повторное иммунологическое исследование проводилось студентам по завершении лечебного курса (через 6 недель от начала приема пробиотического продукта) для выявления динамики иммунологических показателей.
Как видно из таблицы 2 после приема продукта Актимель у студентов сохранялись высокие показатели CD3+Т-лимфоцитов. Однако необходимо отметить, что разницы в количественных показателях CD3+Т-лимфоцитов до и после приема продукта Актимель не наблюдалось. Отсутствовали также достоверные отличия в количественных показателях CD4+ и CD8+лимфоцитов. Соответственно не претерпел достоверных изменений показатель соотношения CD4+/ CD8+. Уровень CD19 нормализовался.
Однако необходимо отметить, что у студентов, принимающих пробиотический продукт Актимель, наблюдалось незначительное снижение концентрации sIgA и отмечалось достоверное повышение уровня кортизола в крови. Достоверных изменений в уровнях концентрации IgЕ до и после приема Актимель не обнаружено.
Резюме
1.У студентов, находящихся в условиях интенсивного учебного процесса до приема пробиотического продукта Актимель наблюдается увеличение количества CD3+Т-лимфоцитов при отсутствии достоверных изменений в количественных показателях CD4+, CD8+, CD19+лимфоцитов, соотношения CD4+/ CD8+ и показателей уровня sIgA и IgЕ.
2.После приема продукта Актимель у студентов сохранялись высокие показатели CD3+Т-лимфоцитов. Отсутствовали также достоверные отличия в количественных показателях CD4+, CD8+, CD19+лимфоцитов и индекса соотношения CD4+/CD8+. Отмечалось незначительное снижение концентрации sIgA и повышение уровня кортизола.
ВЫВОДЫ
1.Анализ данных позволяет заключить, что по окончанию приема пробиотического продукта Актимель происходит достоверное усиление продукции NO клетками и показателей НСТ-теста у студентов исследуемой группы, превышающее продукцию аналогичные показатели до приема пробиотического продукта, что косвенно подтверждает усиление фагоцитарной активности.
2.Шестинедельный курс приема пробитического продукта Актимель не приводил к достоверному увеличению в периферической крови общей численности CD16+CD56+ NK клеток и количества CD56+ NK клеток экспрессирующих Перфорин у студентов находящихся в условиях интенсивного учебного процесса.
3.Ежедневный прием пробиотического продукта Актимель на протяжении 6 недель достоверно повышает уровень IL-12 и IL-15 в периферической крови у студентов находящихся в условиях интенсивного учебного процесса. Достоверного изменения концентрации IL-18 не наблюдалось.
4.У студентов, находящихся в условиях интенсивного учебного процесса до приема пробиотического продукта Актимель наблюдается увеличение количества CD3+Т- лимфоцитов при отсутствии достоверных изменений в количественных показателях CD4+, CD8+, CD19+лимфоцитов, соотношения CD4+/ CD8+ и показателей уровня sIgA и IgЕ. После приема продукта Актимель у студентов сохранялись высокие показатели CD3+Т-лимфоцитов при отсутствии достоверных отличий в количественных показателях CD4+, CD8+, CD19+лимфоцитов и индекса соотношения CD4+/CD8+ на фоне незначительного снижения концентрации sIgA и повышения уровня кортизола.
5.Т.о., проведенное исследование подтвердило литературные научные данные о положительном влиянии приема пробиотического кисломолочного продукта питания Актимель на функционирование врожденного иммунитета. Это позволяет рекомендовать его людям, пребывающим в условиях стрессовых воздействий, в том числе и в течение эпидемиологически неблагоприятного периода года.
СПИСОК ЛИТЕРАТУРЫ
1.1.Neish Andrew S. Microbes in gastrointestinal health and disease. Gastroenterology 2009;136:65-80.
13

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
2.Marchesi Julian, Shanahan Fergus. The normal intestinal microbiota. Curr Opin Infect Dis 2007;20:508-13.
3.Round June L, Mazmanian Sarkis K. The gut microbiota shapes intestinal immune responses during health and disease. Nat Rev Immunology 2009;9.
4.Zuccotti GV, Meneghin F, Raimondi C, Dilillo D, Agostoni C, Riva E, Giovannini M. Probiotics in clinical practise: an overview. J Int Med Res 2008;36(Suppl. 1).
5.Yazdanbakhsh, M., Kremsner, P. G., & van Ree, R. Allergy, parasites, and the hygiene hypothesis. Science 2002, 296, 490–494.
6.Foligne, B. et al. Correlation between in vitro and in vivo immunomodulatory properties of lactic acid bacteria. World J.Gastroenterol. 2007; 13, 236–243
7.Hart, A. L., Lammers, K., Brigidi, P., Vitali, B., Rizzello, F., Gionchetti, P., et al. Modulation of human dendritic cell phenotype and function by probiotic bacteria. Gut 2004; 53, 1602–1609.
8.Takeda, K. et al.Interleukin-12 is involved in the enhancement of human natural killer cell activity by Lactobacillus casei Shirota.Clin. Exp. Immunol. 2006; 146, 109–115
9.Takeda K, Suzuki T, Shimada SI, Shida K, Nanno M, Okumura K. Interleukin-12 is involved in the enhancement of human natural killer cell activity by Lactobacillus casei Shirota. Clin Exp Immunol 2006;146(1):109-15.
10.Пастушенков В.Л., 1989.
11.Green L.C., Wagner D.A., Gladowski G., Skipper P.I.Analisis of nitrat and nitrit and N15-nitrat in biological fluidis. Analytical biocham. – 1982. – Vol. 126. – p. 131-138.
12.Houli Joang, Balazy Michael. Detection of 3-Nitrosine in human platelets exposed to peroxynitrite by a new gas chromatography\ mass spectrometry assay. Nitric oxide: Biology and Chemistry. – 1998. – Vol. 2, №5. – р. 350359.
14

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
ИММУНОЛОГИЧЕCКИЕ АСПЕКТЫ БОЛЕЗНЕЙ ПАРОДОНТА И ВНУТРЕННИХ ОРГАНОВ : ПАТОГЕНЕЗ, ПРОФИЛАКТИКА, ЛЕЧЕНИЕ
*ГРИШАНИН Г.Г., *ПЕРЕШИВАЙЛОВА И.А., *ХОЛОДНАЯ Е.В., КОЖИН М.И., ШУМОВА Н.В., ШУШЛЯПИН О.И., КОНОНЕНКО Л.Г., ТУЧИНСКАЯ М.А., САПРИЧЁВА Л.В.
*Кафедра ортопедической стоматологии, кафедра внутренней медицины № 2, клинической иммунологии и аллергологии, ХНМУ
Состояние здоровья тканей и органов полости рта: губ, зубов, языка и пародонта определяют уровень здоровья человека в рамках интегративной концепции. В этой связи привлекает идея И.И.Мечникова о ведущей роли микрофлоры полости рта в поддержании здоровья человека с современных мировоззренческих позиций.
Микрофлоре полости рта принадлежит особая роль в поддержании стабильного состояния здоровья человека. Хронические гингивиты и пародонтиты разрушают соединительную ткань пародонта, связки периодонта и альвеолярные отростки челюстей, перманентно поставляя в пищеварительную и дыхательные системы организма патогенную микрофлору и продукты ее жизнедеятельности.
Основным субстратом патогенеза, запускающим воспалительный процесс в пародонте, является микробиота зубного налета, локализующегося в специфичных локусах: на поверхностях коронковых частей зубов, ямках и фиссурах, а также на апроксимальных поверхностях: от клинических шеек зубов до контактных пунктов. Кроме того, много зубного налета откладывается в областях зубо-десневых соединений sulcus gingivae (SG).
Микрофлора полости рта представляет собой высокочувствительную индикаторную систему микробиоты, реагирующую как качественными, так и количественными сдвигами в ответ на патологические изменения в органах и системах организма человека.
Клиническая картина воспаления в тканях пародонта характеризуется гиперемией, отеком
икровоточивостью. На молекулярном и клеточном уровнях воспалительный процесс проявляется возникновением клеточных инфильтратов
ивысвобождением цитокинов, ведущих факторов воспаления, сочетающихся с факторами комплемента. Продукты воспаления - молекулы липополисахаридов, запускают цепные иммунологические реакции местного и общего уровня,, в свою очередь, проявляющиеся деструктивными процессами в тканях пародонта, образуя классический circulus vitiosus [5].
Кроме того, патологические процессы в полости рта негативно информационноэнергетически влияют на органы через посред-
ство системы гомо-гетероэнергетических связей организма.
Входе эволюции при постоянных взаимодействиях организма человека и многочисленных популяций микроорганизмов окружающей среды, происходила адаптация, сопровождавшаяся совершенствованием симбиоза организма человека, а также селекция микроорганизмов, способных к адгезии и колонизации биотопа полости рта микробиотой. Образовались стойкие симбиотические ассоциации микроорганизмов, а также своеобразные экологические ниши микробиоты в фиссурах и естественных углублениях коронковых частей зубов, зубодесневых бороздках, на спинке языке etc.
Полость рта среда обитания, биотоп микробных ассоциаций, здесь, в процессе филогенеза, сформировались стабильные симбиотические ассоциации, запустившие процесс образования микробиоты макроорганизма хозяина.
Микробиота организма человека стала своеобразным органом, состоящим из микробных клеток, количество которых от 10 до 30 раз превышает клеточные структуры макроорганизма. Согласно литературным данным общая площадь кожного покрова и слизистых оболочек человека достигает 500 м2.
Из этой площади поверхности 80 5 приходится на поверхность толстого и тонкого кишечника, 16 % на слизистую оболочку легких, 0,5% (2,5 м2 ) на поверхность кожного покрова и лиш 0,01% (0,03-0,05 м2 ) на полость рта.
Полость рта - открытый биотоп, обладающий свойствами своеобразного биологического термостата-инкубатора. Постоянная температура, влажность, благоприятные показатели рН, аэрация, наличие измельчённой пищи, пункты ретенции, создают благоприятные условия для колонизации, размножения и снабжения не только микробными ассоциациями, но и продуктами их жизнедеятельности.
Вполости рта человека в процессе онтогенеза постоянно формируется и совершенствуется микроэкологическая система защитной биопленки в пищеварительной и дыхательной системах. Биологическая пленка полости рта представлена ротовой жидкостью, в которую имплантированы многочисленные колонии индигенной микрофлоры. Защитная биопленка
15

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
содержит продукты метаболизма макроорганизма и его микрофлоры, ферменты, иммуноглобулины, иммунные клетки, полисахариды.
Плод человека имеет стерильные биотопы полости рта и носоглотки. Проходя через родовые пути матери при рождении, новорожденный, заселяет полость рта и носоглотку микробными ассоциациями биоценоза вагины запуская развитие индивидуального биоценоза, задающего, в свою очередь, алгоритм развития микробиоты организма и иммунитета. Поэтому строгое ограничение половых контактов роженицы, деконтаноминационнозаместительная терапия при необходимости, являются гарантией нормального естественного становления микробной экосистемы и иммунитета человека.
В естественных условиях микробиота защитной биопленки полости рта, в первую очередь, выполняет функцию противомикробного фильтра, предотвращающего колонизацию биотопа патогенными микроорганизмами, транслокацию и проникновение токсинов во внутреннюю среду организма, прежде всего в дыхательную и пищеварительную системы.
Посредством микробиоты биопленки организм человека регулирует иммунные ответы местного и системного уровней. Защитная биопленка – это активный сорбент, выводящий из организма токсины. Она поддерживает энергетический и трофический обмен веществ, выполняет роль специфического регулятора, поддерживающего гармонию взаимоотношений организма с собственной, индигенной микрофлорой биотопа полости рта, а также с транслоцировавшимися в биотоп во время приема пищи и дыхания микроорганизмами.
Из клинических наблюдений известно, что зубной налёт (dental plaqne), образованный микробиотой, наиболее часто локализуется на оральных поверхностях шеек нижних центральных резцов. Один грамм зубного налета, по данным разных авторов, содержит от 59 до 811 микробных тел. Зубной налет, «сползая» по поверхности эмали зубов в sulcus gingivae (SG), раздражает, вызывая воспалительный процесс, увеличивающий объем истекающего периодонтального ликвора в десятки раз. Установлено, что определяющим значением для здоровья человека обладают не только состав, но и локализация зубного налета, относительно поверхности эпителиального слоя слизистой оболочки полости рта.
В ходе развития пародонтита, микробиота зубного налёта пенетрирует дно SG, проникая под эпителий в строму соединительной ткани, вызывая в ней воспалительный процесс. Воспаление, в свою очередь, увеличивает объем истекающего ликвора, и таким способом улуч-
шает объем питательной среды микробиоты зубо-десневых карманов. Кроме того, воспалительный процесс дна SG стимулирует присущий эпителию SG, вызывает дефект эпителиального покрова дна SG, отсекает связки периодонта. Погружной рост эпителия ограничивают пределы компактной пластинки периодонтальной щели. Периодонт замещает грануляционная ткань, таким образом, значительно увеличивая площадь поверхности тканей, инфильтрируемых микробиотой зубного налета.
Таким образом, как можно постулировать, что основным патогенетическим звеном, гранью преобразующей микробиоту зубного налета, образованного индигенной микробиотой полости рта, является, во-первых, преодоление эпителиального покрова, во-вторых, возникновение и распространение воспалительного инфильтрата, в соединительную ткань пародонта за зубодесневое соединение SG и проникновение в системный кровоток.
Площадь поверхностей периодонта зубов составляет 75 см2. Таким образом, если у пациента наблюдается атрофия половины (1/2) кости альвеолярного отростка челюсти, то инфицированная микробиотой зубного налета раневая поверхность составит от 30 до 40 см2. Такая площадь инфицированной раны значительно увеличивает риск транслокации представителей микробиоты зубного налета в системный кровоток. При этом если при генерализованных пародонтитах патологические десневые карманы достигают глубины 4-5 мм, то в совокупности они представляют собой хронически инфицированную рану площадью от 10 до 20 см2. Учитывая данные распространенности заболеваний пародонта и клинические наблюдения о том, что большинство пациентов обращаются за стоматологической помощью несвоевременно. Воспалительный процесс в полости рта может приводить к длительной выраженной бактериемии, существенно снижающей показатели иммунитета и истощению иммунной системы [10].
Микроорганизмы биотопа полости рота на фоне пародонтитов оказывают влияние на системное здоровье человека четырьмя путями: бактериемией, системной диссеминацией, локально образующимися медиаторами воспаления, провоцирующие аутоиммунные ответа, при аспирации бактериального содержимого и его попадание в органы дыхания и систему пищеварения [11].
Современные модели функционирования микробиоты биотопа полости рта, пищеварительной, дыхательных систем и кожного покрова, свидетельствуют о том, что местные антигены микробиоты, продуцируемые бактериальным налетом на внешних оболочках, обеспечивают не только местную толерантность, не
16

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
только местные, но и системные иммунные ре- |
цесс как локально, так и системно. Большинство |
||||
акции организма. Кроме того, местные антигены |
клеток пародонта, фибробластов тканей десны |
||||
микробиоты полости рта принимают активное |
секретируют простагландины, интерлейкины - 1 |
||||
участие в «системной передаче информации», |
бета, интерлейкина - 6, интерлейкина 8, фак- |
||||
реализуемую через серию ядерных факторов - |
тора некроза опухоли и гамма-интерферона. |
||||
каппа и бета - синтеза и секреции цитокинов и |
Медиаторы влияют на воспалительный процесс |
||||
хемокинов, регулирующих воспалительный про- |
как локально, так и системно (Таблица 1). |
||||
|
|
|
|
Таблица 1. |
|
|
Основные функции цитокинов в контексте патологических процессов |
||||
|
|
в стоматологии и заболеваний внутренних органов |
|||
|
|
|
|
|
|
|
Цитокины |
Основные источники |
|
ОСНОВНЫЕ ФУНКЦИИ |
|
|
|
|
|
|
|
|
Интерлейкин-1 |
Макрофаги |
Участвует в иммунных и воспалительных реакциях. |
|
|
|
|
|
Стимулирует продукцию белков острой фазы воспаления. |
|
|
|
|
|
Активирует покоящиеся Т-лимфоциты |
|
|
|
|
|
|
|
|
|
Интерлейкин – 2 |
Т-лимфоциты |
Фактор роста Т-лимфоцитов |
|
|
|
|
|
|
|
|
|
Интерлейкин – 3 |
Т-лимфоциты |
Полипотентный колоннестимулирующий фактор – |
|
|
|
|
|
стимулирует все ростки кроветворения |
|
|
|
|
|
|
|
|
|
Интерлейкин – 4 |
Т-лимфоциты |
Фактор роста и дифференцировки В-лимфоцитов; |
|
|
|
|
|
стимулирует синтез IgЕ; дифференцировку Т-лимфоцитов и |
|
|
|
|
|
созревание тучных клеток |
|
|
|
|
|
|
|
|
|
Интерлейкин – 5 |
Т-лимфоциты |
Фактор роста и дифференцировки В- лимфоцитов; |
|
|
|
|
|
стимулирует синтез IgА; фактор роста и дифференцировки |
|
|
|
|
|
эозинофилов |
|
|
|
|
|
|
|
|
|
Интерлейкин – 6 |
Макрофаги и |
Фактор дифференцировки В- лимфоцитов; участвует в |
|
|
|
|
Т-лимфоциты |
воспалительных реакциях; стимулирует продукцию белков |
|
|
|
|
|
острой фазы воспаления |
|
|
|
|
|
|
|
|
|
Интерлейкин – 7 |
Стромальные |
Фактор роста В- и Т лимфоцитов |
|
|
|
|
клетки костного мозга |
|
|
|
|
|
и тимуса |
|
|
|
|
|
|
|
|
|
|
Интерлейкин – 8 |
Макрофаги, |
Фактор хемотаксиса нейтрофилов |
|
|
|
|
Т-лимфоциты, |
|
|
|
|
|
фибробласты |
|
|
|
|
|
|
|
|
|
|
Интерлейкин – 9 |
Т-лимфоциты |
В сочетании с интерлейкином – 2, -3, -4 и эритропоэтином |
|
|
|
|
|
стимулирует кроветворение |
|
|
|
|
|
|
|
|
|
Интерлейкин – 10 |
Т-лимфоциты, |
Угнетает синтез интерферона гамма Тh2, экспрессию |
|
|
|
|
макрофаги |
антигенов HLA класса II, синтез медиаторов воспаления |
|
|
|
|
|
|
|
|
|
Интерлейкин – 11 |
Костный мозг и |
В сочетании с интерлейкином -3,-4 стимулирует |
|
|
|
|
фибробласты легких |
пролиферацию полипотентных стволовых клеток |
|
|
|
|
плода |
Фактор роста и дифференцировки мегакариоцитов. |
|
|
|
|
|
Стимулирует продукцию белков острой фазы воспаления. |
|
|
|
|
|
|
|
|
|
Интерлейкин – 12 |
В-лимфоциты, |
Стимулирует пролиферацию Тh2 и продукцию ими |
|
|
|
|
моноциты, марофаги, |
интерферона гамма. Активирует NK-лимфоциты. |
|
|
|
|
Т-лимфоциты |
|
|
|
|
|
|
|
|
|
|
Интерлейкин – 13 |
Т-лимфоциты |
Стимулирует экспрессию CD 23, CD 72 и антигенов HLA |
|
|
|
|
|
класса II на В- лимфоцитах. Стимулирует пролиферацию |
|
|
|
|
|
В-лимфоцитов и синтез IgЕ. |
|
|
|
|
|
|
|
|
|
Фактор некроза |
Моноциты и |
Участвует в иммунных и воспалительных реакциях; |
|
|
|
опухоли |
макрофаги, |
стимулирует продукцию белков острой фазы воспаления. |
|
|
|
|
Т-лимфоциты |
Обладает противоопухолевой активностью; активирует |
|
|
|
|
|
свертывающую систему крови; фактор хемостазиса |
|
|
|
|
|
моноцитов. |
|
|
|
|
|
|
|
|
|
Интерферон |
Лейкоциты и |
Обладает противовирусной и противоопухолевой |
|
|
|
альфа |
макрофаги |
активностью; повышает экспрессию антигенов HLA класса II |
|
|
|
|
|
на макрофагах; стимулирует макрофаги и NK-лимфоциты |
|
|
|
|
|
|
|
|
17

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
|
|
Продовження таблиці 1 |
|
|
|
Интерферон бета |
Фибробласты, |
Обладает противовирусной и противоопухолевой |
|
эпителитальные |
активностью; повышает экспрессию антигенов HLA класса II |
|
клетки |
на макрофагах; стимулирует макрофаги и NK-лимфоциты |
|
|
|
Интерферон |
Фибробласты, |
Антагонист интерлейкина – 4 и подавляет экспрессию CD 23 |
гамма |
эпителитальные |
и синтез IgЕ: мощный активатор макрофагов. |
|
клетки |
|
|
|
|
Трансформи- |
Т- и В-лимфоциты, |
Регулятор роста и дифференцировки разных типов клеток; |
рующий |
тромбоциты, |
стимулирует IgА; подавляет пролиферацию лимфоцитов и |
фактор роста бета |
остеоциты и другие |
активность цитотоксических лимфоцитов всех типов |
|
клетки |
|
|
|
|
Гранулоци-тарно- |
Т- и В-лимфоциты, |
Фактор роста колоний гранулоцитов и моноцитов; |
моноцитарный |
Тромбоциты, |
активирует фагоцитоз; стимулирует цитотоксическую |
колониестиму- |
остеоциты и |
функцию эозинофилов; индуцирует высвобождение |
лирующий фактор |
эпителиальные клетки |
гистамина базофилами и нейротоксина эозинофилов. |
|
|
|
Объясняется тесная корреляция между воспалением тканей пародонта и патофизиологией хронических воспалительных заболеваний организма двумя механизмами. Первый связан с влиянием микробиоты биотопа полости рта
ипродуктов ее жизнедеятельности на патогенез атеросклеротических бляшек при инфаркте миокарда.
Второй, установленным влиянием медиаторов воспаления, вызванных патогенами пародонта, на патогенез атеросклероза, сахарного диабета имеющих многофакторную этиологию. Эти внутренние болезни, как правило, возникают как следствие хронических заболеваний пародонта [13].
Установлена тесная связь между С-реак- тивным белком острой фазы сыворотки крови,
итяжестью заболевания пародонта. Обычно, С-реактивный белок активируется при травмах, инфицированных, некрозах и опухолях, связан сердечно-сосудистыми заболеваниями и сахарным диабетом. С-реактивный белок синтезируется в печени в ответ на отсутствие цитокинов, таких как интерлейкин – 1 альфа, интерлейкин
– 1 бета и интерлейкин – 6. В их продуцировании принимают участие ФНО-альфа, ФНО-бета, металопротеазы матрикса и фактор трансформированного роста [7].
Современные методы лечения направлены на снижение инфицирования пародонта, включающее в себе механическое удаление над- и поддесневых зубных отложений.
Предложенный нами метод лечения включает деконтанаминационно-заместительную терапию: последовательное использование местных противомикробных средств, таких как, например, нитрофлуроксазид, в течение 5-7 суток, а затем аппликации пробиотической микрофлоры, например, Симбитер-2 концентрат, на такой же срок. Для создания высокой местной концентрации противомикробного препарата и пробиотика использо-
вали тонкостенные каппы из термопласта. После такого лечения уменьшается количество и даже совсем исчезают «маркеры заболеваний пародонта», тем самым уменьшая риск возникновения острого коронарного синдрома и сахарного диабета [6].
Антимикробный и противовоспалительный - может дать применение пасты с триклозаном/ кополимером/фтором (Colgate Total). Триклозан подавляет освобождение простагландина Е2 из фибробластов тканей десен, что стимулируется интерлейкином – 1 бета, а также уменьшается образование интерлейкина 1-альфа и гамма-интерферона (IF-гамма). Местное действие специально синтезированного триклозана уменьшает частоту и предупреждает возникновение заболеваний пародонта [12, 18,19].
В течение 24 месяцев триклозан существенно улучшал гигиеническое состояние полости рта, состояние десен и парадонта в группах высокого риска – курильщиков [12].
Для больных инфарктом миокарда в анамнезе было характерно худшее состояние полости рта по сравнению с контрольной группой. Каким образом воспалительный процесс в пародонте влияет на атерогенез? Происходит стимуляция цитокинов в периферической крови. Которая, в свою очередь, стимулирует синтез в печени С-реактивного белка, который вызывает повреждение сосудов, тем самым стимулируется атерогенез, приводя к инсультам или инфаркту миокарда [14].
Pseudomonas aeruginosa, staphylococcus aureus и кишечные бактерии проявили способность колонизировать зубы. Цитокины – факторы воспаления продуцируются пародонтом и попадают в слюну, а затем и в дыхательные пути, вызывая обструктивную болезнь легких и нагноительные заболевания легких за счет недостаточности компонентов фактора Н комплимента или компонентов факторов R комплемента (Таблица 2).
18

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
Таблица 2.
Недостаточность компонентов комплемента в определении основных функций ротовой полости, стоматологической патологии и сопутствующих системных заболеваний
Недоста- |
|
|
|
точность |
Тип наследования |
Сопутствующие системные заболевания |
|
компонентов |
|||
|
|
||
комплемента |
|
|
|
С1q |
Аутосомно- |
Поражение кожи, как при красной волчанке, агаммаглобулинемия |
|
|
рецессивный |
|
|
|
|
|
|
R |
Аутосомно- |
Поражение кожи, как при красной волчанке, дерматомиозит, |
|
|
рецессивный |
рецидивирующие гнойные инфекции, гломерулонефрит, артрит |
|
|
|
|
|
C1s |
Аутосомно- |
Поражение кожи, как при красной волчанке |
|
|
рецессивный |
|
|
|
|
|
|
C2 |
Аутосомно- |
Рецидивирующие гнойные инфекции, поражение кожи, как |
|
|
рецессивный |
при красной волчанке, васкулиты, мезангиокапиллярный |
|
|
|
гломерулонефрит, полимиозит, лимфогрануломатоз, хронический |
|
|
|
лимфолейкоз, |
|
|
|
герпетиформный дерматит |
|
|
|
|
|
C3 |
Аутосомно- |
Рецидивирующие гнойные инфекции, поражение кожи, как при |
|
|
рецессивный |
красной волчанке |
|
|
|
|
|
C4 |
Аутосомно- |
Поражение кожи, как при красной волчанке, дерматомиозит, |
|
|
рецессивный |
васкулиты |
|
|
|
|
|
C5 |
Аутосомно- |
СКВ, рецидивирующая менингококковая инфекция |
|
|
рецессивный |
|
|
|
|
|
|
C6 |
Аутосомно- |
СКВ, рецидивирующая менингококковая инфекция, васкулиты, |
|
|
рецессивный |
системная склеродермия |
|
|
|
|
|
C7 |
Аутосомно- |
СКВ, рецидивирующая менингококковая инфекция, васкулиты |
|
|
рецессивный |
|
|
|
|
|
|
C8 |
Аутосомно- |
СКВ, рецидивирующая менингококковая инфекция, пигментная |
|
|
рецессивный |
ксеродерма |
|
|
|
|
|
C9 |
Аутосомно- |
Рецидивирующая менингококковая инфекция |
|
|
рецессивный |
|
|
|
|
|
|
Ингибитор С1 |
Аутосомно- |
Наследственный отек Квинке, волчаночный нефрит |
|
|
рецессивный |
|
|
|
|
|
|
Фактор I |
Аутосомно- |
Рецидивирующие гнойные инфекции, крапивница |
|
|
доминантный |
|
|
|
|
|
|
Фактор Н |
Аутосомно- |
Рецидивирующие гнойные инфекции |
|
|
рецессивный |
|
|
|
|
|
|
ФакторD |
Аутосомно- |
Менингококковая инфекция |
|
|
рецессивный |
|
|
|
и аутосомно- |
|
|
|
доминантный |
|
|
|
|
|
|
Пропердин |
Сцепленный с |
Менингококковая инфекция |
|
|
Х-хромосомой |
|
|
|
|
|
Заболевание легких, госпитальная пневмония и хроническая обструктивная болезнь легких связана с плохим состоянием полости рта.
Таким образом, зубной налет приводит к хроническому воспалению и гингивит - начальное проявление этого процесса. Избыточный местный ответ, включая синтез цитокинов и антител, в определенных условиях приводит к разрушению связок периодонта и опорного костного каркаса, вызывая пародонтит, связующее звено между системными заболеваниями – атеросклерозом, инфарктом миокарда, болезни легких [15].
Под регенерацией в стоматологии понимают восстановление структурных элементов тканей взамен погибших. Регенерация может происходить на разных уровнях (органа, ткани, клетки и т.п.). Однако во всех случаях речь идет о возмещении структуры, выполняющей специализированные функции. Иначе говоря, полноценная регенерация предполагает восстановление, как морфологии, так и функции [16].
В настоящее время в челюстно-лицевой хирургии разработаны методы хирургических вмешательств, предполагающие регенеративное течение послеоперационной фазы.
19

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
Различают три вида регенерации: физиологическую, репаративную восстановительную
ирепаративную патологическую. Говоря о направленной регенерации ткани, следует иметь ввиду полную репаративную регенерацию, для которой характерно замещение дефекта тканью, идентичной погибшей, т.е. восстановление костных структур пародонта, его связочного аппарата, цемента [4].
До недавнего времени регенерация рассматривалась в качестве завершающего этапа различных патологических процессов, когда с ее помощью организм после освобождения от омертвевших тканей устраняет образовавшийся дефект. Однако теперь на основе данных электронно-микроскопических исследований стало очевидным, что процесс регенерации запускается не на финальном этапе болезни, а в самом ее начале в качестве «противовеса» возникающему повреждению, который активно протекает на протяжении всего патологического процесса, становясь четко выраженным на его завершающей стадии. Поэтому возникла необходимость «управлять» регенерацией с самого начала процесса повреждения тканей [21].
Весь комплекс тканей, которые окружают зуб, называют пародонтом. В его сустав входят кость альвеолярного отростка челюсти, цемент корня зуба и периодонтальные связки [9].
Внастоящее время в пародонтологии для лечения заболеваний пародонта используют методы направленной регенерации тканей. Она применяется для изменения течения раневого процесса путем влияния на размножение и миграцию клеток.
Клетками «управляют», чтобы убедиться, что раневой процесс идет именно путем регенерации, т.е. восстановления архитектуры и функции тканей опорно-удерживающего аппарата зуба, а не репарации, которая, как известно, приводит к «починке», но не к реставрации околозубных тканей. Таким образом, направленная регенерация тканей увеличивает предсказуемость восстановления структур пародонта, разрушенных пародонтином [23].
Стремление к полному морфофункциональному восстановлению пораженных тканей (по большому счету, к выздоровлению) так же старо, как и сама медицина. Но систематическое исследование процессов регенерации началось лишь в конце XIX века. В начале XX века активно изучались процессы регенерации поврежденных мышц, нервных волокон, переломах костей
идр. Долгое время для лечения деструктивных заболеваний пародонта цель – регенерация пораженных тканей – не могла быть достигнута, поскольку применялось исключительно репаративными хирургическими методиками.
Исследования показали, что контакт альвеолярной кости к соединительной ткани десны и с поверхностью корня, освобожденной от перидонтальных волокон, не формирует прикрепление, а вызывает анкилоз и резорбцию корней зубов. Следовательно, необходимо было помешать срастанию, как эпителия, так и соединительной ткани и альвеолярной кости
собнаженной поверхностью корня. Выход был найден, когда была продемонстрирована способность клеток периодонтальной связки регенерировать с помощью целлюлозного фильтра; при этом удаляли с вестибулярной поверхности зубов альвеолярную кость, периодонт, цемент. Над каждым дефектом фиксировался целлюлярный фильтр. Раневая поверхность закрывалась слизисто-надкостальным лоскутом. Через 6 месяцев гистологически определялась регенерация альвеолярной кости, образование нового цемента с приросшими к нему волокнами периодонта.
Таким образом, периодонтальная связка способна восстанавливаться при условии ограничения десневого эпителия и соединительной ткани. Тем самым показана важность сохранения жизнеспособности периодонтальной связки для регенерации пародонта. Ткань периодонтальной связки содержит родительские клетки типа остеобластов, которые дифференцируются в остеобласты и цементобласты.
Основные показания для применения методики направленной регенерации тканей – это глубокие узкие двухили трехстеночные карманы, поражение функции 2-й степени на нижней челюсти.
Ход операции и использование методики направленной регенерации тканей у больных с прогрессирующим пародонтитом, например, в области нижнего резца сводится к следующему:
После откидывания полного лоскута необходимо полирование корня, инструментальная обработка костного канала, проведение скейлинга с удалением грануляционной ткани. Вокруг обработанного корня в виде манжетки укладывается целлюлярный фильтр вплоть до эмалево-цементной границы, окруженный своего рода воротничком, изолирующий как эпителий, так и соединительную ткань от контакта
споверхностью зуба. Затем ушивается лоскут. Через 3 месяца гистология показала наличие нового цемента с вросшими в него коллагеновыми волокнами.
Данная операционная техника называется направленной регенерацией тканей и после применения при этой технике нерезорбирующих мембран политетрафторэтилена и резорбирующих мембран, состоящих из животного или человеческого коллагена и синтетических
20
