
immunologia_N3-4_2010_block_210x297
.pdf
ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
|
При біохімічному дослідженні, що характе- |
мірно збільшена активність екскреторних фер- |
||||||||
ризує функціональний стан печінки, було вста- |
ментів – ЛФ та ГГТП (Р<0,05) та в низці випадків |
|||||||||
новлено, що вміст у сироватці крові фракції |
відімчалося підвищення рівня холестерину та |
|||||||||
прямого (зв’язаного) білірубіну був у більшості |
-ліпопротеїдів у сироватці крові. |
|
|
|||||||
випадків помірно підвищеним (Р<0,05) та скла- |
При проведенні імунологічного досліджен- |
|||||||||
дав від 8,3 до 8,9 мкмоль/л, активність АлАТ пе- |
ня до початку лікування у хворих на НАСГ, мали |
|||||||||
ревищувала верхню межу норми в 1,9–2,3 рази |
місце вірогідні зсуви з боку ЦПК, які характери- |
|||||||||
та АсАТ – в 1,7–2,0 рази, значення показника |
зувалися підвищенням вмісту у сироватці крові |
|||||||||
тимолової проби також були помірно підвище- |
концентрації прозапальних ЦК – як IL-1 , так і |
|||||||||
ними та складали від 6,4 од. до 8,8 од.; у біль- |
TNF (табл. 1). |
|
|
|||||||
шості пацієнтів, які були під наглядом, була по- |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
Таблиця 1 |
|
|
Концентрація прозапальних ЦК (IL-1 , TNF ) у сироватці крові хворих на НАСГ |
|||||||||
|
|
|
|
до початку лікування (M±m), пг/мл |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Цитокіни, пг/мл |
|
Норма |
|
|
Хворі на НАСГ |
|
Р |
|
|
|
|
|
|
(n=32) |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IL-1 |
|
18,2±1,6 |
|
55,7±2,0 |
|
<0,001 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
TNF |
|
58,0±1,8 |
|
101,4±3,7 |
|
<0,001 |
|
||
|
|
|
|
|
|
|
|
|||
Примітка: у табл. 1, 4 стовпчик Р відображає вірогідність розбіжностей кожного показника стосовно |
||||||||||
|
показника норми. |
|
|
|
|
|
|
|
||
|
Дійсно, з таблиці 1 видно, що кратність |
хворих на НАСГ, що свідчить про наявність хро- |
||||||||
збільшення рівня IL-1 у сироватці крові хво- |
нічного запального процесу. |
|
|
|||||||
рих на НАСГ складала стосовно норми 3,06 |
При повторному обстеженні хворих на НАСГ |
|||||||||
рази (Р<0,001). Аналогічні дані були встанов- |
на момент завершення лікування із застосуван- |
|||||||||
лені також стосовно вмісту у сироватці крові ін- |
ням загальноприйнятих препаратів, було вста- |
|||||||||
шого прозапального ЦК, а саме TNF (табл. 1). |
новлено, що лише у 6 (18,8%) осіб мало місце |
|||||||||
Так, кратність збільшення TNF в крові хворих |
нормалізація IL-1 у сироватці крові (дивись |
|||||||||
на НАСГ стосовно норми складала 1,75 рази |
табл. 2). В той самий час у решти 26 (81,2%) об- |
|||||||||
(Р<0,001). Таким чином, до початку проведення |
стежених хворих на НАСГ, відзначалися збіль- |
|||||||||
лікування виявлено суттєве підвищення вмісту |
шення відносно норми концентрації прозапаль- |
|||||||||
прозапальних ЦК (IL-1 , TNF ) у сироватці крові |
ного ЦК IL-1 у сироватці крові. |
|
|
|||||||
|
|
|
|
|
|
|
|
|
Таблиця 2 |
|
|
Градації рівня прозапального ЦК (IL-1 ) у сироватці крові у хворих на НАСГ після |
|||||||||
|
завершення загальноприйнятого лікування (M±m), пг/мл |
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
|
Цитокін, пг/мл |
|
|
Градації рівня у крові |
|
Хворі на НАСГ |
|
|
||
|
|
IL-1 , пг/мл |
|
(n=32) |
|
|
||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19,0-23,0 |
|
_6_ |
|
|
|
|
|
|
|
|
|
18,8 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
IL-1 |
|
|
23,1-28,0 |
|
_3_ |
|
|
|
|
|
|
|
|
9,4 |
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
(норма – |
|
|
|
|
|
|
|
|
|
|
|
|
28,1-33,0 |
|
_3_ |
|
|
|
||
|
18,2±1,6), пг/мл |
|
|
|
|
|
|
|||
|
|
|
9,4 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
градації норми: |
|
|
33,1-38,0 |
|
_3_ |
|
|
|
|
|
|
|
9,4 |
|
|
|
||||
|
(13,4-23,0) пг/мл |
|
|
|
|
|
|
|
|
|
|
|
|
38,1-43,0 |
|
_11_ |
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
34,4 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
43,1-48,0 |
|
_4_ |
|
|
|
|
|
|
|
|
|
12,5 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
48,1-53,0 |
|
_2_ |
|
|
|
|
|
|
|
|
|
6,3 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Примітки: у табл. 2 та 3: у чисельнику – абсолютна кількість хворих; у знаменнику – відносна (у %). |
|
|
||||||||
51

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
|
Близькі дані отримані нами також відносно |
у сироватці крові обстежених хворих відмічена |
|||
вмісту у сироватці крові хворих на НАСГ також |
лише в 7 осіб (21,9%) та суттєве зниження зна- |
||||
іншого прозапального ЦК – TNF (табл. 3). Дій- |
чень даного показника мало місце в 6 обстеже- |
||||
сно, з таблиці 3 видно, що на момент завершен- |
них хворих (18,8%), (табл. 3). |
||||
ня лікування повна нормалізація вмісту TNF |
|
|
|
||
|
|
|
|
Таблиця 3 |
|
|
Градації рівня прозапального ЦК (TNF ) у сироватці крові хворих на НАСГ |
||||
|
|
після завершення лікування (M±m), пг/мл |
|||
|
|
|
|
|
|
|
Цитокін, пг/мл |
Градації рівня у крові TNF , пг/мл |
Хворі на НАСГ |
|
|
|
(n=32) |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
38,0-46,5 |
|
7 |
|
|
|
|
21,9 |
|
|
|
|
|
|
|
|
|
TNF |
46,6-55,0 |
|
_6_ |
|
|
|
18,8 |
|
||
|
|
|
|
||
|
(норма – |
|
|
|
|
|
55,1-63,0 |
|
_10_ |
|
|
|
39,6±2,2), пг/мл |
|
|
||
|
|
31,3 |
|
||
|
|
|
|
|
|
|
градації норми: |
63,1-70,0 |
|
_5_ |
|
|
|
15,6 |
|
||
|
(32,2-46,5) пг/мл |
|
|
|
|
|
70,1-80,0 |
|
_2_ |
|
|
|
|
|
|
||
|
|
|
6,3 |
|
|
|
|
|
|
|
|
|
|
80,1-90,0 |
|
_1_ |
|
|
|
|
3,1 |
|
|
|
|
|
|
|
|
|
|
90,1-100,0 |
|
_1_ |
|
|
|
|
3,1 |
|
|
|
|
|
|
|
|
Таким чином, отримані дані дозволяють вважати, що проведення загальноприйнятого лікування не забезпечує нормалізації концентрації прозапальних ЦК (IL-1 , TNF- ) у сироватці крові обстежених хворих на НАСГ. Можна вважати, що збереження у більшості хворих на НАСГ при виписці зі стаціонару підвищеної концентрації прозапальних ЦК (IL-1 , TNF- ) обумовлює необхідність подальшого дослідження особливостей імунопатогенезу даної патології та розробки ефективних способів імунокорекції таких хворих.
ВИСНОВКИ
1.При імунологічному дослідженні хворих з загостренням НАСГ до початку проведення лікування було виявлено суттєве підвищення
концентрації прозапальних ЦК у сироватці крові - IL-1 в 3,06 рази, TNF - в 1,75 рази.
2.При проведенні загальноприйнятого лікування хворих на НАСГ відмічена деяка позитивна динаміка вивчених імунологічних показників, однак у більшості хворих при цьому не відбулося нормалізації концентрації вивчених прозапальних ЦК. Так, лише у 18,8% випадків у
хворих на НАСГ відмічалася нормалізація IL- 1 у сироватці крові, а у решти 81,2% - збе-
рігалося вірогідне збільшення концентрації прозапального ЦК IL-1 у сироватці крові стосовно норми; нормалізація вмісту TNF у сироватці крові обстежених хворих відмічена
лише в 21,9% випадків та суттєве зниження даного показника відносно вихідних значень мало місце у 18,8% випадків.
3.Виходячи з отриманих даних можна вважати, що застосування лише загальноприйнятого лікування не забезпечує відновлення проаналізованих показників імунного гоме-
остазу, зокрема концентрації прозапальних ЦК (IL-1 , TNF ) у сироватці крові хворих на НАСГ, що може бути підставою для вивчення доцільності включення сучасних імуноактивних препаратів до комплексу лікування таких хворих з метою нормалізації вивчених показників.
ЛІТЕРАТУРА
1.Бабак О.Я Хронические гепатиты / О.Я. Бабак - Киев: Блиц–Информ, 1999. – 208 с.
2.Возианов А.Ф. Цитокины. Биологические и противоопухолевые свойства / А.Ф. Возианов, А.К. Бутенко, К.П. Зак. – Киев: Наукова думка, 1998. – 313 с.
3.Гриневич В.Б. Неалкогольная жировая болезнь печени: клинико-социальные аспекты проблемы / В.Б. Гриневич, Е.И. Сас // Российские медицинские вести. - 2010. - Т. 15, № 1. - С. 54-62.
4.Дранник Г.Н. Клиническая иммунология и аллергология / Г.Н. Дранник. – Киев: Полиграф Плюс. – [3-е изд.], 2006. – 482 с.
52

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
5.Ивашкин В.Т. Неалкогольный стеатогепатит / В.Т. Ивашкин, Ю.О. Шупельникова // Болезни органов пищеварения. – 2003. - №2. – С. 41 – 45.
6.Клиническая иммунология и аллергология / под ред. Г. Лолора, Т. Фишера и Д. Адельмана: пер. с англ. – М.: Практика, 2000.
–806 с.
7.Мансуров Х.Х. Неалкогольный стеатогепатит – сравнительно новая патология в гепатологии / Х.Х. Мансуров // Проблемы гастроэнтерологии. – 2001. - №1-2. – С. 4-9
8.Москаленко В.Ф. Заболевания гепатобилиарной системы (распространенность, нерешенные проблемы) / В.Ф. Москаленко, М.В. Голубчиков: зб. наук. праць співроб. КМАПО ім. Шупіка. - 2000. - Вип. 9, Кн. 4. - С. 5-10.
9.Сергиенко В.И. Математическая статистика в клинических исследованй / В.И. Сергиенко, И.Б. Бондарева. —М.: Ботар Медицина, 2000. — 162 с.
10.Стандартизовані протоколи діагностики та лікування хвороб органів травлення: методичні рекомендації / Н.В. Харченко, Г.А. Анохіна, Н.Д. Опанасюк [та інш.] – Київ, 2005.
–56 с.
11.Степанов Ю.М. Современные взгляды на патогенез, диагностику и лечение неалкогольного стеатогепатита / Степанов Ю.М., Филиппова Ф.Ю. //Сучасна гастроентерологія. – 2008. - №3. – С. 18-24.
12. Тест |
системы |
ProCon |
IL1 |
(ИЛ-1 ), |
TNF |
(ФНО ), |
IL4 (ИЛ-4), |
IL10 |
(ИЛ-10) |
[Электронный ресурс]. – Режим доступа: http://www.protc.spb.ru/russian.html.
13.Унифицированные биохимические методы обследования больных: метод. рекомендации / Под. ред. Л.Л. Громашевской. – Киев: МЗ Украины, 1990. – 64 с.
14. Фадеенко Г.Д. Стеатогепатит. Биохимические маркеры и проблемы диагностики / Г.Д. Фадеенко, Н.А. Кравченко // Сучасна гастроентерологія. – 2006. – № 1. –
С. 8 – 13.
15.Філіппов Ю.О. Епідеміологічні особливості хвороб органів травлення та гастроентерологічна служба в Україні: здобутки, пробле-
ми та шляхи їх вирішення / Ю.О. Філіппов, І.Ю. Скирда // Гастроентерологія: міжвід. зб.
–Дніпропетровськ, 2005. – Вип. 36. – С. 9 - 17.
16.Ярилин А.А. Система цитокинов и принципы ее функционирования в норме и при патологии / А.А. Ярилин // Иммунология. – 1997.
–№ 5. – С. 7 – 14.
17.Adams L.A. Nonalcoholic fatty liver disease / L.A. Adams, P. Angulo, D. Lu, K. Undor – 2005.
–Vol. 172. – P. 899 – 905.
18.Angulo P. Nonalcoholic fatty liver disease / P. Angulo, K. Undor // J. Gastroenterol. Hepatol.
–2002. – Suppl. 17. – P. 187 – 191.
19.Charlton M. Nonalcoholic steatohepatitis - sometimes is more / M. Charlton // Congress of gastroenterology & Hepatology, 2001. – P. 283 – 289.
РЕЗЮМЕ
КОНЦЕНТРАЦИЯ ПРОВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ (IL-1 , TNF ) В СЫВОРОТКЕ КРОВИ
БОЛЬНЫХ НЕАЛКОГОЛЬНЫМ СТЕАТОГЕПАТИТОМ
Елизарова Т.А., Кузнецова Л.В.
Изучена концентрация провоспалительных цитокинов (IL-1 , TNF ) в сыворотке крови больных неалкогольным стеатогепатитом (НАСГ). Установлено достоверное повышение содержания IL-1 и TNF в сыворотке крови обследованных с обострением НАСГ. Применение общепринятого лечения не обеспечивает нормализации концентрации IL-1 и TNF в сыворотке крови больных НАСГ, что свидетельствует о целесообразности использования иммуноактивных препаратов, направленных на восстановление иммунного гомеостаза.
Ключевые слова: неалкогольный стеатогепатит, провоспалительные цитокины (IL-1 и TNF ), патогенез.
SUMMARY
CONCENTRATION OF PROINFLAMMATORY CYTOKINES (IL-1 , TNF ) AT SERUM OF THE
PATIENTS WITH NONALCOHOLIC STEATOHEPATITIS
Elisarova T.O., Kuznetsova L.V.
The concentration of proinflammatory cytokines (IL-1 , TNF ) at serum of teenagers with nonalcoholic steatohepatitis (NASH) was studied. It was set increase of IL-1 and TNF level at serum of patients with NASH. It was set that application of generally accepted therapy don’t provided normalization of concentration of IL-1 , TNF at serum of patients with NASH that needed to using of immunoactive preparation to normalization of immune homeostasis.
Key words: nonalcoholic steatohepatitis, proinflammatory cytokines (IL-1 , TNF ), pathogenesis.
53

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
УДК:576.8.097.29:612.017:576.3/.4:616-074/-078:061.6
МЕТОДИКА ДОСЛІДЖЕННЯ ЦИТОТОКСИЧНОЇ АКТИВНОСТІ ІМУНОКОМПЕТЕНТНИХ КЛІТИН МТТ-КОЛОРИМЕТРИЧНИМ МЕТОДОМ
ЛІСЯНИЙ М.І., ЛЮБИЧ Л.Д.
ДУ «Інститут нейрохірургії ім.акад.А.П.Ромоданова АМН України», відділ нейроімунології, Київ, Україна
В останній час все більшого поширення набувають неізотопні колориметричні методи оцінки цитотоксичної дії на клітини, такі як МТТколориметричний тест [9,13] та тест з нейтральним червоним [3], які є не менш чутливими, ніж класичні ізотопні методи [8].
Колориметричний метод із застосуванням МТТ (3-[4,5-диметилтіазол-2-іл]-2б5- дифенилтетразоліум бромід) вперше був запропонований Mossmann T. у 1983 р. [12] для визначення проліферації та життєздатності клітин. Метод засновано на тому, що мітохондріальні ферменти у життєздатних клітинах, в яких збережена мітохондріальна активність, перетворюють доданий в культуру клітин субстрат – МТТ-тетразолієву сіль жовтого кольору у кристалічний МТТ-формазан пурпурного кольору. Пізніше МТТ-метод знайшов своє застосування в експерименті in vitro для оцінки цитотоксичної активності макрофагів, цитотоксичних лімфоцитів та ЛАК-клітин [1,7,10,11], а також клітинної та лікарської цитотоксичності [5,6].
Метою нашої роботи була адаптація колориметричного МТТ-методу для дослідження специфічної алоцитотоксичної активності імунокомпетентних клітин експериментальних тварин-реципієнтів в алогенній системі в динаміці розвитку імунної відповіді на різні алоантигени донорів.
МАТЕРІАЛ І МЕТОДИ
За прототип нами було взято відомий протокол Шпакової А.П. та ін. (2000) [9], в якому розроблено МТТ-колориметричний метод визначення цитотоксичної активності природних кілерних клітин. Нам необхідно було адаптувати метод для визначення цитотоксичної активності імунокомпетентних клітин тварин-реципієнтів стосовно алогенних імунокомпетентних клітин тварин-донорів. Для досягнення мети нашого дослідження необхідно було вирішити наступні завдання: відпрацювати робочі концентрації клітин, що використовуються для постановки реакції в алогенній системі; знайти ефективне співвідношення ефектор-мішень, яке дозволить прослідкувати зміну цитотоксичної активності імунокомпетентних клітин у інтактних та дослідних тварин.
В якості клітин-ефекторів використовували лімфоцити лімфовузлів мишей-реципієнтів С57BL/6 експериментальних груп. В якості клітин-мішеней використовували лімфоцити лімфовузлів мишей-донорів СВА. Для цього виділяли лімфоцити лімфовузлів (n=6 від кожної тварини) мишей, підраховували кількість клітин у камері Горяєва з 3% розчином оцтової кислоти та кількість життєздатних клітин з 0,2% розчином трипанового синього. Життєздатність клітин у суспензіях складала (92,3+4,6)%.
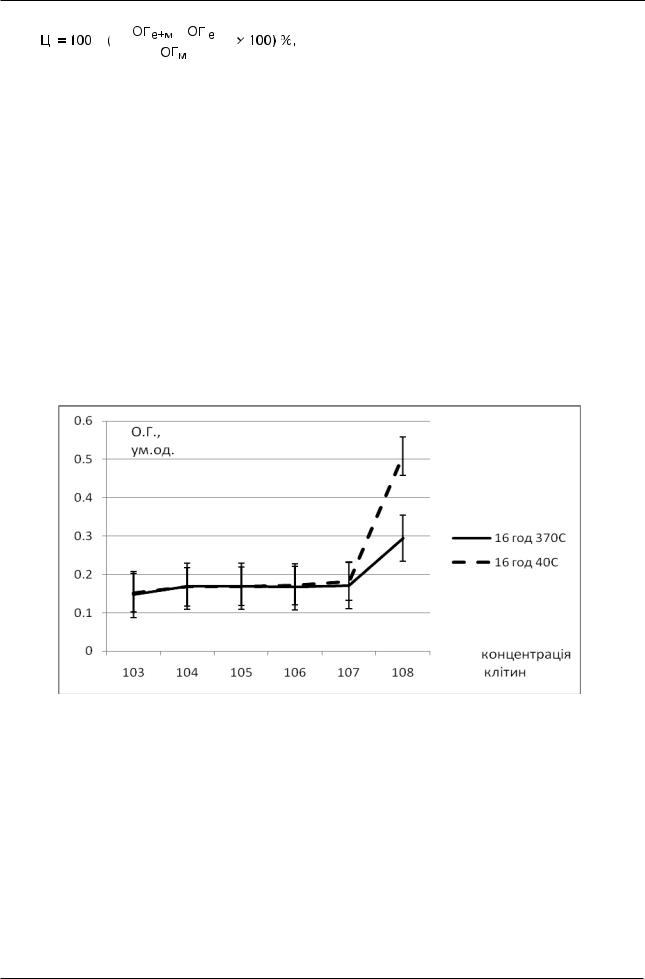
Дослідження залежності рівня продукції МТТ-формазана від кількості клітин у лунці. На першому етапі готували суспензії лімфоцитів лімфовузлів (n=12) мишей С57BL/6, СВА та нелінійних мишей у концентраціях 103, 104, 105, 106, 107, 108 клітин /мл та інкубували в середовищі RPMI + 10% ETC 16 год при 370С або 16 год при 40С. Для цього суспензії у вказаних концентраціях у кількості 100 мкл вносили у комірки планшетів та додавали 100 мкл середовища RPMI + 10% ETC. Після закінчення інкубації в комірки планшету додавали 20 мкл розчину реактиву МТТ (0,5 мг/мл) та інкубували ще 3 год при вищевказаних умовах. Після цього клітини осаджували центрифугуванням при 1000 об/хв протягом 15 хв, відбирали супернатант, додавали 150 мкл димексиду та інкубували 30 хв при 200С для розчинення гранул формазану. Інтенсивність сигналу в комірках реєстрували фотометрично при 570 нм за допомгою імуноферментного аналізатора Ц-01С.
Знаходження ефективного співвідношення ефектор-мішень для дослідження цитотоксичної активності імунокомпетентних клітин МТТколориметричним методом. На другому етапі відпрацьовували варіанти постановки МТТ-тесту з використанням різних співвідношень ефектормішень: 20:1, 10:1, 5:1. В якості клітин-мішеней використовували лімфоцити лімфовузлів інтактних мишей СВА (у концентрації 0,25х107), в якості клітин-ефекторів використовували лімфоцити лімфовузлів інтактних мишей С57BL/6 (у концентраціях 1,25х107, 2,50х107, 5,00х107 відповідно). Для постановки використовували протокол [9]. Цитотоксичність виражали цитотоксичним індексом (ЦІ) у відсотках:
54
ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
|
|
|
|
|
|
|
|
|
Суспензії лімфоцитів отримували з лімфовузлів |
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
(n=6) мишей шляхом механічної гомогенізації |
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
тканини лімфовузлів у середовищі RPMI з по- |
|||
Де ОГе+м - значення оптичної густини в лунках |
дальшим відмиванням і підрахунком клітин з 3% |
|||||||||||
розчином СН3СООН та 0,2% розчином трипано- |
||||||||||||
ефектори+мішені; |
|
|||||||||||
ОГ е - значення оптичної густини в лунках з ефек- |
вого синього. |
|
|
|||||||||
Внутрішньомозкова трансплантація клітин. |
||||||||||||
торами; |
|
|||||||||||
|
Різні типи клітин від мишей-донорів СВА вводи- |
|||||||||||
ОГм - значення оптичної густини в лунках з міше- |
||||||||||||
ли у праву півкулю мишей-реципієнтів С57BL/6 |
||||||||||||
нями. |
|
у кількості 1х10 |
6 |
клітин на тварину в об’ємі |
||||||||
|
|
|
|
|
|
|
|
|
|
|||
Моделювання алоімунної відповіді у експе- |
50,0 мкл. |
|
|
|||||||||
Експериментальних мишей С57BL/6 розді- |
||||||||||||
риментальних тварин. Дослідження |
розвитку |
|||||||||||
лили на групи: |
|
|
||||||||||
клітинної імунної відповіді на алоантигени про- |
|
|
||||||||||
1) внутрішньомозкове введення клітин лім- |
||||||||||||
водили після внутрішньомозкового |
введення |
|||||||||||
|
|
|
||||||||||
алогенних нейроклітин, клітин лімфовузлів до- |
фовузлів дорослих мишей СВА (на яких |
|
алоантигени представлені повноцінно); |
||
рослих тварин та фетальних нейроклітин (тер- |
||
2) внутрішньомозкове введення фетальних |
||
мін гестації 13-15 діб) на лінійних мишах. Контр- |
||
нейроклітин (Е13-15), отриманих з голов- |
||
олем слугували інтактні тварини. Всього дослі- |
||
ного мозку мишей СВА 13-15 доби ембрі- |
||
джено 158 тварин. |
||
онального розвитку; |
||
Отримання клітинних суспензій. Отримання |
||
3) внутрішньомозкове введення нейроклі- |
||
суспензій НКП з мозку мишей 13-15 доби емб- |
||
тин дорослих мишей СВА; |
||
ріонального розвитку та НК дорослих мишей |
||
4) інтактні тварини. |
||
проводили за методикою, описаною раніше [1]. |
||
|
Рис.1. Залежність продукції рівня МТТ-формазана від кількості лімфоцитів у лунці
Через 6, 12, 18 та 37 діб після трансплантації |
РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ ТА ОБГОВОРЕННЯ |
|
проведено дослідження цитотоксичної актив- |
І. Дослідження залежності рівня про- |
|
ності імунокомпетентних клітин лімфовузлів ре- |
||
дукції МТТ-формазана від кількості клітин |
||
ципієнтів стосовно клітин лімфовузлів донорів. |
||
у лунці. |
||
В якості клітин-ефекторів використовува- |
||
Результати дослідження суспензій (n=12) |
||
ли лімфоцити лімфовузлів мишей-реципієнтів |
||
лімфоцитів лімфовузлів мишей С57BL/6, СВА |
||
С57BL/6 експериментальних груп (у концентра- |
||
та нелінійних мишей представлено на рис.1. Як |
||
ції 1,25х107). В якості клітин-мішеней використо- |
||
вували лімфоцити лімфовузлів мишей-донорів |
видно, в середньому при обох використаних |
|
режимах інкубації (370С та 40С) рівень продукції |
||
СВА (у концентрації 0,25х107). Співвідношення |
||
ефектор-мішень складали 5:1. Цитотоксичний |
МТТ-формазану, що відображає активність |
|
мітохондріальних гідрогеназ, був на рівні плато |
||
тест проводили за протоколом [9]. |
||
|
55

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
при кількості клітин у лунці від 102 до 106 (або 103 до 107 клітин /мл суспензії), досягаючи лінійного зростання при кількості клітин у лунці від 106 до 107 (або 107 до 108 клітин /мл суспензії).
При цьому не виявлено міжлінійних відмінностей між клітинами мишей різних ліній, мала значення лише концентрація клітин у комірці. Таким чином, для отримання ефективного співвідношення ефектор-мішень і досягнення значущих і достовірних відмінностей між рівнем сигналу від заданих концентрацій клітин в подальшому використовували концентрації клітин в діапазоні від 107 до 108 клітин /мл суспензії.
Крім того, вказана закономірність спостерігалась при обох режимах інкубації: 16 год при
370С та 16 год при 40С; величина сигналу при другому режимі була в середньому достовірно вища, ніж при першому.
ІІ. Знаходження ефективного співвідно-
шення ефектор-мішень для дослідження цитотоксичної активності імунокомпетентних клітин МТТ-колориметричним методом.
На другому етапі відпрацьовували варіанти постановки МТТ-тесту з використанням різних співвідношень ефектор-мішень: 20:1, 10:1, 5:1. Результати представлені в табл.1. Як видно, значення цитотоксичного індексу інтактних тварин в алогенній системі достовірно відрізнялись при збільшенні співвідношення ефектор-мішень з 5:1 до 10:1 та 20:1, зростаючи в середньому від 35% (5:1) до 78% (10:1) та 89% (20:1).
Таблиця 1.
Залежність значення цитотоксичного індексу лімфоцитів лімфовузлів інтактних тварин в алогенній системі від кількісного співвідношення ефекторних клітин та клітин-мішеней
|
|
Співвідношення ефектор-мішень |
|
|
||
|
|
|
|
|
|
|
|
20:1 |
|
10:1 |
|
5:1 |
|
|
|
|
|
|
|
|
Цитотоксичний індекс, |
88.96± 4.93* |
|
78.24± 2.81* |
|
35,09±7,62 |
|
% (n=5) |
|
|
|
|||
|
|
|
|
|
|
|
*- достовірність різниці між групами (р<0,01) |
|
|
||||
|
|
|
|
|
Таблиця 2. |
|
Цитотоксична активність лімфоцитів лімфовузлів інтактних тварин в алогенній системі
№ |
ОГм |
ОГ е |
|
ОГ е+м |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
0,143 |
0,357 |
|
0,436 |
44,8 |
|
|
|||||
2 |
0,136 |
0,760 |
|
0,844 |
38,2 |
|
|
|||||
3 |
0,163 |
0,760 |
|
0,891 |
19,6 |
|
|
|||||
4 |
0,238 |
0,545 |
|
0,743 |
16,8 |
|
|
|||||
5 |
0,223 |
0,545 |
|
0,697 |
31,8 |
|
|
|||||
6 |
0,297 |
0,545 |
|
0,707 |
45,5 |
|
|
|||||
7 |
0,234 |
0,693 |
|
0,837 |
38,5 |
|
|
|||||
8 |
0,132 |
0,366 |
|
0,410 |
33,3 |
|
|
|||||
9 |
0,264 |
0,401 |
|
0,487 |
32.6 |
|
|
|||||
10 |
0,264 |
0,322 |
|
0,364 |
15,9 |
|
|
|||||
11 |
0,365 |
0,585 |
|
0,797 |
41,9 |
|
|
|||||
12 |
0,419 |
0,694 |
|
1,004 |
26,0 |
|
|
|||||
|
Середнє значення ЦІ,% |
|
32,08+8,38 |
|
||||||||
Примітка: ОГ е+м - значення оптичної густини в лунках ефектори+мішені; ОГ е - значення оптичної густини в лунках з ефекторами; ОГм - значення оптичної густини в лунках з мішенями.
Наші дані не протирічать даним [9], які показали наростання значення ЦІ при збільшенні співвідношення ефектор-мішень. Оскільки нашим завданням було знайти ефективне співвідношення ефектор-мішень, яке дозволить прослідкувати зміну цитотоксичної активності іму-
нокомпетентних клітин у інтактних та дослідних тварин, в подальшому використовували співвідношення ефектор-мішень 5:1, оскільки значення ЦІ, отримані при цьому співвідношенні, достовірно відрізнялись від тих, що були отримані при інших співвідношеннях.
56

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
ІІІ. Дослідження цитотоксичної активності |
достовірно знижувалась на 37-у добу (табл.3). |
|
імунокомпетентних клітин інтактних тварин |
Найвища цитотоксична активність зареєстро- |
|
МТТ-колориметричним методом. |
вана в групі реципієнтів лімфоцитів лімфовуз- |
|
Проведено 6 серій дослідів. В якості клітин- |
лів; ЦІ зростав з 6-ї по 12-у добу, досягаючи |
|
ефекторів використовували лімфоцити лімфо- |
максимуму, а в наступні терміни поступово до- |
|
вузлів інтактних мишей С57BL/6, в якості клітин- |
стовірно знижувався, проте не досягав контр- |
|
мішеней використовували лімфоцити лімфо- |
ольних значень на 37-у добу дослідження, до- |
|
вузлів інтактних мишей СВА. Співвідношення |
стовірно перевищуючи показники інтактних |
|
ефектор-мішень складали 5:1 (концентрація |
тварин. В групі тварин, яким було введено не- |
|
клітин-ефекторів у суспензії склала 1,25х107/ |
йроклітини дорослих донорів, цитотоксична |
|
мл, клітин-мішеней – 0,25х107/мл). Реакцію ста- |
активність лімфоцитів в МТТ-тесті демонстру- |
|
вили в 4-х повторах. Цитотоксичний тест прово- |
вала подібну динаміку, проте в усі терміни була |
|
дили за протоколом [9]. Результати наведені в |
нижча, ніж в групі тварин із внутрішньомозко- |
|
табл.2. |
|
вим введенням клітин лімфовузлів дорослих |
Як видно з табл.2, в наших дослідах цитоток- |
тварин, і знижувалась до контрольного рівня до |
|
сична активність інтактних мишей |
в алогенній |
37-ї доби спостереження. В групі тварин, яким |
системі в середньому становила (32,08+8,38)%, |
було введено фетальні нейроклітини (Е13-15), |
|
розмах індивідуальних коливань складав 15,9 – |
цитотоксична активність лімфоцитів на 12-у та |
|
45,5 %. |
|
18-у добу була найнижчою, достовірно відріз- |
ІV. Дослідження цитотоксичної активності |
няючись від показників інших груп, і досягала |
|
імунокомпетентних клітин експерименталь- |
контрольного рівня вже на 18-у добу, достовір- |
|
них тварин МТТ-колориметричним мето- |
но не відрізняючись від нього і в подальшому, |
|
дом. |
|
на 37-у добу дослідження. |
Встановлено, що клітини |
лімфовузлів |
Таким чином, з отриманих результатів ви- |
мишей-реципієнтів С57BL/6 усіх досліджених |
пливає, що клітинні реакції трансплантаційного |
|
груп демонстрували цитотоксичну активність |
імунітету мають місце при внутрішньомозково- |
|
у МТТ-тесті стосовно лімфоцитів лімфовузлів |
му введенні як нейроклітин та клітин лімфовуз- |
|
мишей-донорів СВА, яка зростала з 6-ї по 12-у |
лів дорослих тварин, так і фетальних нейроклі- |
|
добу після трансплантації, досягаючи в цей |
тин (Е13-15), і наростають з 6-ї по 12-у добу та |
|
термін максимальних значень, а в подальшому |
достовірно знижуються на 30-у добу (табл.3). |
|
Таблиця 3.
Цитотоксична активність лімфоцитів лімфовузлів мишей-реципієнтів C57Bl/6 стосовно лімфоцитів лімфовузлів мишей-донорів CBA (МТТ–тест,%)
Група |
|
Доба після трансплантації |
|
|
|
|
|
|
|
тварин |
6-a |
12-а |
18-а |
37-а |
|
5:1 |
5:1 |
5:1 |
5:1 |
|
|
|
|
|
1 |
47.60+ 3.17 > |
70,72+5,29 >@ |
59,36+9,97>& |
52,06+7,69*>^ |
|
|
|
|
|
2 |
56.63+ 4.58 > |
52,24+ 17,71 |
35,16+7,64*& |
41,96+ 4,78@ |
|
|
|
|
|
3 |
38.05+ 3.03 |
63,05+ 5,34 >@ |
47,78+8,66 |
34,78+5,21*^ |
|
|
|
|
|
4 |
|
32,08+8,38 |
|
|
|
|
|
|
|
Примітка: > - достовірність різниці у порівнянні з контролем (p<0,02); ^ - достовірність різниці між 1 і 3 групою (p<0,03);
& - достовірність різниці між 1 і 2 групою (p<0,03);
@ - достовірність різниці в межах однієї групи порівняно з 6-ю добою (p<0,04); *- достовірність різниці в межах однієї групи порівняно з 12-ю добою (p<0,04).
Отже, застосування відпрацьованих нами концентрацій клітин та співвідношення ефектормішень 5:1 дозволило виявити відмінності цитотоксичної активності імунокомпетентних клітин інтактних та дослідних тварин та простежити динаміку алоімунної відповіді після внутрішньо-
мозкової трансплантації клітин різних типів. Крім того, розроблені умови постановки методики дозволяють відстежувати як динаміку розвитку клітинної імунної відповіді на алоантигени, так і її інтенсивність в залежності від ступеня імуногенності алоантигенів.
57

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
ВИСНОВКИ
1.Досліджено залежність рівня продукції МТТформазана від кількості клітин у лунці і встановлено, що використання концентрацій клітин в діапазоні від 107 до 108 клітин /мл суспензії (106 – 107 клітин на комірку) дозволяє досягнути пропорційної залежності між рівнем інтенсивності сигналу та кількості клітин у комірці планшету.
2.Значення цитотоксичного індексу лімфоцитів лімфовузлів інтактних тварин в алогенній системі залежить від кількісного співвідношення ефекторних клітин та клітин-мішеней; ефективним є співвідношення 5:1; цитотоксична активність інтактних мишей в алогенній системі при цьому співвідношенні становила (32,08+8,38)%.
3.Застосування відпрацьованих нами концентрацій клітин та співвідношення ефектормішень 5:1 дозволило простежити динаміку імунної відповіді на алоантигени після внутрішньомозкової трансплантації клітин різних типів. Клітинна відповідь на алоантигени реципієнтів мала місце при внутрішньомозковому введенні як нейроклітин та клітин лімфовузлів дорослих тварин, так і фетальних нейроклітин (Е13-15) донорів. Найвищі значення цитотоксичної активності лімфоцитів реципієнтів реєструються на 6-12-у після внутрішньомозкового введення клітин.
4.Розроблені умови постановки реакції клітинної цитотоксичності з МТТ-реактивом дозволяють рекомендувати її до використання не лише для визначення активності природних кіллерів, а також і специфічної імунної відповіді на алота онкоантигени.
ЛІТЕРАТУРА
1.Борисевич Н.В., Шман Т.В., Алейникова О.В.
Структура первых рецидивов острого лимфобластного лейкоза у детей и оценка результатов их лечения с учетом МТТ-теста // Вопросы гематологии, онкологии и иммунопатологии в педиатрии.-2004.- Т.3, № 1.- С.95-98.
2. Изучение вариабельности интенсивности метаболизма МТТ в культуре клеток при оценке пролиферации и гибели клеток с помощью МТТ-теста / А.С.Макаренков, С.М.Терехов, Е.А.Калашникова, Т. Д. Смирнова // Цитология. — 2003, №9. — С.899.
3.Кузовкова Н.А. Оценка активности естественных киллеров колориметрическим методом // Иммунология.-1991.-№4. - С.59-61.
4.Лісяний М.І., Любич Л.Д. Особливості розвитку імунної відповіді на внутрішньо мозкове введення алогенних фетальних нейроклітин в експерименті // Імунологія та алергологія.- 2009.-№4.- С.99-109.
5.Оптимизация критических параметров МТТ-теста для оценки клеточной и лекарственной цитотоксичности / В.С.Черепович, Е.В.Волочник, Е.В.Антоненко, Е.С.Лоткова, Т.В.Романовская, В.В.Гринев // БМЖ.- 2006.-2(16).
6.ПашковаВ.С.,ФилипповаЛ.А.,ЛавреновА.Л.
Способ определения индивидуальной химиочувствительности опухоли у больных in vitro // Патент Российской Федерации на изобретение RU2094802. 1997.10.27.
7.Прогностическое значение определения чувствительности бластных клеток детей с острым лимфобластным лейкозом к химиопрепаратам in vitro / С.С.Кузнецова, А.Н.Иншаков, С.А.Маякова, Ю.В.Шишкин, А.Ю.Барышников // Российский биотерапевтический журнал.- 2004.-Т.3, №1.- С.61-67.
8.Тейлор П., Томас Д., Миллз К. Культивирование линий и клонов Т-клеток in vitro //В.кн. «Лимфоциты. Методы» П/р Дж.Клауса.-М.: «Мир».-1990.- С.208-229.
9.Шпакова А.П., Павлова К.С., Булычева Т.И.
МТТ-колориметрический метод определения цитотоксической активности естественных киллерных клеток // Клин.лаб. диагностика.-2000.-№ 2.-С.20-23.
10.A tetrazolium-based colorimetric MTT assay to quantitate human monocyte mediated cytotoxicity against leukemic cells from cell lines and patients with acute myeloid leukemia / A.A.Van de Loosdrecht, R.H.J.Beelenb, G.I.Ossenkoppele, M.G.Broekhoven, M.M.Langenhuijsen // J.Immunol.Meth. - 1994. - Vol. 174 (1-2).- P. 311-320.
11.Cell mediated cytotoxicity against U937 cells by human monocytes and macrophages in a modified colorimetric MTT assay / A.A.Van de Loosdrecht, E.Nennie, G.I.Ossenkoppele, R.H.Beelen, M.M.Langenhuijsen // J.Immunol. Meth.-1991.-Vol.141.-P.15-22.
12.MosmannT.Rapidcolorimetricassayforcellular growth and survival: application to proliferation and cytotoxicity assays // J.Immunol.Methods.- 1983.-Vol.65(1-2).-P.55-63.
13.Qing-xia Niu, Cheng-yan Zhao, Zhi-an Jing. An evaluation of the colorimetric assays based on enzymatic reactions used in the measurement of human natural cytotoxicity // J.Immunil. Meth.-2001.-Vol.251(1-2).-P.11-19.
58

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
РЕЗЮМЕ
МЕТОДИКА ИССЛЕДОВАНИЯ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТИ ИММУНОКОМПЕТЕНТНЫХ КЛЕТОК МТТ-КОЛОРИМЕТРИЧЕСКИМ МЕТОДОМ
Н.И.Лисяный, Л.Д.Любич
ГУ «Институт нейрохирургии им.акад.А.П.Ромоданова АМН Украины», отдел нейроиммунологии, Киев, Украина
Целью работы была адаптация колориметрического МТТ-метода для исследования специфической аллоцитотоксической активности иммунокомпетентных клеток животных экспериментальных групп в аллогенной системе при моделировании реакций трансплантационного иммунитета. Применение концентраций клеток в диапазоне от 107 до 108 клеток/мл и соотношения эффектор-мишень 5:1 позволило выявить отличия цитотоксической активности иммунокомпетентных клеток интактных и опытных животных и проследить динамику иммунного ответа на аллоантигены после внутримозговой трансплантации клеток разных типов.
SUMMARY
MTS COLORIMETRIC ASSAY FOR STUDY OF CYTOTOXIC IMMUNOCOMPETENT CELLS ACTIVITY
N.I.Lisyany, L.D.Lyubych
Acad.A.P.Romodanov Institute of Neurosurgery Acad.Med.Sci. of Ukraine, Neuroimmunology department, Kyiv, Ukraine
The purpose of paper was adaptation of colorimetric MTS assay for the study of specific allocytotoxic activity of immunocompetentcellsfromexperimentalanimalswithmodeled allogeneic immunity reactions following transplantation. The application of cell concentration from 107 till 108 cells/ml and effector-target ratio 5:1 allowed to detect distinction between allocytotoxic activity of immunocompetent cells from intact and experimental animals and to trace the dynamics of immune response to alloantigens after intracerebral transplantation of different cell types.
59

ІМУНОЛОГІЯ ТА АЛЕРГОЛОГІЯ: НАУКА І ПРАКТИКА. 3-4’2010
УДК 616.831-005.8-036.35-092-085:612.017.1
СТАН ІМУННОЇ СИСТЕМИ ТА ЦИТОКІНОВОГО СТАТУСУ У ХВОРИХ ПІСЛЯ ПЕРЕНЕСЕНОГО ГОСТРОГО ПОРУШЕННЯ МОЗКОВОГО КРОВООБІГУ ЗА ІШЕМІЧНИМ ТИПОМ
Н.Г.БИЧКОВА
Національний медичний університет імені О.О.Богомольця
Вступ. Судинні захворювання головного мозку завдяки високій розповсюдженості та значному рівню інвалідизації являють собою одну із важливих медико – соціальних проблем сьогодення, серед цереброваскулярних захворювань значну частину складають гострі порушення мозкового кровообігу (ГПМК), які щорічно вражають від 5,6 до 7,0 млн. людей та забирають життя у 4,6 млн. чоловік на планеті. Аналогічна ситуація і на України, де щорічно фіксується понад 150 тисяч інсультів, а смертність від цереброваскулярної патології займає друге місце в структурі загальної смертності населення нашої країни [1]. Дослідженнями останнього часу встановлено інтегральний зв’язок між морфофункціональними елементами нервової, ендокринної та імунної систем, про що свідчить наявність спільних рецепторів до лімфокінів, нейропептидів та нейрогормонів на плазматичних мембранах клітин нервової та імунної систем організму. Доведено, що нейроімунні зв’язки при різних захворюваннях нервової системи можуть змінюватись, і, тим самим, призводити до порушень функції імунної системи, розвитку аутоімунних реакцій до антигенів мозку та впливати опосередковано на виникнення ГПМК, його перебіг та наслідки. Не дивлячись на значні досягнення у вивченні патологічних процесів, що призводять до порушень функції імунної системи при виникненні ГПМК, його перебігу та ускладнень, багато питань залишаються невивченими, а значна їх частина потребує більш детального дослідження, на сучасному методичному рівні. Зокрема це стосується вивчення особливостей запально-нейроімунних порушень у хворих після перенесеного ГПМК на різних етапах реабілітації, залежно як від ступеня неврологічного дефіциту, так і глибини змін в імунній системі, локалізації ішемічного інсульту, розробки показань до імунокорекції та її обґрунтування і вибору.
Мета роботи – визначити стан імунного та цитокінового статусу у хворих після перенесеного ГПМК за ішемічним типом залежно від статусу неврологічних порушень в періоді ранньої реабілітації.
МАТЕРІАЛ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Обстежено 50 хворих після перенесеного ГПМК віком від 40 до 65 років та 25 здорових осіб, співставлюваних за віком та статтю. Комплексне
дослідження включало клініко – анамнестичне обстеження, КТ головного мозку або МРТ, що дозволило виявити ознаки ішемічного ураження різної локалізації та розміру. Ступінь порушень неврологічного статусу оцінювали за шкалою Бартеля та чотирьохбальної оцінки в день поступлення, та кожні 10 днів перебування в стаціонарі. Виражений ступінь порушень (F4) за шкалою чотирьохбальної оцінки мали 16 хворих (32%), помірний (F3) – 10 хворих (20%), легкий (F2) – 20 хворих (40%), 4 хворих (8%) порушень неврологічного статусу не мали (F1). Вміст основних та активованих популяцій та субпопуляцій лімфоцитів вивчали непрямим імунофлюоресцентним методом за допомогою моноклональних антитіл на аналізаторі Facscan (Beckton Dikinson) [2]. Сироваткову концентрацію інтерлейкіну-1 (ІЛ- 1 ), інтерлейкіну-6 (ІЛ-6), інтерлейкіну-4 (ІЛ-4) та фактору некрозу пухлин- (ФНП- ), вивчали імуноферментним методом за методикою, розробленою фірмою виробником, функціональну активність Т-лімфоцитів – за допомогою РБТЛ з ФГА [3], В-лімфоцитів – за продукцією сироваткових Ig G, Ig A, Ig M [4]. Концентрацію ЦІК визначали методом преципітації в розчині ПЕГ-6000 з виділенням фракцій ЦІК за молекулярною масою [5]. Вивчення фагоцитарної активності нейтрофілів оцінювали за ступенем поглинання часток латексу діаметром 1,2 мкм із обчисленням фагоцитарного індексу Гамбурга та фагоцитарного числа Райта [2]. Для оцінки обґрунтованості та достовірності отриманих результатів проводилась статистична обробка даних з використанням комп’ютерної програми Microsoft Excel.
РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ
Проведені дослідження стану клінічного та гуморального імунітету та цитокінового статусу у хворих із наслідками ішемічного інсульту виявили зміни у складі та функціональній активності популяцій СD3+, СD4+, СD8+ СD16+ та СD19+ лімфоцитів, активаційних молекул СD25+, СD54+ та СD95+, фагоцитарній активності нейтрофілів, рівні Ig G, Ig А та Ig M і ЦІК різної молекулярної маси, прозапальних (ФНП- , ІЛ-1 та ІЛ-6) та протизапальних (ІЛ-4) цитокінів залежно від ступеня неврологічних порушень.
В результаті проведених досліджень встановлено, що, незалежно від ступеня неврологічних порушень, кількість лейкоцитів та лімфоцитів у
60
