
- •Глава 8. Алициклические углеводороды и их производные
- •8.1. Номенклатура моно- и бициклических соединений
- •8.2. Пространственное строение и изомерия циклоалканов
- •8.2.1. Циклопропан
- •8.2.2. Циклобутан
- •8.2.3. Циклопентан
- •8.2.4. Циклогексан
- •8.3. Химические свойства
- •8.3.1. Реакции циклопропана, циклопропена и их производных
- •8.3.2. Реакции циклобутана и его производных
- •8.3.3. Реакции средних циклов
- •8.3.4. Реакции изомеризации цикла
- •8.4. Способы получения циклоалканов
- •8.5. Терпены и терпеноиды. Каротиноиды
- •8.5.1. Ациклические терпены и терпеноиды
- •3,7-Диметилоктадиен-2,6-ол-1
- •8.5.2. Моноциклические терпены и терпеноиды
- •8.5.3. Бициклические терпены и терпеноиды
- •8.5.4. Каротиноиды
- •8.6. Физиологическая роль и важнейшие представители
- •8.7. Стероиды
- •Вопросы и упражнения
8.3.2. Реакции циклобутана и его производных
Циклобутан значительно менее реакционноспособен, чем циклопропан. Реакции раскрытия цикла не протекают ни под действием галогенов, ни под действием галогеноводородов. Четырёхчленное кольцо разрушается только гидрированием на платине при значительном нагревании:
![]()
8.3.3. Реакции средних циклов
Для соединений со средним размером цикла (8—11 атомов) по сравнению с нормальными циклами (5—7 атомов) возрастает энергия напряжения до 40—52 кДж/моль. В больших циклах она уменьшается до 10 кДж/моль в циклододекане и затем до нуля в циклах большего размера.
Возрастание общей энергии напряжения в средних циклах обусловлено ростом торсионного напряжения и появлением трансаннулярного напряжения Прелога, характерного для ван-дер-ваальсова отталкивания атомов водорода или других групп, находящихся у пространственно сближенных противоположных концов кольцевых систем с восемью—одиннадцатью атомами углерода. Это, в свою очередь, является причиной целого ряда аномалий в химическом поведении функциональных производных средних циклов. Для них, например, наиболее характерны трансаннулярные реакции, когда происходят взаимодействия атомов или функциональных групп у атомов углерода, расположенных на противоположных концах цикла. Примером может служить трансаннулярное перемещение гидрид-иона при дегидратации 1-метилциклодекандиола-1,6:

1-метилциклодекандиол-1,6 6-метилциклодеканон
Другой пример — присоединение брома к цис-,цис-циклононадиену-1,5:

цис-,цис-циклононадиен-1,5

2,7-дибромбицикло[4,3,0]нонан
8.3.4. Реакции изомеризации цикла
Эти реакции характерны, как правило, для алициклических соединений, содержащих функциональные группы в боковой углеродной цепи. В таком случае для малых циклов протекают не только реакции раскрытия кольца, но и его расширения с образованием более устойчивых циклов. Например:

Механизм расширения трёхчленного цикла можно представить следующим образом:


Примером реакции расширения четырёхчленного цикла является нитрозирование первичного алифатического амина:

Не всегда изомеризация алициклического соединения сводится к расширению малого цикла. Перегруппировка Фаворского* — пример превращения 6-членного кольца в 5-членное. В эту реакцию вступают циклические -галогенокетоны с участием этилата натрия:


8.4. Способы получения циклоалканов
Циклопентан, циклогексан и их гомологи входят в состав некоторых нефтей. В связи с этим циклогексаны получают из продуктов переработки нефти. Циклопентаны тоже могут быть получены из нефти, но основное количество получают синтетическим путём.
Синтетические способы получения циклоалканов с малым, нормальным и средним размером цикла, а также алициклических соединений с кратными связями могут различаться в связи с их разной устойчивостью.
Лучшим способом получения циклопропана остаётся применённое в 1887 году Г. Густавсоном* действие цинковой пыли на спиртовый раствор 1,3-дибромпропана:
![]()
Другой способ создания трёхчленного кольца — взаимодействие 1,2-дибромэтана с малоновым эфиром в 50%-м водном растворе щёлочи в присутствии солей четвертичного аммония:


Для получения производных циклобутана здесь подходит способ с использованием натриймалонового эфира и 1,3-дибромпропана:

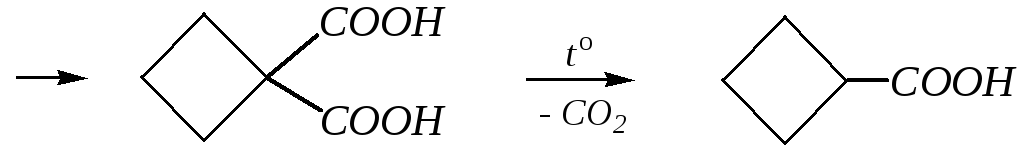
Производные циклопропана могут быть получены также присоединением карбена и дигалокарбенов (гл. 3.2.4) к алкенам. В настоящее время это наиболее распространённый общий способ синтеза производных циклопропана и построения циклопропанового кольца:

Эффективный способ превращения алкенов в производные циклопропана основан на реакции алкенов с метилендийодидом и сплавом цинка и меди:

Активной частицей в этой реакции является карбеноид — йодид йодметилцинка, образующийся при взаимодействии метилендийодида с металлическим сплавом:
CH2I2 + Zn(Cu) ICH2ZnI
Производные циклобутана и циклопентана, но не более высоких циклов, получаются с помощью модифицированной реакции Вюрца для циклизации 1,4- или 1,5-дигалогенопроизводных. Например:

Реакция протекает в очень мягких условиях и с высоким выходом.
Аналогично кетонам алифатического ряда некоторые циклические кетоны могут быть получены пиролизом кальциевых и бариевых солей карбоновых кислот (гл. 6.1.5). Для этого необходимо использовать соответствующие соли дикарбоновых кислот или нагревать кислоты с гидроксидом кальция или бария:

Механизм реакции приведён в свойствах карбоновых кислот и их производных (гл. 6.4.4.4). Однако если циклопентанон и циклогексанон получаются с выходом 80% при нагревании соответственно адипиновой и пимелиновой кислот с гидроксидом кальция или бария, то для реакции получения циклогептанона и циклооктанона выход падает до 20%, а циклические кетоны с n > 9 вообще не могут быть получены этим способом, так как выходы для высших кетонов не превышают 2—5%. Швейцарский химик Л. Ружичка* за эти работы и за исследования в области высших терпенов был удостоен в 1939 году Нобелевской премии.
Шестичленные циклы могут быть получены реакцией Дильса–Альдера (гл. 4.3.3).
Димеризацией и олигомеризацией сопряжённых диенов можно получить восьмичленные циклы и циклы большего размера. Например, димеризация бутадиена-1,3 в присутствии специфических комплексов никеля в качестве катализатора при температуре 350—370 К даёт цис,цис-циклооктадиен-1,5 с выходом 96% по схеме:

Однако другие никелевые комплексы катализируют тримеризацию бутадиена с образованием 12-членных циклов (циклододекатриенов-1,5,9). При этом в зависимости от условий (природа катализатора) образуются разные геометрические изомеры:

Конденсацией Дикмана* обычно получают пяти- и шестичленные циклы, а макроциклы могут быть получены в сильно разбавленных растворах. Это внутримолекулярная конденсация эфиров дикарбоновых кислот, она является частным случаем конденсации Кляйзена (гл. 6.4.4.3):

Механизм реакции аналогичен конденсации Кляйзена и включает в себя отрыв протона от -углеродного атома под действием алкоголятов.
Полученный эфир циклоалканонкарбоновой кислоты далее может быть гидролизован и декарбоксилирован с образованием соответствующих циклических кетонов:

Циклогексан и его производные могут быть получены каталитическим гидрированием ароматических соединений (см. далее в соответствующих главах). Как, например, циклогексан из бензола (гл. 9.5.1.2) или циклогексанол из фенола (гл. 10.5.3.5).
