
- •2. Основные теоретические положения курса органической химии
- •Отличительные особенности органических соединений обусловлены спецификой строения атома углерода
- •Теория строения органических соединений а.М. Бутлерова (1861 г.) Основные положения теории:
- •Классификация органических реакций
- •Классификация химических реагентов
- •Электронное строение атома углерода и его валентные состояния
- •Типы гибридизации атомных орбиталей в органических соединениях:
- •Характеристика ковалентной связи:
- •Электронные эффекты в органических соединениях:
- •2.1.1. Алканы (предельные углеводороды)
- •Электронное и геометрическое строение алканов
- •Природные источники алканов
- •Синтетические способы получения алканов
- •Химические свойства алканов
- •2.1.2. Алкены Общая формула CnH2n
- •Электронное и геометрическое строение алкенов
- •Способы получения алкенов
- •Химические свойства
- •2.1.3. Алкины Общая формула CnH2n-2
- •Электронное и геометрическое строение алкинов
- •Способы получения алкинов
- •Химические свойства
- •2.1.4. Алкадиены Общая формула CnH2n-2
- •Сопряженные алкадиены Электронное и геометрическое строение 1,3-бутадиена
- •Способы получения сопряженных алкадиенов
- •Особенности химических свойств сопряженных алкадиенов
- •Реакции полимеризации углеводородов
- •Полимеризация алкенов
- •Полимеризация алкадиенов
- •2.1.5. Ароматические углеводороды (арены) Общая формула CnH2n-6 Строение бензола
- •Изомерия и номенклатура
- •Химические свойства бензола
- •Механизм реакции:
- •Правила ориентации в реакциях электрофильного замещения
- •Способы получения бензола и его гомологов
- •Физические свойства углеводородов
Полимеризация алкадиенов
Цепная радикальная полимеризация 1,3 – бутадиена. Катализаторы: свободные радикалы, металлоорганические соединения, Na.
Пример:

2.1.5. Ароматические углеводороды (арены) Общая формула CnH2n-6 Строение бензола
К ароматическим углеводородам относятся бензол и его гомологи. Их производные называют ароматическими соединениями. Брутто-формула бензола С6Н6. Структурную формулу бензола как системы циклогексатриена впервые предложил немецкий химик Кекуле (1865 г.).
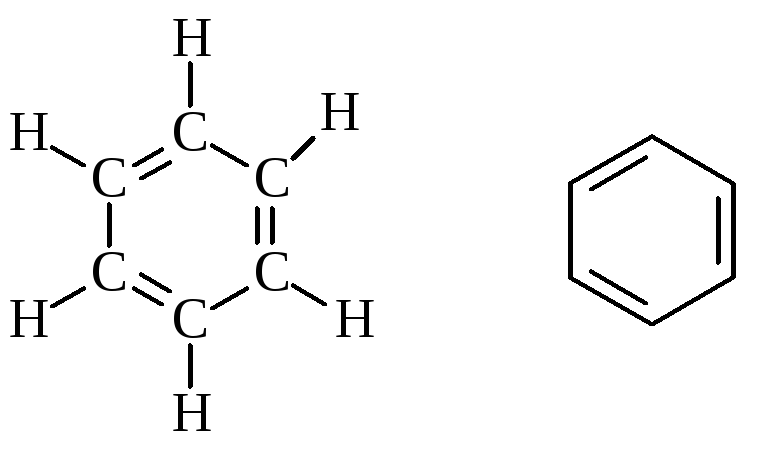
Однако несмотря на свою ненасыщенность бензол трудно вступает в реакции присоединения. Типичными для него являются реакции замещения атомов водорода. Для него характерна высокая термическая и химическая устойчивость. Противоречие между формальной ненасыщенностью и особыми свойствами ароматических углеводородов смогли объяснить только современные методы исследования органических молекул.
Электронографический метод анализа показал, что молекула бензола плоская. Все шесть атомов углерода объединены в правильный шестиугольник.
Все длины связей между атомами углерода равны 0.139 нм. Шесть атомов водорода связаны по одному с каждым атомом углерода и лежат на радиусах, направленных от кольца. Длины связей между атомами углерода и водорода равны и составляют 0.109 нм. Атомы углерода в молекуле бензола находятся в sp2 – гибридном состоянии. Каждый атом углерода образует по три - связи с соседними атомами. Углы между - связями - 1200. У каждого атома углерода остается по электрону на негибридизованной рz-орбитали. Все 6 рz – электроны не локализованы в парах, а взаимодействуют между собой и образуют непрерывную - систему.
Таким образом, молекула бензола имеет равномерное - сопряжение по всему циклу. Порядок связи составляет 1,5. Резкое понижение энергии молекулы бензола (возрастание ее термодинамической устойчивости) по сравнению с гипотетическим 1,3,5-циклогексатриеном на 152 кДж/моль является следствием ароматического - сопряжения.

В связи с вышесказанным структурную формулу молекулы бензола изображают следующим образом:

Таким образом, ароматические системы характеризуются следующими признаками:
геометрический признак: все ароматические системы имеют плоскую замкнутую в цикл сопряженную систему - электронов.
электронный признак: ароматическая молекула должна иметь число - электронов, равное величине (4n+2) (правило Хюккеля), где n – любое целое число (0, 1, 2, и т.д.). Для бензола n = 1.
химический признак: ароматические соединения в обычных условиях не способны к реакциям присоединения, а склонны к реакциям замещения по связям С-Н.
Изомерия и номенклатура
Гомологи бензола можно рассматривать как продукты замещения атомов водорода в бензольном ядре на алкильные группы Гомологи бензола называют , добавляя название алкильных радикалов (групп) к слову «бензол» с указанием цифрами их положения:

метилбензол ,2-диметилбензол 1,4-диметилбензол 1,3-диметилбензол
толуол орто-ксилол пара-ксилол мета-ксилол
Названия остатков аренов образуют с помощью суффикса ил (арил). Для некоторых остатков сохранились тривиальные названия:
 фенил бензил п-толил
м-толил о-толил
фенил бензил п-толил
м-толил о-толил
