
- •2. Основные теоретические положения курса органической химии
- •Отличительные особенности органических соединений обусловлены спецификой строения атома углерода
- •Теория строения органических соединений а.М. Бутлерова (1861 г.) Основные положения теории:
- •Классификация органических реакций
- •Классификация химических реагентов
- •Электронное строение атома углерода и его валентные состояния
- •Типы гибридизации атомных орбиталей в органических соединениях:
- •Характеристика ковалентной связи:
- •Электронные эффекты в органических соединениях:
- •2.1.1. Алканы (предельные углеводороды)
- •Электронное и геометрическое строение алканов
- •Природные источники алканов
- •Синтетические способы получения алканов
- •Химические свойства алканов
- •2.1.2. Алкены Общая формула CnH2n
- •Электронное и геометрическое строение алкенов
- •Способы получения алкенов
- •Химические свойства
- •2.1.3. Алкины Общая формула CnH2n-2
- •Электронное и геометрическое строение алкинов
- •Способы получения алкинов
- •Химические свойства
- •2.1.4. Алкадиены Общая формула CnH2n-2
- •Сопряженные алкадиены Электронное и геометрическое строение 1,3-бутадиена
- •Способы получения сопряженных алкадиенов
- •Особенности химических свойств сопряженных алкадиенов
- •Реакции полимеризации углеводородов
- •Полимеризация алкенов
- •Полимеризация алкадиенов
- •2.1.5. Ароматические углеводороды (арены) Общая формула CnH2n-6 Строение бензола
- •Изомерия и номенклатура
- •Химические свойства бензола
- •Механизм реакции:
- •Правила ориентации в реакциях электрофильного замещения
- •Способы получения бензола и его гомологов
- •Физические свойства углеводородов
Электронное и геометрическое строение алканов
Атомы углерода в алканах находятся в sp3-гибридизованном состоянии. В алканах имеются связи С-С и С-Н. В метане имеются только С-Н связи. Связи С-Н образуются путем перекрывания 2s АО атома водорода с sp3 гибридизованной АО атома углерода. Связи С-С образуются путем перекрывания sp3-гибридизованных орбиталей атомов углерода.
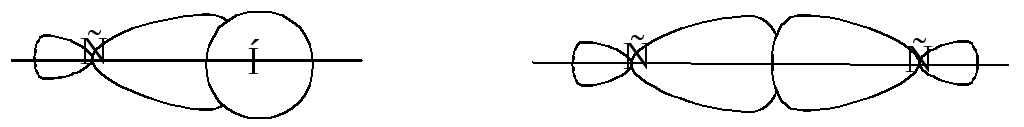
Перекрывание атомных орбиталей происходит по линии, связывающей ядра атомов. Такие связи называются -связями.
Направленность -связей в метане – к вершинам правильного тетраэдра под углом 1090, что соответствует направленности четырех sp3-гибридизованных атомных орбиталей атома углерода.

Длина связи между атомами углерода в алканах 0,154нм, длина связи между атомами углерода и водорода 0,112нм.
Природные источники алканов
Природными источниками алканов являются нефть и природный газ. Природный газ в основном состоит из метана (до 98%), этана, пропана. Эти же газообразные углеводороды растворены в нефти. Метан, выделяющийся в угольных шахтах, называется рудничным газом. В результате гниения целлюлозы без доступа воздуха также образуется метан, который выделяется со дна болот (болотный газ).
При перегонке нефти получаются продукты, представляющие собой смеси углеводородов, содержащих алканы. Такими являются: петролейный эфир (Ткип. 40-750С), бензин (Ткип. 70-1800С), керосин (Ткип. 180-2300С), дизельное топливо (Ткип. 230-3050С) и мазут. При перегонке мазута при пониженном давлении или с водяным паром получают соляровое масло, смазочные масла, вазелин, парафин.
Синтетические способы получения алканов
Гидрирование угля.
Гидрирование угля происходит под действием водорода только в присутствии катализаторов (оксиды и сульфиды молибдена, вольфрама, никеля) и при высоких температурах (450-4700С). Процесс проводят под давлением до 300 атм.:
nC + (n+1)H2 CnH2n+2.
В результате образуется смесь различных алканов, которая используется в качестве моторного топлива.
Гидрирование двуокиси и окиси углерода.

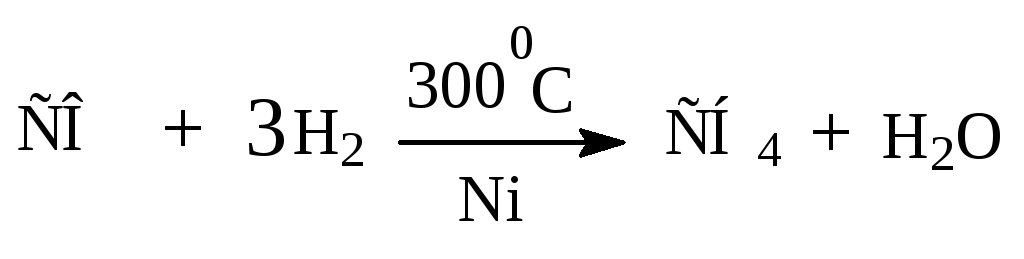
В присутствии катализатора, содержащего кобальт или железо, при температуре от 1800 до 3000С смесь СО и Н2 реагирует с образованием смеси алканов (синтин).
nCО + (2n+1)H2 CnH2n+2 + nН2О
Взаимодействие галогеналканов с натрием (реакция Вюрца).
Пример:
2CH3Br + 2Na CH3 - CH3 + 2NaBr
Реакция идет через образование промежуточного натрийорганического соединения.
CH3Br + 2Na CH3Na + NaBr
метилнатрий
CH3Na + CH3Br CH3 - CH3 + NaBr
Электролиз солей карбоновых кислот (реакция Кольбе).
В этой реакции анион карбоновой кислоты на аноде отдает электрон (окисляется), образуя свободный радикал, который разлагается на СО2 и алкильный радикал. Алкильные радикалы димеризуются.
Пример:

Декарбоксилирование карбоновых кислот.
При нагревании солей карбоновых кислот в присутствии щелочей при 2500-3000 С происходит их разложение, и выделяется алкан.
Пример:

Гидрирование ненасыщенных углеводородов
Примеры:


Химические свойства алканов
Слабая полярность -связей в алканах является причиной их малой реакционной способности. При обычных условиях на них не действуют окислители, восстановители, кислоты и щелочи.
Реакции радикального замещения атомов водорода.
Связи С-Н в алканах при sp3-гибридизованном атоме углерода малополярны, поэтому для них характерен гомолитический разрыв с образованием свободных радикалов:
Пример:
![]()
Такой разрыв связей происходит в реакциях галогенирования, нитрования, сульфохлорирования и сульфоокисления.
Галогенирование.
Гомолитический разрыв связей требует большой энергии активации, поэтому реакции радикального замещения проходят при высоких температурах или при облучении светом.
По уменьшению реакционной способности галогены располагаются в ряд: F2 Cl2 Br2. Иод не реакционноспособен.
Хлорирование и бромирование
При освещении смеси Cl2 (или Br2) и алкана светом подходящей длины волны протекают следующие элементарные реакции.
а) Инициирование цепной реакции:
![]()
Для гомолитического разрыва связи в молекуле хлора требуется 300кДж на 1 моль хлора. Время жизни хлор-радикала 10-2 сек.
б) Цикл цепной реакции (рост цепи):

в) Обрыв цепи:

Реакции, при которых стадия инициирования приводит к двум или более самоподдерживающимся реакциям (рост цепи), заканчивающиеся обрывом цепи, называются цепными. Реакция не останавливается на стадии получения только монохлорпроизводного:

По энергии С-Н связи в алканах отличаются друг от друга:
Тип связи Энергия связи (Е, кДж/моль)
Сперв.–Н 410
Свтор.–Н 390
Стрет.–Н 380
Таким образом, наиболее активными являются С-Н связи при третичном атоме углерода.
Фторирование
При взаимодействии алканов с фтором выделяется большое количество тепла, что приводит к расщеплению С-С связей.
СnH2n+2 + (n+1)F2 (2n+2)HF + nC
В связи с этим фторирование алканов проводят при разбавлении фтора азотом.
Нитрование.
При взаимодействии алканов с разбавленной азотной кислотой или оксидами азота при нагревании происходит замещение атомов водорода на нитро-группу, и образуются нитроалканы (метод Коновалова).
Пример:
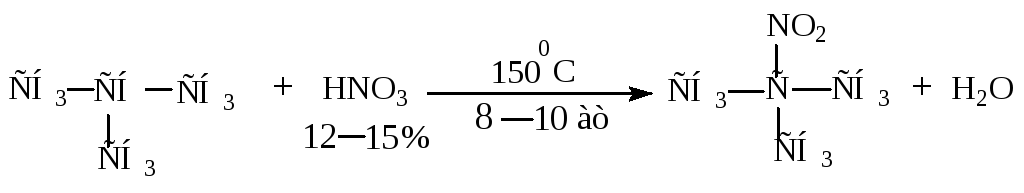
Сульфохлорирование.
Пример:
![]()
Сульфоокисление.
Алканы взаимодействуют с SO2 и O2 при ультрафиолетовом облучении. В результате образуются алкансульфокислоты.
Пример:

Реакции алканов с кислородом.
а) В присутствии кислорода воздуха алканы легко сгорают с образованием СО2 и Н2О и выделением большого количества тепла (46000-50000 кДж/кг). Эта реакция широко используется в энергетических целях. Такое сгорание происходит в двигателях всех типов. В двигателе внутреннего сгорания при сжатии смеси паров бензина с воздухом нормальные углеводороды образуют перекиси, вызывающие преждевременное воспламенение (без участия запальной свечи). Это явление называется детонацией и причиняет вред, так как способствует изнашиванию двигателя. Разветвленные алканы лишены этого недостатка. Особенно ценны в качестве моторного топлива углеводороды, имеющие четвертичный углеродный атом (с неоструктурой), например:

Изооктан был положен в основу условной шкалы оценки моторных топлив по «октановому числу». Ему было приписано октановое число 100, а
н-гептану – 0. Бензин сравнивают со смесью, содержащей а% изооктана и (100-а)% н-гептана. При одинаковом поведении обеих проб в двигателе бензину приписывают октановое число а.
В дизельных и ракетных двигателях, где ценной является способность топлива быстро загораться, самые ценные топлива состоят из нормальных углеводородов. В оценочной условной шкале «цетановых чисел» точка 100 соответствует алкану цетану н-С16Н34, а точка 0 – метилнафталину.
Смеси газообразных алканов с кислородом взрывоопасны.
б) Окислением алканов в газообразной или в жидкой фазе воздухом или кислородом в присутствии катализаторов могут быть получены продукты частичного окисления, в основном, карбоновые кислоты.
Пример: окисление н-бутана при 80-1000С, давлении 400атм, в присутствии в качестве ктализатора солей марганца или оксидов металлов (MnO2).


Реакция проходит с разрывом углерод-углеродных цепей.

в) Окислительный пиролиз метана.

г) Конверсия метана.

Эта реакция является главным источником СО и Н2, которые широко применяются в промышленных синтезах.
Термические превращения алканов.
При температуре выше 5000С алканы распадаются с выделением водорода и образованием углеводородов с более низкой молекулярной массой. Присутствие катализаторов уменьшает температуру распада. В этих реакциях происходит гомолитический разрыв связей С-С и С-Н. Термические превращения алканов называют крекингом. Термический и каталитический крекинг широко применяется в промышленности.
Труднее всего превращается метан.

Алканы с более длинной углеводородной цепью образуют ненасыщенные углеводороды или распадаются на углеводороды с меньшей молекулярной массой.
Примеры:
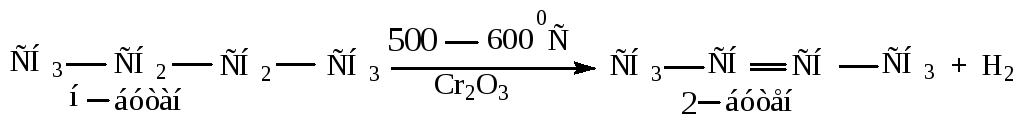
![]()
Алканы с шестью и более углеродными атомами в присутствии катализаторов способны к циклизации и образованию бензола и его производных – ароматических углеводородов.
Пример:

Эта реакция называется дегидроциклизацией или ароматизацией.
