
- •2. Основные теоретические положения курса органической химии
- •Отличительные особенности органических соединений обусловлены спецификой строения атома углерода
- •Теория строения органических соединений а.М. Бутлерова (1861 г.) Основные положения теории:
- •Классификация органических реакций
- •Классификация химических реагентов
- •Электронное строение атома углерода и его валентные состояния
- •Типы гибридизации атомных орбиталей в органических соединениях:
- •Характеристика ковалентной связи:
- •Электронные эффекты в органических соединениях:
- •2.1.1. Алканы (предельные углеводороды)
- •Электронное и геометрическое строение алканов
- •Природные источники алканов
- •Синтетические способы получения алканов
- •Химические свойства алканов
- •2.1.2. Алкены Общая формула CnH2n
- •Электронное и геометрическое строение алкенов
- •Способы получения алкенов
- •Химические свойства
- •2.1.3. Алкины Общая формула CnH2n-2
- •Электронное и геометрическое строение алкинов
- •Способы получения алкинов
- •Химические свойства
- •2.1.4. Алкадиены Общая формула CnH2n-2
- •Сопряженные алкадиены Электронное и геометрическое строение 1,3-бутадиена
- •Способы получения сопряженных алкадиенов
- •Особенности химических свойств сопряженных алкадиенов
- •Реакции полимеризации углеводородов
- •Полимеризация алкенов
- •Полимеризация алкадиенов
- •2.1.5. Ароматические углеводороды (арены) Общая формула CnH2n-6 Строение бензола
- •Изомерия и номенклатура
- •Химические свойства бензола
- •Механизм реакции:
- •Правила ориентации в реакциях электрофильного замещения
- •Способы получения бензола и его гомологов
- •Физические свойства углеводородов
2.1.3. Алкины Общая формула CnH2n-2
Простейшим алкином является ацетилен:
Гомологический ряд алкинов:
НС СН этин (ацетилен)
СН3-С СН пропин
СН3-СН2-С СН 1-бутин
СН3-С С-СН3 2-бутин
и т. д.
По номенклатуре ИЮПАК названия алкинов образуют от названий соответствующих алканов, заменяя суффикс «ан» на «ин». Суффикс «ин» обозначает присутствие тройной связи в цепи углеродных атомов. Для образования названия алкина выбирают самую длинную углеродную цепь, содержащую тройную связь. Углеродную цепь нумеруют таким образом, чтобы тройная связь получила наменьший номер.
Электронное и геометрическое строение алкинов
Атомы углерода, связанные тройной связью, находятся в sp – гибридизованном состоянии. Они образуют по две - связи sp – гибридизованными орбиталями атомов углерода. Валентный угол между - связями равен 1800. Молекула первого представителя алкинов – ацетилена линейная.

Оставшиеся у каждого атома углерода по две р – атомные орбитали при перекрывании образуют 2 - связи в двух взаимно перпендикулярных плоскостях ху и хz.

Энергия тройной связи равна 835 кДж/моль, энергия одной - связи – 260 кДж/моль (см. “Алкены”), тогда энергия второй - связи – 225 кДж/моль.
Длина тройной связи короче двойной (0.120 нм).
Способы получения алкинов
Реакции пиролиза (промышленный способ).
а) пиролиз метана:

б) пиролиз этана:

Получение ацетилена из карбида кальция:
CaC2 + 2H2O HC CH + Ca(OH)2
3. Из дигалогенопроизводных действием спиртового раствора щелочи.
Пример:
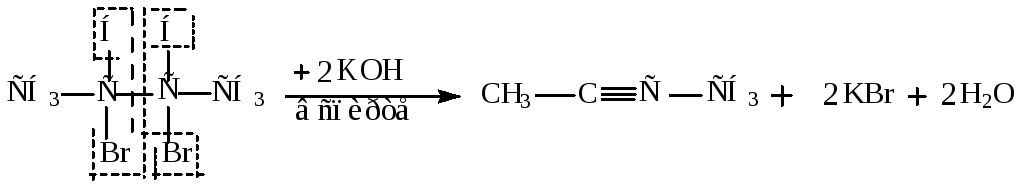
Алкилирование алкинов.
Алкилацетилены легко могут быть получены из ацетиленидов металлов и галогенопроизводных.
Пример:
HC C – Ag + CH3I HC C – CH3 + AgI
Химические свойства
Реакции электрофильного присоединения.
В реакциях электрофильного присоединения алкины менее реакционноспособны, чем алкены, так как электроны тройной связи располагаются ближе к ядру и труднее вовлекаются в химические превращения с участием электрофильных реагентов.
Присоединение галогенов (Cl2 и Br2):
Пример:

Присоединение галогеноводородов.
Пример:

Присоединение НBr проходит без участия катализатора.
Присоединение карбоновых кислот.
Пример:

Реакции нуклеофильного присоединения.
Ядра атомов углерода алкинов, находясь в sp – гибридизованном состоянии, благодаря линейному строению более доступны для нуклеофильных реагентов, чем алкенов, так как - электронное облако как бы втянуто внутрь молекулы.
Присоединение воды (реакция Кучерова).
Пример:

Присоединение спиртов (реакция Фаворского).
Пример:

Механизм реакции:

Присоединение HCN.
Пример:

Гидрирование алкинов.
Пример:

Окисление алкинов.
Окисление концентрированным раствором KMnO4 в кислой или щелочной среде при нагревании ( 1000С).
Пример:

Окисление разбавленным водным раствором KMnO4 при комнатной температуре.
Пример:

Кислотные свойства алкинов.
Алкины с концевой тройной связью – слабые СН - кислоты, так как связи Сsp – H сильно поляризованы.
R-C
CH
![]() H+
+ R-C
C-
H+
+ R-C
C-
Ацетилен и его монозамещенные вступают в реакции кислотного замещения протона со щелочными металлами, а также с ионами Cu+, Ag+, Hg2+ и др. Алкины не образуют солей (ацетиленидов) при действии щелочей. Ацетилениды образуются при действии на ацетилен и его монозамещенные щелочных металлов или их растворов в жидком аммиаке.
Примеры:
НС СН + Na НС С-Na+ + 1/2H2
НС СН + NaNH2 НС С-Na+ + NH3
Ацетилениды Na, Mg, Ca при взаимодействии с водой мгновенно гидролизуются до ацетилена и гидроксидов. Более устойчивы ацетилениды тяжелых металлов (Cu+, Ag+, Hg2+ и др.). Они образуются очень легко и выпадают в осадок при пропускании ацетилена в водно-аммиачный раствор AgCl, CuCl2 или в щелочной раствор реактива Несслера (HgI42-).
Пример:
НС СН + [Ag(NH3)2]+OH- НС С-Ag + 2NH3 + H2O
Осадок ацетиленида меди красно-фиолетового цвета, серебра – желтого, со временем переходящего в серый, ртути – белого. Эта реакция является качественной реакцией на концевую тройную связь. Ацетилениды меди и серебра устойчивы к действию воды и разрушаются с выделением ацетилена только при действии сильных кислот. В сухом виде они неустойчивы и взрываются при ударе.
