
- •2. Основные теоретические положения курса органической химии
- •Отличительные особенности органических соединений обусловлены спецификой строения атома углерода
- •Теория строения органических соединений а.М. Бутлерова (1861 г.) Основные положения теории:
- •Классификация органических реакций
- •Классификация химических реагентов
- •Электронное строение атома углерода и его валентные состояния
- •Типы гибридизации атомных орбиталей в органических соединениях:
- •Характеристика ковалентной связи:
- •Электронные эффекты в органических соединениях:
- •2.1.1. Алканы (предельные углеводороды)
- •Электронное и геометрическое строение алканов
- •Природные источники алканов
- •Синтетические способы получения алканов
- •Химические свойства алканов
- •2.1.2. Алкены Общая формула CnH2n
- •Электронное и геометрическое строение алкенов
- •Способы получения алкенов
- •Химические свойства
- •2.1.3. Алкины Общая формула CnH2n-2
- •Электронное и геометрическое строение алкинов
- •Способы получения алкинов
- •Химические свойства
- •2.1.4. Алкадиены Общая формула CnH2n-2
- •Сопряженные алкадиены Электронное и геометрическое строение 1,3-бутадиена
- •Способы получения сопряженных алкадиенов
- •Особенности химических свойств сопряженных алкадиенов
- •Реакции полимеризации углеводородов
- •Полимеризация алкенов
- •Полимеризация алкадиенов
- •2.1.5. Ароматические углеводороды (арены) Общая формула CnH2n-6 Строение бензола
- •Изомерия и номенклатура
- •Химические свойства бензола
- •Механизм реакции:
- •Правила ориентации в реакциях электрофильного замещения
- •Способы получения бензола и его гомологов
- •Физические свойства углеводородов
Особенности химических свойств сопряженных алкадиенов
Повышенная - электронная плотность у концевых атомов сопряженной системы алкадиена приводит к тому, что химические реакции электрофильного присоединения происходят в большей степени с участием 1,4 – атомов углерода, чем 1,2 или 2,3 – атомов.
Реакции электрофильного присоединения.
Присоединение галогенов (Cl2 и Br2)
Примеры:
![]()
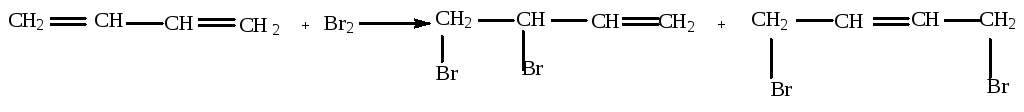
при 400С 20% при 400С 80%
при -800 80% при -800 20%
Cоотношение продуктов реакции определяется температурой реакции. При низких температурах больше продукта 1,2 - присоединения, скорость образования которого выше. При высоких температурах образуется термодинамически более стабильный продукт 1,4 - присоединения.
Присоединение галогеноводородов.
Пример:
CН2=СН-СН=СН2 + НCl СН3-СН=СН-СН2(Cl) + СН2=СН-СН(Cl)-СН3
3. Присоединение воды (катализатор H2SO4).
Пример:
CН2=СН-СН=СН2 + Н2О СН3-СН=СН-СН2(ОН) + СН2=СН-СН(ОН)-СН3
Гидрирование алкадиенов.
Алкадиены каталитически гидрируются с образованием алкенов и алканов (катализаторы Ni, Pd, Pt).
Пример:
CН2=СН-СН=СН2 + Н2 CН3-СН2-СН=СН2 CН3-СН2-СН2-СН3
Гидрирование водородом «в момент выделения».
Пример:
CН2=СН-СН=СН2 + 2[H] CН3-СН=СН-СН3
Диеновый синтез или реакции циклоприсоединения (реакции Дильса-Альдера).
Алкадиены могут присоединяться к двойной или тройной связи некоторых ненасыщенных соединений, либо вступают в такую реакцию друг с другом. Молекулы, не относящиеся к сопряженным алкадиенам, способные более или менее легко к ним присоединяться, называются диенофилами. Например, малеиновый ангидрид, акролеин, тетрацианоэтилен, акрилонитрил. Они реагируют с диенами при комнатной температуре или при легком нагревании. Реакции диенового синтеза стали одним из универсальных методов синтеза циклических соединений.
Пример:

Реакции полимеризации углеводородов
Реакции полимеризации – это взаимодействие двух или более ненасыщенных соединений или легко размыкаемых циклов, называемых мономерами, приводящее к образованию димеров, тримеров и т. д. вплоть до высокополимеров. Полимеризация никогда не сопровождается отщеплением атомов или молекул. Наоборот, она часто связана с присоединением по концам полимера так называемых концевых групп. Часто это осколки продуктов инициирования.
Полимеризация алкенов
Ступенчатая полимеризация.
Данному виду полимеризации не подвергаются этилен и пропилен. Катализатор реакции – H2SO4. На каждой стадии можно выделять продукты (димеры, тримеры и т. д.).
Пример:

При гидрировании этих димеров образуется изооктан.
Линейная цепная полимеризация.
Катализаторы: катионы или анионы (ионная полимеризация), радикалы (радикальная полимеризация), металлоорганические соединения (координационная полимеризация).

Пример свободнорадикальной полимеризации:
R-O-O-R 2RO -инициирование цепной реакции (свободные радикалы генерируют разложением пероксидов).
CH2 CH2 + RO RO-CH2-CH2 - рост цепи
RO-CH2-CH2 + CH2 CH2 RO-CH2-CH2-CH2-CH2 и т.д.
RO-CH2-CH2-[СН2-СН2]n-CH2-CH2
Обрыв цепи:
а) 2 RO-[СН2-СН2]n+1-CH2-CH2 RO-[СН2-СН2]n+1-CH2-CH2-[СН2-СН2]n+1-ОR
б)RO-CH2-CH2-[СН2-СН2]n-CH2-CH2 + OR RO-[СН2-СН2]n+1-CH2-CH2OR
в) 2 RO-[СН2-СН2]n+1-CH2-CH2 RO-[СН2-СН2]n+1-CH CH2 +
+ RO-[СН2-СН2]n+1-CH2-CH3
