
- •2. Основные теоретические положения курса органической химии
- •Отличительные особенности органических соединений обусловлены спецификой строения атома углерода
- •Теория строения органических соединений а.М. Бутлерова (1861 г.) Основные положения теории:
- •Классификация органических реакций
- •Классификация химических реагентов
- •Электронное строение атома углерода и его валентные состояния
- •Типы гибридизации атомных орбиталей в органических соединениях:
- •Характеристика ковалентной связи:
- •Электронные эффекты в органических соединениях:
- •2.1.1. Алканы (предельные углеводороды)
- •Электронное и геометрическое строение алканов
- •Природные источники алканов
- •Синтетические способы получения алканов
- •Химические свойства алканов
- •2.1.2. Алкены Общая формула CnH2n
- •Электронное и геометрическое строение алкенов
- •Способы получения алкенов
- •Химические свойства
- •2.1.3. Алкины Общая формула CnH2n-2
- •Электронное и геометрическое строение алкинов
- •Способы получения алкинов
- •Химические свойства
- •2.1.4. Алкадиены Общая формула CnH2n-2
- •Сопряженные алкадиены Электронное и геометрическое строение 1,3-бутадиена
- •Способы получения сопряженных алкадиенов
- •Особенности химических свойств сопряженных алкадиенов
- •Реакции полимеризации углеводородов
- •Полимеризация алкенов
- •Полимеризация алкадиенов
- •2.1.5. Ароматические углеводороды (арены) Общая формула CnH2n-6 Строение бензола
- •Изомерия и номенклатура
- •Химические свойства бензола
- •Механизм реакции:
- •Правила ориентации в реакциях электрофильного замещения
- •Способы получения бензола и его гомологов
- •Физические свойства углеводородов
2.1.2. Алкены Общая формула CnH2n
Простейшим алкеном является этилен: СН2 СН2
Гомологический ряд алкенов:
СН2 = СН2 этен (этилен)
СН3-СН=СН2 пропен (пропилен)
СН3-СН2-СН=СН2 1-бутен
СН3-СН=СН-СН3 2-бутен
По номенклатуре ИЮПАК названия алкенов образуют от названий соответствующих алканов, заменяя суффикс «ан» на «ен». Суффикс «ен» обозначает присутствие двойной связи в цепи углеродных атомов. Для образования названия алкена выбирают самую длинную углеродную цепь, содержащую двойную связь. Углеродную цепь нумеруют таким образом, чтобы двойная связь получила наменьший номер.
Примеры:



Электронное и геометрическое строение алкенов
Рассмотрим строение этилена. Атомы углерода в этилене находятся в sp2-гибридизованном состоянии. Каждый атом углерода образует по три -связи с использованием sp2-гибридизованных орбиталей. Угол между -связями близок к 1200. Молекула этилен плоская. Длина связи С=С равна 0.133 нм.

Оставшиеся две pz – орбитали перекрываются между собой. “Боковое” перекрывание pz – атомных орбиталей образует - связь. - Связи располагаются в плоскости ху, а - связь – в плоскости xz. Величина энергии С=С связи равна 610 кДж/моль. Поскольку энергия связи С-С равна 350 кДж/моль, энергия - связи равна 260 кДж/моль. Меньшая энергия - связи объясняет способность алкенов к реакциям присоединения, протекающим с разрывом - связи. Электроны - связи находятся дальше атомных ядер, поэтому они более подвижны, чем электроны - связи, и более уязвимы для атаки реагентов. - Электроны играют роль экранирующей оболочки молекулы от атаки нуклеофильными реагентами. В связи с эти алкены взаимодействуют с электрофильными реагентами.
Способы получения алкенов
Дегидрирование и крекинг алканов.
Пример:

Отщепление воды от спиртов.
Пример:
![]()
Или:

H2SO4 и Al2O3 являются водоотнимающими средствами.
Отщепление галогеноводорода от галогеналкана.
Алкены образуются при воздействии на галогеналканы концентрированных спиртовых растворов щелочей.
Пример:
![]()
Наиболее легко отщепляется НI, затем HBr, труднее HCl. Не отщепляется HF.
Отщепление элементов стабильной молекулы (Н2О, галогеноводорода) от соседних атомов углерода происходит по правилу Зайцева. При этом водород легче всего уходит от наименее гидрогенизированного атома углерода (легче от третичного, затем вторичного и уже затем от первичного атома углерода).
Пример:

Отщепление галогена от дигалогеналканов.
Пример:

Гидрирование алкинов и алкадиенов.
Примеры:
![]()
![]()
Химические свойства
Реакции электрофильного присоединения.
Присоединение хлора и брома.
Иод не присоединяется по двойной связи, а в атмосфере фтора углеводороды сгорают.
Присоединение хлора и брома проходит в полярных растворителях (вода, спирты, уксусная кислота).
Пример:

Механизм реакции:
1 –стадия: быстрое и равновесное образование - комплекса или комплекса с переносом заряда.
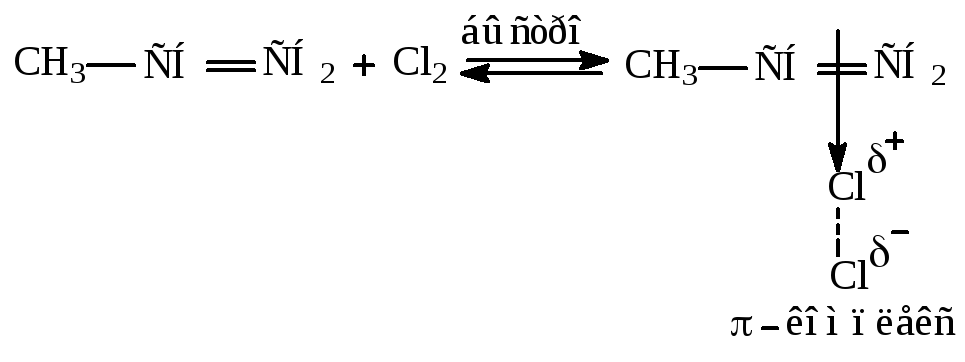
Под действием богатой электронами - связи связь между атомами хлора разрыхляется, и молекула хлора поляризуется. Поляризованная молекула
хлора взаимодейсвует с - связью.
2 – стадия: разрыв - связи в молекуле хлора и разрыв - связи алкена. Галоген вытягивает - электронную пару для образования связи C-Cl, при этом образуется карбокатион.

3 – стадия: быстрое взаимодействие карбокатиона с хлорид-анионом.

Присоединение галогеноводородов (в растворе и в газовой фазе).
Пример:

Присоединение галогеноводородов к несимметричным алкенам проходит по правилу Марковникова:
протон присоединяется к более гидрогенизированному атому углерода.
Эту направленность реакции можно объяснить с помощью классической электронной теории. Молекула несимметрично замещенного алкена поляризована, и алкильные группы как электронодонорные заместители определяют наиболее вероятное место присоединения протона.

Механизм реакции:
1 стадия: быстрое и равновесное образование - комплекса.

2 стадия: медленное образование карбокатиона.

Реакция проходит через образование наиболее стабильного вторичного карбокатиона (б). Его стабилизация достигается за счет (+I) – эффекта двух соседних электронодонорных метильных групп, тогда как в случае карбокатиона (а) сдвиг - электронной плотности происходит только от одной этильной группы.
3 стадия: быстрое взаимодействие карбокатиона (б) с анионом Х-.

По устойчивости карбокатионы располагаются в ряд:
трет. R+ втор. R+ перв. R+ СН3
Присоединение воды (реакция гидратации).
Присоединение воды происходит только в присутствии катализаторов (H2SO4, H3PO4 на силикагеле).
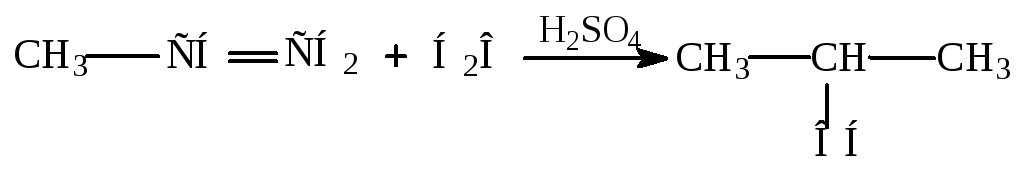
Роль H2SO4:

В промышленности реакцию проводят в газовой фазе.
Пример:

Окисление алкенов.
Окисление с помощью KMnO4 в водных растворах в слабощелочной среде при комнатной температуре.
Пример:

Окисление с помощью CrO3 в растворе уксусной кислоты или KMnO4 при нагревании.
Пример:

Окисление в присутствии солей палладия.
Пример:

Каталитическое окисление кислородом воздуха в присутствии Ag или надкислот.
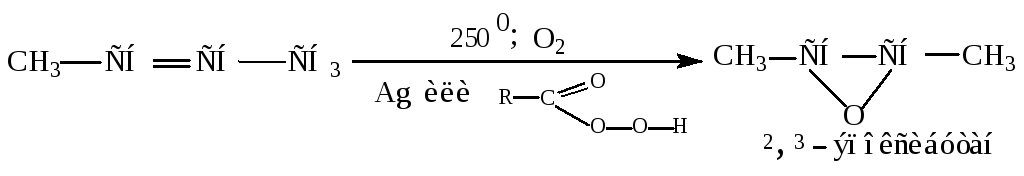
Реакция используется в лакокрасочной промышленности для получения эпоксидов.
Озонолиз.
Алкены легко реагируют с озоном и образуют взрывчатые соединения – озониды.
Пример:

Озониды при взаимодействии с водой гидролизуются с образованием карбонильных соединений (альдегидов и кетонов).

Гидрирование алкенов.
Гидрирование алкенов проходит с большим трудом в присутствии катализаторов (Pt, Pd, Ni) при 150-2500С.
Пример:

Реакции свободнорадикального присоединения.
Присоединение бромистого водорода в присутствии пероксидов (перекисный эффект Караша).
Пример:
![]()
Реакция идет в малополярных растворителях.
Механизм:

Реакция проходит через образование наиболее устойчивого радикала.
