
- •АЛКЕНЫ
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
Алкены
Химические свойства
21
Алкены
Химические свойства
22

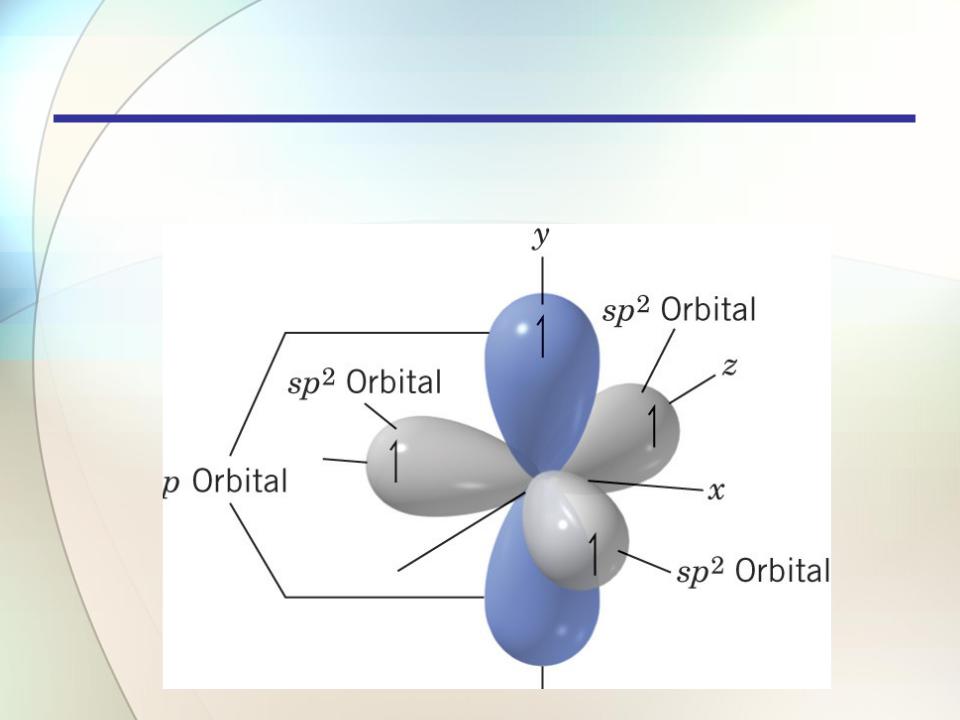
Алкены
H |
H |
С |
C |
H |
H |
|
.
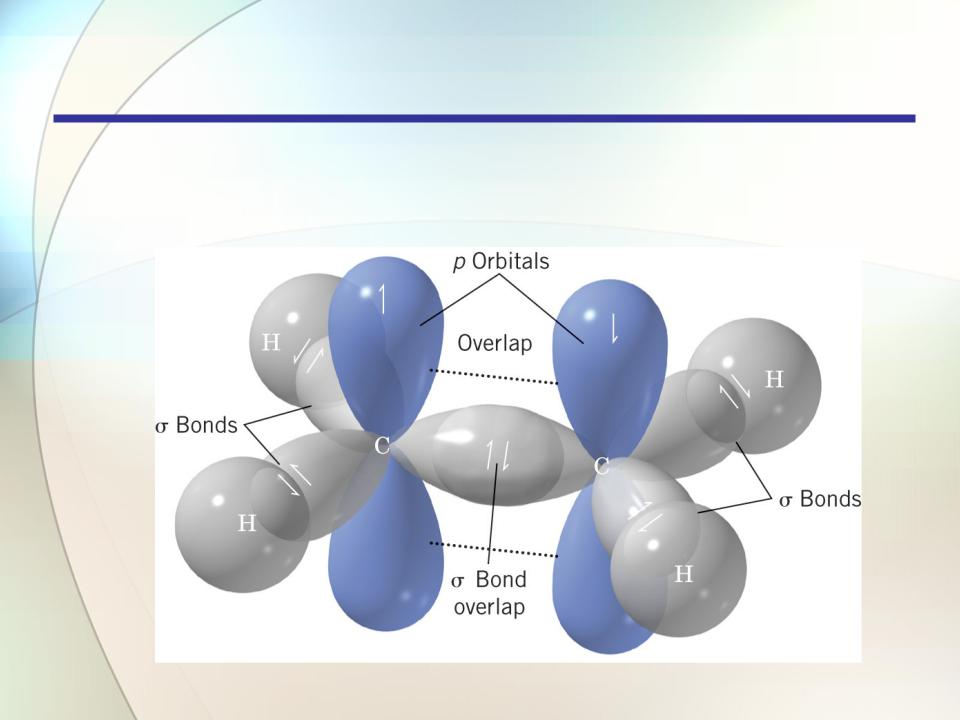
-Связь делает невозможным вращение вокруг связи углерод-
углерод; с этим связано явление геометрической изомерии. Таким образом, двойная углерод-углеродная связь построена из более прочной -связи (347 кДж/моль ) и менее прочной -
связи (264 кДж/моль ). Двойная углерод-углеродная связь в этилене короче, чем простая связь в этане.
23

Алкены
Химические свойства
|
. |
|
|
H |
0,109 í ì |
|
H |
. |
|
||
|
|
|
|
|
0,134 í ì |
C |
|
|
C |
117,5 Î |
|
H |
121,2 Î |
|
H |
-связь (347 кДж/моль)-связь (264 кДж/моль)
Двойная углерод- углеродная связь в этилене короче, чем простая связь в этане.
24

Алкены
Химические свойства
0,150.í ì |
0,153.í ì |
|
|
CH3 |
CH |
CH3 |
CH3 |
|
CH2 |
|
|
Расстояние С-Н в этилене равно 0,109 нм, что меньше, чем расстояние С-Н в этане (0,110 нм). Гибридизация атомов углерода в этих соединениях неодинакова. По сравнению с sp3- орбиталью, sp2-орбиталь имеет меньшую долю p- орбитали и большую долю s-орбитали. p-Орбиталь находится на большем расстоянии от ядра, чем s- орбиталь. По мере возрастания s-характера гибридной орбитали её эффективный размер уменьшается и одновременно уменьшается длина связи с другим атомом.
25

Алкены
Химические свойства |
|
|
С( sp) C( sp2 ) |
C( sp3 ) |
|
50 % |
33 % |
25 % |
Чем больше доля s-состояния в гибридной орбитали атома углерода, тем более электроотрицательным он будет
H
H C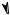 - CH = CH2 + I- и Mh - эффект метильной группы
- CH = CH2 + I- и Mh - эффект метильной группы
H
|
- |
+ _ |
||
или CH3 - CH = CH2 |
|
CH2 - CH = CH2 |
|
CH3 - CH - CH2 |
|
|
|||
|
+ |
|
|
|
|
|
H |
|
|
26

Алкены
Химические свойства
Типичными реакциями двойной связи являются реакции, в которых происходит разрыв -связи и образование вместо нее двух более прочных -связей. Такие реакции называются
реакциями присоединения. Они обозначаются символом Аd (Addition - присоединение).
|
|
|
|
|
|
|
X Y |
||||||
|
+ X |
|
|
|
|
|
|
|
|
|
|||
C |
C |
|
Y |
|
|
|
C |
|
C |
|
|||
|
|
|
|
|
|
||||||||
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||
27

Алкены
Химические свойства
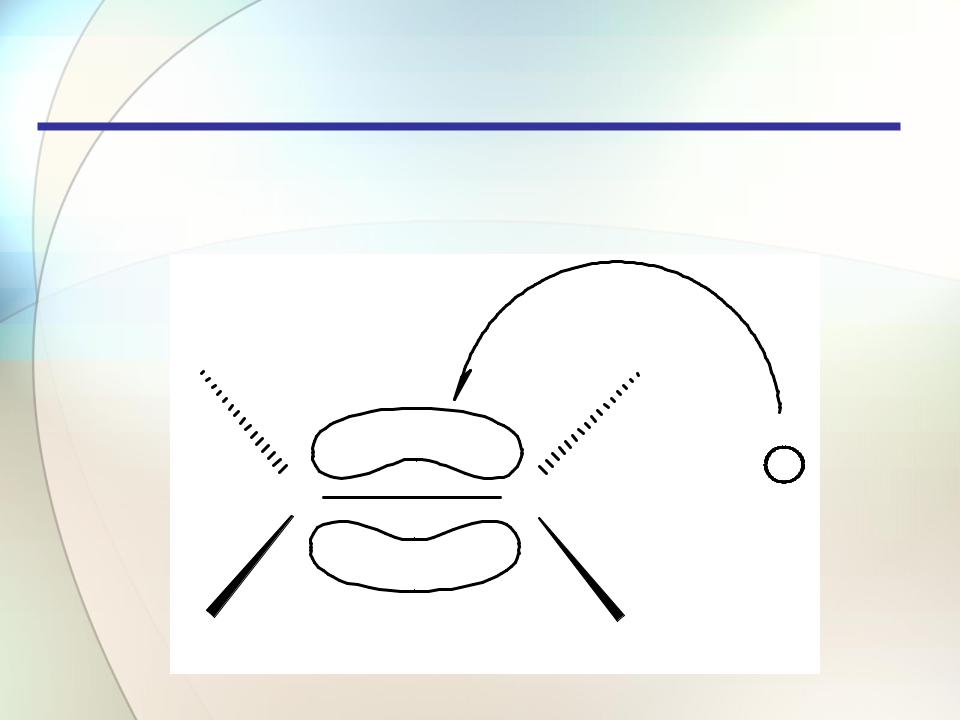
Облака -электронов находятся над и под плоскостью, в
которой лежат атомы углерода и водорода. Двойная углерод- углеродная связь служит донором электронов, т.е. ведет себя как основание (По Льюису, основание - соединение, предоставляющее пару электронов для образования связи, донор пары электронов; кислота - акцептор пары электронов).
Она реагирует с соединениями, которые обеднены электронами, т.е. с кислотами (по Льюису). Эти реагенты, не имеющие пары электронов, называются электрофильными реагентами (электрофил - любящий электроны). Следовательно, типичными реакциями алкенов являются реакции электрофильного присоединения (AdE).
28
Алкены
Химические свойства
H |
|
|
H |
|
|
+ |
|
|
С |
С |
|
|
X |
||
|
|
|
|
H |
|
|
H |
29

Алкены
Химические свойства
Существуют реагенты другого типа, также обедненные электронами, - свободные радикалы. С ними алкены вступают в реакции радикального присоединения (AdR) .
Большинство алкенов содержит алкильные группы, которые являются остатками алканов, следовательно, такие алкены могут подобно алканам участвовать в реакциях свободнорадикального замещения атома водорода в алкильном остатке (SR).
30
