
- •АЛКЕНЫ
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
- •Алкены
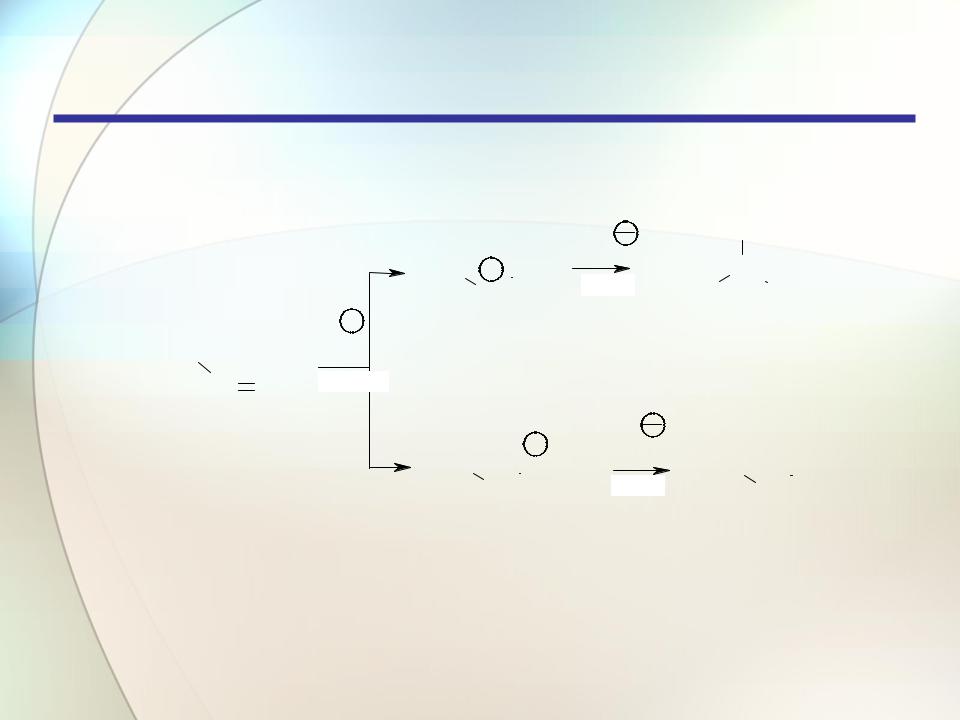
Алкены
Реакции электрофильного присоединения
|
(1) |
|
|
|
Cl |
Cl |
|
|
|
H3C |
+ CH3 |
CH |
|||
|
|
|
áû ñòðî |
||||
|
+ |
|
|
CH |
|
H3C |
CH3 |
I. H C |
Âòî ðè÷í û é |
2-Õëî ðï ðî ï àí |
|||||
H |
карбо катио н |
Î ñí î âí î é ï ðî äóêò |
|||||
3 HC CH |
м едлен н о |
ï ðèñî åäèí åí èÿ |
|||||
|
2 |
|
|
|
|
|
|
|
(2) |
H3C |
+ |
Cl |
H3C |
CH2Cl |
|
|
|
|
CH2 |
áû ñòðî |
|||
|
|
|
|
CH2 |
|
|
CH2 |
|
П ервичн ы й карбо кати- |
1-Õëî ðï ðî ï àí |
|||||
|
о н , м ен ее усто йчивы й |
|
|
||||
41
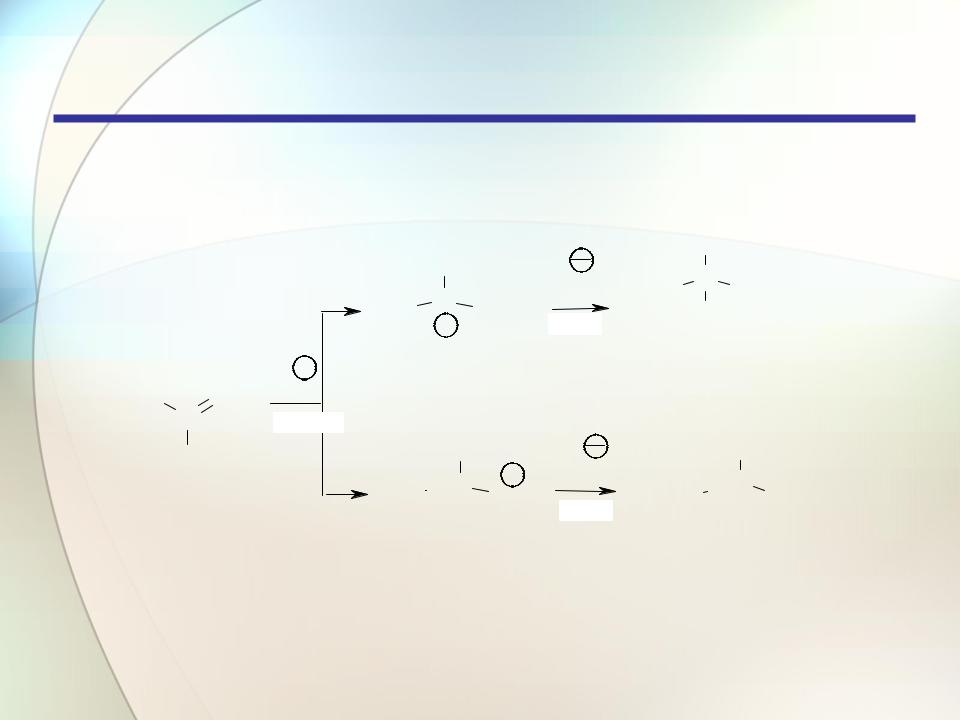
Алкены
Реакции электрофильного присоединения
|
|
|
|
(1) |
|
CH3 |
|
|
Cl |
|
|
|
|
H C |
C CH |
|
|||
|
|
|
|
|
3 |
|
|||
|
|
|
|
|
3 |
+ |
|
áû ñòðî |
|
|
|
|
|
+ |
Третичн ы й |
|
|
|
|
II. H C |
C |
CH |
2 |
H |
карбо катио н |
|
|
||
3 |
|
м едлен н о |
|
CH3 |
|
|
|
||
|
CH3 |
|
(2) |
|
+ |
Cl |
|||
|
|
|
|
|
H3C HC CH2 |
áû ñòðî |
|||
П ервичн ы й карбо кати- о н , м ен ее усто йчивы й
CH3
H3C CCl CH3
2-Ì åòèë-2-õëî ðï ðî ï àí Î ñí î âí î é ï ðî äóêò ï ðèñî åäèí åí èÿ
CH3
H3C HC CH2Cl
2-Ì åòèë-1-õëî ðï ðî ï àí
42
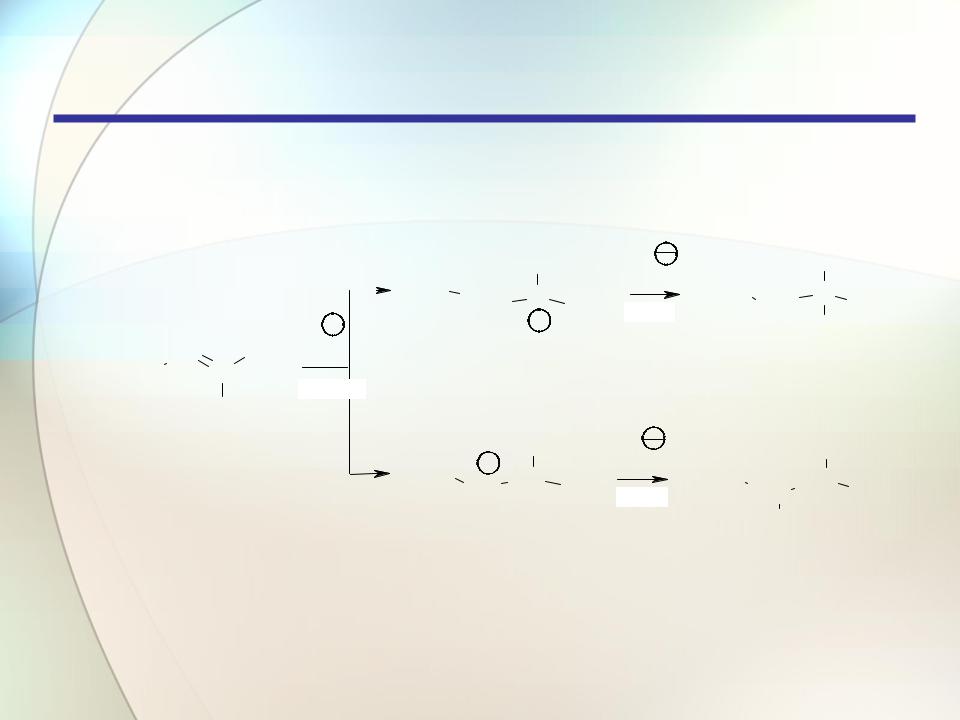
Алкены
Реакции электрофильного присоединения
|
|
|
|
(1) |
H3C |
|
|
CH3 |
|
|
|
|
|
|
H+ |
H |
C |
C |
CH |
3 |
|
III. |
HC |
|
CH3 |
|
2 |
|
+ |
|
||
|
|
Третичн ы й |
|
|||||||
|
H3C |
C |
|
м едлен н о |
|
карбо катио н |
|
|||
|
|
CH3 |
|
|
|
|
CH |
|
|
|
|
|
|
|
(2) H3C |
|
|
3 |
|
||
|
|
|
|
+ HC |
|
|||||
|
|
|
|
|
|
HC |
|
CH3 |
||
Вто ричн ы й карбо кати- о н , м ен ее усто йчивы й
Cl |
H3C |
|
CH3 |
|
CH2 |
C |
|
áû ñòðî |
|
Cl CH3 |
|
|
2-М етил-2-хло рбутан |
||
|
Î ñí î âí î é ï ðî äóêò |
||
|
ï ðèñî åäèí åí èÿ |
||
Cl |
|
|
CH3 |
áû ñòðî |
H3C HC HC CH3 |
||
|
|
Cl |
|
2-М етил-3-хло рбутан
43

Алкены
Реакции электрофильного присоединения
Состав продуктов реакции показывает, что в первой стадии вторичный карбокатион образуется быстрее, чем первичный по реакции 1, а третичный - быстрее, чем первичный и вторичный, как следует из реакций II и III.
Легкость образования карбокатионов увеличивается в следующей последовательности:
первичный < вторичный < третичный.
Устойчивость карбокатионов увеличивается в следующей последовательности:
первичный < вторичный < третичный.
44

Алкены
Строение карбокатиона
pz-орбиталь
H
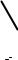 C +C
C +C



















sp3 sp2
45
Алкены
Реакции электрофильного присоединения |
|
||
H |
H |
R |
R |
H C + < R C < R C < R C |
|||
H |
H |
H |
R |
Подавая электроны на положительно заряженный атом углерода, алкильная группа в какой-то степени уменьшает его -заряд, сама
при этом приобретает некоторый положительный заряд. В третичном карбокатионе положительный заряд распределен между третичным углеродом и тремя алкильными группами, поэтому третичный карбокатион наиболее устойчив. Наоборот, метильный - наименее устойчив, т.к. в нем заряд локализован на одном атоме углерода.
46

Алкены
Реакции электрофильного присоединения
Устойчивость карбокатионов изменяется в таком же порядке, как и лёгкость их образования.
Чем устойчивее карбокатион, тем легче он образуется.
47

Алкены
Реакции электрофильного присоединения
Современная трактовка правила Марковникова
электрофильное присоединение к алкенам происходит через стадию образования более устойчивого карбокатиона.
48

Алкены
Индуктивный эффект – перераспределение электронной плотности внутри σ-связей, которое возникает вследствие разности величин электроотрицательности атомов, участвующих в этих связях.
(CH3)3C > (CH3)2CH > CH3CH2 > CH3 |
< CH2=CH < C6H5 < NH2 |
<OH < COOCH3 < Cl < F < CN < NO2 |
||
( +I ) |
|
|
|
( -I ) |
|
|
|
||
49

Алкены
Заместитель (Х), притягивающий электронную плотность -связи
сильнее, чем атом водорода, проявляет отрицательный индуктивный эффект (-I). Такие заместители в целом снижают электронную плотность системы и их называют электроноакцепторными (галогены, ОН, NO2, СООН, катионы и др.).
Если заместитель (Y) по сравнению с атомом водорода смещает электронную плотность -связи в сторону атома углерода цепи, то
он проявляет положительный индуктивный эффект (+I). Такие заместители ведут к повышению электронной плотности в цепи и называются электронодонорными. К их числу относятся алкильные группы, металлы и анионы.
50
