
- •Общая физика
- •Система отсчета. Материальная точка. Радиус-вектор и вектор перемещения, их связь с координатами точки.
- •Кинематика. 1.3
- •Кинематика. 1.4
- •Кинематика. 1.5
- •Кинематика. 1.6
- •Кинематика. 1.7
- •Кинематика. 1.8
- •Кинематика. 1.9
- •Кинематика. 1.10
- •Лекция 2
- •Кинематика. 2.2
- •Кинематика. 2.3
- •Кинематика. 2.4
- •Кинематика. 2.5
- •Кинематика. 2.6
- •Кинематика. 2.7
- •Кинематика. 2.8
- •Кинематика. 2.9
- •Кинематика. 2.10
- •Лекция 3
- •Динамика. 3.2
- •Динамика. 3.3
- •Динамика. 3.4
- •Динамика. 3.5
- •Динамика. 3.6
- •Динамика. 3.7
- •Динамика. 3.8
- •Динамика. 3.9
- •Динамика. 3.10
- •Динамика. 3.11
- •Замкнутая система материальных точек. Закон сохранения импульса. Момент импульса, закон сохранения момента импульса.
- •Законы сохранения. 4.2
- •Законы сохранения. 4.3
- •Законы сохранения. 4.4
- •Законы сохранения. 4.5
- •Законы сохранения. 4.7
- •Законы сохранения. 4.8
- •Законы сохранения. 4.9
- •Законы сохранения. 4.10
- •Законы сохранения. 4.11
- •Лекция 5
- •Законы сохранения. 5.2
- •Законы сохранения. 5.3
- •Законы сохранения. 5.4
- •Законы сохранения. 5.5
- •Законы сохранения. 5.6
- •Законы сохранения. 5.7
- •Законы сохранения. 5.8
- •Законы сохранения. 5.9
- •Законы сохранения. 5.10
- •Упругие и квазиупругие силы. Закон Гука. Гармонические
- •Колебания. 6.2
- •Колебания. 6.3
- •Колебания. 6.4
- •Колебания. 6.5
- •Колебания. 6.6
- •Колебания. 6.7
- •Колебания. 6.8
- •Колебания. 6.9
- •Колебания. 6.10
- •Лекция 7 Затухающие колебания. Коэффициент затухания и
- •Колебания. 7.2
- •Колебания. 7.3
- •Колебания. 7.4
- •Колебания. 7.5
- •Колебания. 7.6
- •Колебания. 7.7
- •Колебания. 7.8
- •Колебания. 7.9
- •Колебания. 7.10
- •Лекция 8 Вынужденные колебания. Резонанс
- •Вынужденные колебания. 8.2
- •Вынужденные колебания. 8.3
- •Вынужденные колебания. 8.4
- •Вынужденные колебания. 8.5
- •Вынужденные колебания. 8.6
- •Вынужденные колебания. 8.7
- •Вынужденные колебания. 8.8
- •Вынужденные колебания. 8.9
- •Вынужденные колебания. 8.10
- •Лекция 9
- •Основы МКТ. 9.2
- •Основы МКТ. 9.3
- •Основы МКТ. 9.4
- •Основы МКТ. 9.5
- •Основы МКТ. 9.6
- •Основы МКТ. 9.7
- •Основы МКТ. 9.8
- •Основы МКТ. 9.9
- •Основы МКТ. 9.10
- •Связь кинетической энергии молекул газа с температурой и
- •Основы МКТ. 10.2
- •Основы МКТ. 10.3
- •Основы МКТ. 10.4
- •Основы МКТ. 10.5
- •Основы МКТ. 10.6
- •Основы МКТ. 10.7
- •Основы МКТ. 10.8
- •Основы МКТ. 10.9
- •Основы МКТ. 10.10
- •Внутренняя энергия термодинамической системы. Теплоемкость. Работа, совершаемая газом при изменении объема
- •Термодинамика. 11.2
- •Термодинамика. 11.3
- •Термодинамика. 11.4
- •Термодинамика. 11.5
- •Термодинамика. 11.6
- •Термодинамика. 11.7
- •Термодинамика. 11.8
- •Термодинамика. 11.9
- •Термодинамика. 11.10
- •Лекция 12 Распределение молекул газа по скоростям. Функция
- •Распределение Максвелла. 12.2
- •Распределение Максвелла. 12.3
- •Распределение Максвелла. 12.4
- •Распределение Максвелла. 12.5
- •Распределение Максвелла. 12.6
- •Распределение Максвелла. 12.7
- •Распределение Максвелла. 12.8
- •Распределение Максвелла. 12.9
- •Распределение Максвелла. 12.10
- •Опыты Штерна и Ламмерта. Идеальный газ в поле силы тяжести, барометрическая формула. Распределения
- •Распределение Больцмана. 13.2
- •Распределение Больцмана. 13.3
- •Распределение Больцмана. 13.4
- •Распределение Больцмана. 13.5
- •Распределение Больцмана. 13.6
- •Распределение Больцмана. 13.7
- •Распределение Больцмана. 13.8
- •Распределение Больцмана. 13.9
- •Распределение Больцмана. 13.10
- •Лекция 14
- •Основы термодинамики. 14.2
- •Основы термодинамики. 14.3
- •Основы термодинамики. 14.4
- •Основы термодинамики. 14.5
- •Основы термодинамики. 14.6
- •Основы термодинамики. 14.7
- •Основы термодинамики. 14.8
- •Основы термодинамики. 14.9
- •Основы термодинамики. 14.10
- •Основы термодинамики. 14.11
- •Основы термодинамики. 14.12
- •Лекция 15 Электрические заряды. Точечный заряд. Закон Кулона.
- •Электростатика. 15.2
- •Электростатика. 15.3
- •Электростатика. 15.4
- •Электростатика. 15.5
- •Электростатика. 15.6
- •Электростатика. 15.7
- •Электростатика. 15.8
- •Электростатика. 15.9
- •Электростатика. 15.10
- •Лекция 16 Поток вектора напряженности электрического поля. Теорема
- •Электростатика. 16.2
- •Электростатика. 16.3
- •Электростатика. 16.4
- •Электростатика. 16.5
- •Электростатика. 16.6
- •Электростатика. 16.7
- •Электростатика. 16.8
- •Электростатика. 16.9
- •Электростатика. 16.10
- •Лекция 17 Работа сил электростатического поля. Потенциал.
- •Электростатика. 17.2
- •Электростатика. 17.3
- •Электростатика. 17.4
- •Электростатика. 17.5
- •Электростатика. 17.6
- •Электростатика. 17.7
- •Электростатика. 17.8
- •Электростатика. 17.9
- •Электростатика. 17.10
- •Лекция 18 Поле В. Сила Лоренца. Закон Био – Савара. Циркуляция и
- •Магнитное поле в вакууме 18.2
- •Магнитное поле в вакууме 18.3
- •Магнитное поле в вакууме 18.4
- •Магнитное поле в вакууме 18.5
- •Магнитное поле в вакууме 18.6
- •Магнитное поле в вакууме 18.7
- •Магнитное поле в вакууме 18.8
- •Магнитное поле в вакууме 18.9
- •Магнитное поле в вакууме 18.10
- •Лекция 19
- •Магнитное поле в вакууме 19.2
- •Магнитное поле в вакууме 19.3
- •Магнитное поле в вакууме 19.4
- •Магнитное поле в вакууме 19.5
- •Магнитное поле в вакууме 19.6
- •Магнитное поле в вакууме 19.7
- •Магнитное поле в вакууме 19.8
- •Магнитное поле в вакууме 19.9
- •Магнитное поле в вакууме 19.10
- •Магнитное поле в вакууме 19.11
- •Лекция 20 Сила Ампера. Работа поля В при перемещении контура
- •Магнитное поле в вакууме 20.2
- •Магнитное поле в вакууме 20.3
- •Магнитное поле в вакууме 20.4
- •Магнитное поле в вакууме 20.5
- •Магнитное поле в вакууме 20.6
- •Магнитное поле в вакууме 20.7
- •Магнитное поле в вакууме 20.8
- •Магнитное поле в вакууме 20.9
- •Магнитное поле в вакууме 20.10
- •Магнитное поле в вакууме 20.11
- •Магнитное поле в вакууме 20.12
- •Лекция 21
- •Диэлектрики 21.2
- •Диэлектрики 21.3
- •Диэлектрики 21.4
- •Диэлектрики 21.5
- •Диэлектрики 21.6
- •Диэлектрики 21.7
- •Диэлектрики 21.8
- •Диэлектрики 21.9
- •Диэлектрики 21.10
- •Лекция 22
- •Магнетики 22.2
- •Магнетики 22.3
- •Магнетики 22.4
- •Магнетики 22.5
- •Магнетики 22.6
- •Магнетики 22.7
- •Магнетики 22.8
- •Магнетики 22.9
- •Магнетики 22.10
- •Магнетики 22.11
- •Лекция 23 Законы геометрической оптики. Принцип Ферма. Явление
- •Геометрическая оптика 23.2
- •Геометрическая оптика 23.3
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.5
- •Геометрическая оптика 23.6
- •Геометрическая оптика 23.7
- •Геометрическая оптика 23.8
- •Геометрическая оптика 23.9
- •Геометрическая оптика 23.10
- •Лекция 24 Оптическая система. Кардинальные плоскости.
- •Оптическая система. 24.2
- •Оптическая система. 24.3
- •Оптическая система. 24.4
- •Оптическая система. 24.5
- •Оптическая система. 24.6
- •Оптическая система. 24.7
- •Оптическая система. 24.8
- •Оптическая система. 24.9
- •Оптическая система. 24.10
- •Лекция 25
- •Тонкие линзы. 25.2
- •Тонкие линзы. 25.3
- •Тонкие линзы. 25.4
- •Тонкие линзы. 25.5
- •Тонкие линзы. 25.6
- •Тонкие линзы. 25.7
- •Тонкие линзы. 25.8
- •Тонкие линзы. 25.9
- •Тонкие линзы. 25.10
- •Интерференция света. Когерентные источники. Интерференция от двух когерентных источников. Бипризма Френеля. Интерференция при
- •Интерференция. 26.2
- •Интерференция. 26.3
- •Интерференция. 26.4
- •Интерференция. 26.5
- •Интерференция. 26.6
- •Интерференция. 26.7
- •Интерференция. 26.8
- •Интерференция. 26.9
- •Интерференция. 26.10
- •Интерференция. 26.11
- •Интерференция. 26.12
- •Лекция 27 Дифракция света. Принцип Гюйгенса-Френеля. Зоны
- •Дифракция. 27.2
- •Дифракция. 27.3
- •Колебания приходящие в точку Р от аналогичных точек двух соседних зон, находятся в
- •Дифракция. 27.5
- •Дифракция. 27.6
- •Дифракция. 27.7
- •Дифракция. 27.8
- •Дифракция. 27.9
- •Дифракция. 27.10
- •Дифракция Френеля от простейших преград. Дифракция от
- •Дифракция. 28.2
- •Дифракция. 28.3
- •Дифракция. 28.4
- •Дифракция. 28.5
- •Дифракция. 28.6
- •Дифракция. 28.7
- •Дифракция. 28.8
- •Дифракция. 28.9
- •Дифракция. 28.10
- •Закономерности в атомных спектрах. Опыт по рассеянию альфа частиц.
- •Атомная физика. 29.2
- •Атомная физика. 29.3
- •Атомная физика. 29.4
- •Атомная физика. 29.5
- •Атомная физика. 29.6
- •Атомная физика. 29.7
- •Атомная физика. 29.8
- •Атомная физика. 29.9
- •Атомная физика. 29.10
- •Лекция 30 Гипотеза де Бройля. Принцип неопределенности.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Лекция 31 Таблица Менделеева. Состав и характеристики атомного
- •Элементы атомной физики. 31.2
- •Элементы атомной физики. 31.3
- •Элементы атомной физики. 31.4
- •Элементы атомной физики. 31.5
- •Элементы атомной физики. 31.6
- •Элементы атомной физики. 31.7
- •Элементы атомной физики. 31.8
- •Элементы атомной физики. 31.9
- •Элементы атомной физики. 31.10
- •Элементы атомной физики. 31.11
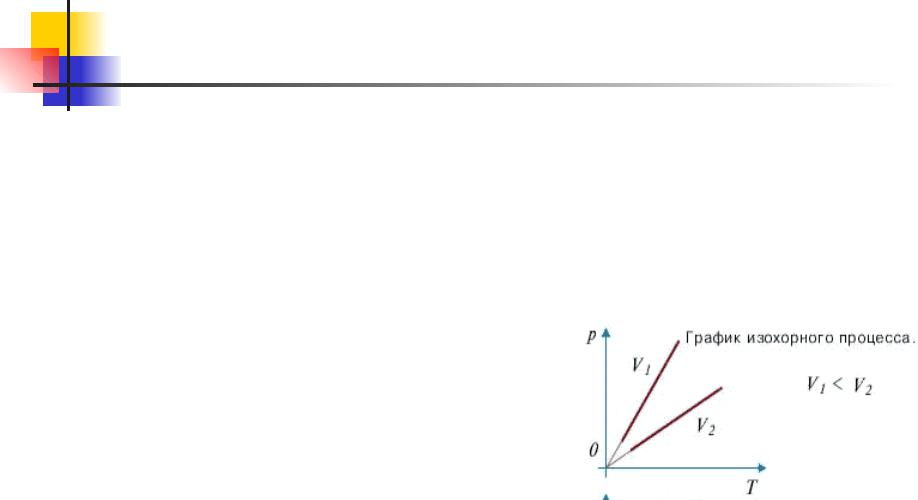
Основы МКТ. 9.9
Изохорный процесс – это процесс равновесного нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным. Как следует из уравнения состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально
его абсолютной температуpре: p ~ T или
T const
На плоскости (Т, р) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются
Большимизохора значениям. объема соответствуют изохоры с меньшим наклоном по отношению к оси температур. Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение
изохорного процесса называется законом Шарля.
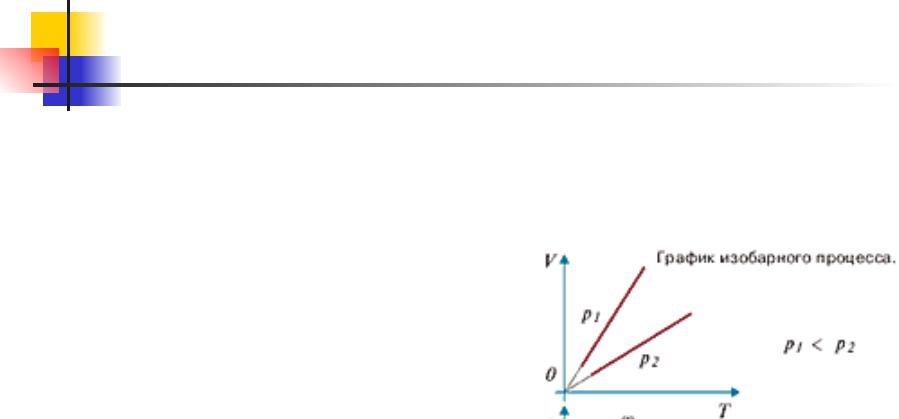
Основы МКТ. 9.10
Изобарным процессом называют квазистатический процесс,
протекающий при неизменным давлении p. Уравнение
изобарного процесса для некоторого неизменного количества
вещества ν имеет вид: VT const
На плоскости (V, T) изобарные
процессы при разных значениях давления p изображаются семейством прямых линий, которые называются изобарами.
Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-
Люссака.

Связь кинетической энергии молекул газа с температурой и
давлением. Равнораспределение энергии по степеням свободы. Число степеней свободы и средняя энергия многоатомной молекулы.
Молекулярно-кинетическая теория (МКТ) устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТ выражает связь давления газа со средней кинетической энергией поступательного движения молекул. Давление газа на стенки сосуда является результатом многочисленных ударов молекул. При каждом ударе стенка получает силовой импульс, величина которого зависит от скорости молекул и, следовательно, от энергии их движения. При огромном числе ударов создается постоянное давление газа на стенку. Число ударов зависит от концентрации молекул n. Таким образом, можно ожидать, что давление газа связано с концентрацией молекул и с энергией их движения.
Для нахождения этой связи введем некоторые упрощения:
1)все молекулы движутся по взаимно перпендикулярным направлениям;
2)скорости всех молекул одинаковы.
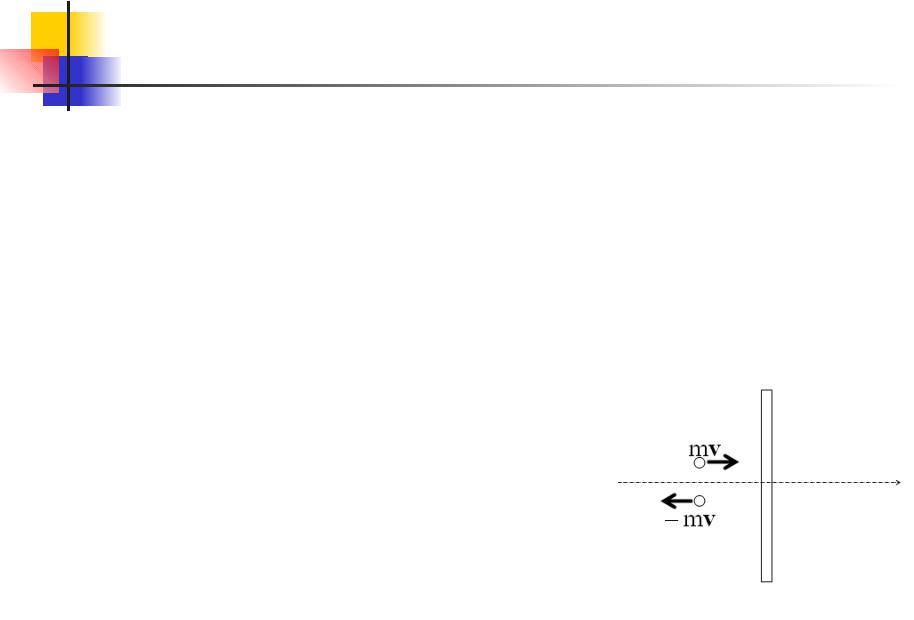
Основы МКТ. 10.2
При ударе о стенку сосуда молекула сообщает ей импульс, численно равный изменению импульса молекулы. Каждый элемент поверхности dS непрерывно подвергается бомбардировке большим количеством молекул, в результате чего за время dt получает суммарный импульс dp направленный по нормали к dS. Отношение dр к dt дает, как известно из второго закона Ньютона, силу,
действующую на dS, а отношение этой силы к dS дает давление Р.
До удара о стенку импульс молекулы направлен по внешней нормали к dS и равен mv. В результате удара импульс меняет знак. Таким образом, приращение импульса молекулы
оказывается равным:
( mv) (mv) 2mv

Основы МКТ. 10.3
По третьему закону Ньютона стенка получает при ударе импульс 2mv, имеющий направление нормали. За время dt до элемента стенки dS долетят все движущиеся по направлению к нему молекулы, заключенные в объеме цилиндра с основанием dS и высотой vdt. Число этих молекул равно:
N 16 nvdSdt
где n – число молекул в единице объема. Таким образом, число ударов о единицу поверхности за единицу
времени будет равно:
N 1 nv dtdS 6

Основы МКТ. 10.4
Умножив число ударов на импульс, сообщаемый стенке при
каждом ударе, получим суммарный импульс dp, сообщаемый
элементу стенки dS за время dt:
p 2mv 16 nvdSdt 13 nmv2dSdt.
Отнеся импульс dp к промежутку времени dt, получим силу, действующую на dS. Наконец, отнеся полученную силу к
площадке dS, получим давление газа, оказываемое им на
стенки сосуда. Следовательно |
|
|
|||
|
|
P |
dp |
1 nmv2. |
|
|
|
dSdt |
|||
|
= mv2 |
|
3 |
|
|
Е |
представляет собой кинетическую |
||||
Учитывая, что к |
2 |
||||
энергию поступательного движения молекулы, выражению |
|||||
для давления можно придать следующий вид: |
|||||
|
|
|
|
2 |
Основное уравнение |
|
|
|
P= |
3 nEк |
|
|
|
|
МКТ |
||

Основы МКТ. 10.5
Отказ о предположении, о равенстве всех скоростей приводит к тому, что необходимо учитывать среднюю квадратичную скорость молекул газа или среднюю кинетическую энергию.
Давление равно двум третям кинетической энергии поступательного
движении молекул, заключенных в единице объема.
Из полученного закона следует, что давление пропорционально средней кинетической энергии поступательного движение молекул. Вместе с тем оно пропорционально температуре газа. Следовательно, средняя кинетическая энергия пропорциональна температуре газа.
PV= 23 nEкV, PV= m RT
Первое соотношение получается из основного уравнение МКТ
умножением на V, второе это уравнение состояния идеального газа. Приравняв правые части получим:

Основы МКТ. 10.6
|
2 nEк V m RT |
|
|
3 |
|
n= N |
, N= m Na |
получим: |
Принимая во внимание, что V |
|
|
2 m NaEк m RT |
||
3 |
|
|
Eк = 32 NaR T
Введя обозначение
k= |
R |
1.38 |
10 23 |
Дж |
постоянная Больцмана, |
||
Na |
К |
|
|||||
окончательно получим: |
|
|
|
3 kT |
|||
|
|
|
Е |
= |
|||
|
|
|
|
к |
|
2 |
|

Основы МКТ. 10.7
Получается, что кинетическая энергия зависит только от
температуры и не зависит от массы молекулы. Заменив в уравнении состояния идеального газа R на Nak и учитывая,
что n/V равно концентрацииP=nkT, получим:
Для смеси газов справедлив закон Дальтона:
давление смеси идеальных газов равно сумме парциальных
давлений входящих в нее газов:
Р Рк
к
где k – номер газовой компоненты в смеси, Pk – ее парциальное
давление, т.е. то давление, которое имел бы k–ый газ, если бы только он один занимал весь объём, занимаемый смесью.
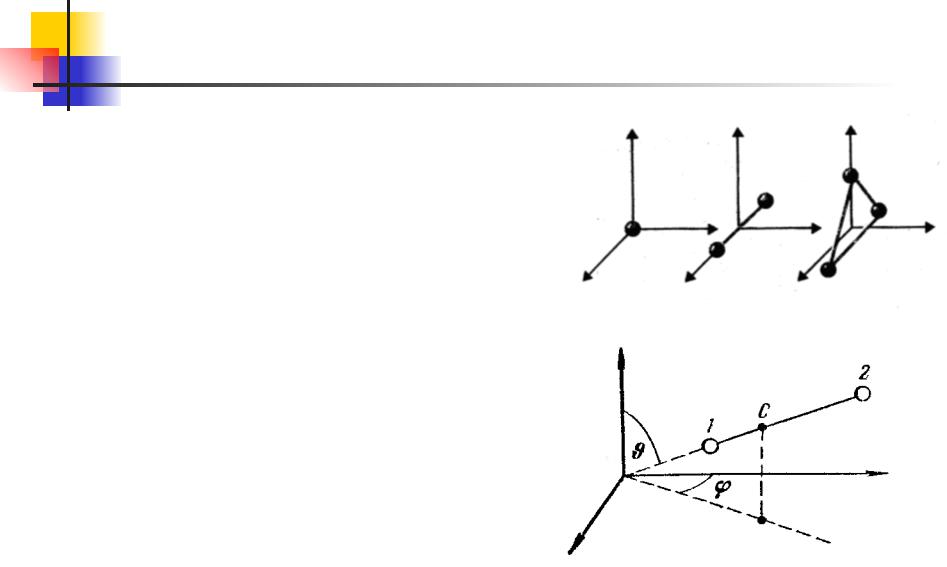
Основы МКТ. 10.8
Очевидно, что число координат в трехмерном пространстве, а следовательно и число степеней свободы одноатомного газа, равно трем. Газ может быть двухатомным, трёхатомным и т. д. Для молекул таких газов характерно наличие внутренней структуры и, соответственно, дополнительных степеней свободы. Если атомы в молекуле жестко связаны между собой, в качестве дополнительных степеней свободы выступают вращательные степени, характеризующие угловое положение молекулы в пространстве.
