
- •Общая физика
- •Система отсчета. Материальная точка. Радиус-вектор и вектор перемещения, их связь с координатами точки.
- •Кинематика. 1.3
- •Кинематика. 1.4
- •Кинематика. 1.5
- •Кинематика. 1.6
- •Кинематика. 1.7
- •Кинематика. 1.8
- •Кинематика. 1.9
- •Кинематика. 1.10
- •Лекция 2
- •Кинематика. 2.2
- •Кинематика. 2.3
- •Кинематика. 2.4
- •Кинематика. 2.5
- •Кинематика. 2.6
- •Кинематика. 2.7
- •Кинематика. 2.8
- •Кинематика. 2.9
- •Кинематика. 2.10
- •Лекция 3
- •Динамика. 3.2
- •Динамика. 3.3
- •Динамика. 3.4
- •Динамика. 3.5
- •Динамика. 3.6
- •Динамика. 3.7
- •Динамика. 3.8
- •Динамика. 3.9
- •Динамика. 3.10
- •Динамика. 3.11
- •Замкнутая система материальных точек. Закон сохранения импульса. Момент импульса, закон сохранения момента импульса.
- •Законы сохранения. 4.2
- •Законы сохранения. 4.3
- •Законы сохранения. 4.4
- •Законы сохранения. 4.5
- •Законы сохранения. 4.7
- •Законы сохранения. 4.8
- •Законы сохранения. 4.9
- •Законы сохранения. 4.10
- •Законы сохранения. 4.11
- •Лекция 5
- •Законы сохранения. 5.2
- •Законы сохранения. 5.3
- •Законы сохранения. 5.4
- •Законы сохранения. 5.5
- •Законы сохранения. 5.6
- •Законы сохранения. 5.7
- •Законы сохранения. 5.8
- •Законы сохранения. 5.9
- •Законы сохранения. 5.10
- •Упругие и квазиупругие силы. Закон Гука. Гармонические
- •Колебания. 6.2
- •Колебания. 6.3
- •Колебания. 6.4
- •Колебания. 6.5
- •Колебания. 6.6
- •Колебания. 6.7
- •Колебания. 6.8
- •Колебания. 6.9
- •Колебания. 6.10
- •Лекция 7 Затухающие колебания. Коэффициент затухания и
- •Колебания. 7.2
- •Колебания. 7.3
- •Колебания. 7.4
- •Колебания. 7.5
- •Колебания. 7.6
- •Колебания. 7.7
- •Колебания. 7.8
- •Колебания. 7.9
- •Колебания. 7.10
- •Лекция 8 Вынужденные колебания. Резонанс
- •Вынужденные колебания. 8.2
- •Вынужденные колебания. 8.3
- •Вынужденные колебания. 8.4
- •Вынужденные колебания. 8.5
- •Вынужденные колебания. 8.6
- •Вынужденные колебания. 8.7
- •Вынужденные колебания. 8.8
- •Вынужденные колебания. 8.9
- •Вынужденные колебания. 8.10
- •Лекция 9
- •Основы МКТ. 9.2
- •Основы МКТ. 9.3
- •Основы МКТ. 9.4
- •Основы МКТ. 9.5
- •Основы МКТ. 9.6
- •Основы МКТ. 9.7
- •Основы МКТ. 9.8
- •Основы МКТ. 9.9
- •Основы МКТ. 9.10
- •Связь кинетической энергии молекул газа с температурой и
- •Основы МКТ. 10.2
- •Основы МКТ. 10.3
- •Основы МКТ. 10.4
- •Основы МКТ. 10.5
- •Основы МКТ. 10.6
- •Основы МКТ. 10.7
- •Основы МКТ. 10.8
- •Основы МКТ. 10.9
- •Основы МКТ. 10.10
- •Внутренняя энергия термодинамической системы. Теплоемкость. Работа, совершаемая газом при изменении объема
- •Термодинамика. 11.2
- •Термодинамика. 11.3
- •Термодинамика. 11.4
- •Термодинамика. 11.5
- •Термодинамика. 11.6
- •Термодинамика. 11.7
- •Термодинамика. 11.8
- •Термодинамика. 11.9
- •Термодинамика. 11.10
- •Лекция 12 Распределение молекул газа по скоростям. Функция
- •Распределение Максвелла. 12.2
- •Распределение Максвелла. 12.3
- •Распределение Максвелла. 12.4
- •Распределение Максвелла. 12.5
- •Распределение Максвелла. 12.6
- •Распределение Максвелла. 12.7
- •Распределение Максвелла. 12.8
- •Распределение Максвелла. 12.9
- •Распределение Максвелла. 12.10
- •Опыты Штерна и Ламмерта. Идеальный газ в поле силы тяжести, барометрическая формула. Распределения
- •Распределение Больцмана. 13.2
- •Распределение Больцмана. 13.3
- •Распределение Больцмана. 13.4
- •Распределение Больцмана. 13.5
- •Распределение Больцмана. 13.6
- •Распределение Больцмана. 13.7
- •Распределение Больцмана. 13.8
- •Распределение Больцмана. 13.9
- •Распределение Больцмана. 13.10
- •Лекция 14
- •Основы термодинамики. 14.2
- •Основы термодинамики. 14.3
- •Основы термодинамики. 14.4
- •Основы термодинамики. 14.5
- •Основы термодинамики. 14.6
- •Основы термодинамики. 14.7
- •Основы термодинамики. 14.8
- •Основы термодинамики. 14.9
- •Основы термодинамики. 14.10
- •Основы термодинамики. 14.11
- •Основы термодинамики. 14.12
- •Лекция 15 Электрические заряды. Точечный заряд. Закон Кулона.
- •Электростатика. 15.2
- •Электростатика. 15.3
- •Электростатика. 15.4
- •Электростатика. 15.5
- •Электростатика. 15.6
- •Электростатика. 15.7
- •Электростатика. 15.8
- •Электростатика. 15.9
- •Электростатика. 15.10
- •Лекция 16 Поток вектора напряженности электрического поля. Теорема
- •Электростатика. 16.2
- •Электростатика. 16.3
- •Электростатика. 16.4
- •Электростатика. 16.5
- •Электростатика. 16.6
- •Электростатика. 16.7
- •Электростатика. 16.8
- •Электростатика. 16.9
- •Электростатика. 16.10
- •Лекция 17 Работа сил электростатического поля. Потенциал.
- •Электростатика. 17.2
- •Электростатика. 17.3
- •Электростатика. 17.4
- •Электростатика. 17.5
- •Электростатика. 17.6
- •Электростатика. 17.7
- •Электростатика. 17.8
- •Электростатика. 17.9
- •Электростатика. 17.10
- •Лекция 18 Поле В. Сила Лоренца. Закон Био – Савара. Циркуляция и
- •Магнитное поле в вакууме 18.2
- •Магнитное поле в вакууме 18.3
- •Магнитное поле в вакууме 18.4
- •Магнитное поле в вакууме 18.5
- •Магнитное поле в вакууме 18.6
- •Магнитное поле в вакууме 18.7
- •Магнитное поле в вакууме 18.8
- •Магнитное поле в вакууме 18.9
- •Магнитное поле в вакууме 18.10
- •Лекция 19
- •Магнитное поле в вакууме 19.2
- •Магнитное поле в вакууме 19.3
- •Магнитное поле в вакууме 19.4
- •Магнитное поле в вакууме 19.5
- •Магнитное поле в вакууме 19.6
- •Магнитное поле в вакууме 19.7
- •Магнитное поле в вакууме 19.8
- •Магнитное поле в вакууме 19.9
- •Магнитное поле в вакууме 19.10
- •Магнитное поле в вакууме 19.11
- •Лекция 20 Сила Ампера. Работа поля В при перемещении контура
- •Магнитное поле в вакууме 20.2
- •Магнитное поле в вакууме 20.3
- •Магнитное поле в вакууме 20.4
- •Магнитное поле в вакууме 20.5
- •Магнитное поле в вакууме 20.6
- •Магнитное поле в вакууме 20.7
- •Магнитное поле в вакууме 20.8
- •Магнитное поле в вакууме 20.9
- •Магнитное поле в вакууме 20.10
- •Магнитное поле в вакууме 20.11
- •Магнитное поле в вакууме 20.12
- •Лекция 21
- •Диэлектрики 21.2
- •Диэлектрики 21.3
- •Диэлектрики 21.4
- •Диэлектрики 21.5
- •Диэлектрики 21.6
- •Диэлектрики 21.7
- •Диэлектрики 21.8
- •Диэлектрики 21.9
- •Диэлектрики 21.10
- •Лекция 22
- •Магнетики 22.2
- •Магнетики 22.3
- •Магнетики 22.4
- •Магнетики 22.5
- •Магнетики 22.6
- •Магнетики 22.7
- •Магнетики 22.8
- •Магнетики 22.9
- •Магнетики 22.10
- •Магнетики 22.11
- •Лекция 23 Законы геометрической оптики. Принцип Ферма. Явление
- •Геометрическая оптика 23.2
- •Геометрическая оптика 23.3
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.5
- •Геометрическая оптика 23.6
- •Геометрическая оптика 23.7
- •Геометрическая оптика 23.8
- •Геометрическая оптика 23.9
- •Геометрическая оптика 23.10
- •Лекция 24 Оптическая система. Кардинальные плоскости.
- •Оптическая система. 24.2
- •Оптическая система. 24.3
- •Оптическая система. 24.4
- •Оптическая система. 24.5
- •Оптическая система. 24.6
- •Оптическая система. 24.7
- •Оптическая система. 24.8
- •Оптическая система. 24.9
- •Оптическая система. 24.10
- •Лекция 25
- •Тонкие линзы. 25.2
- •Тонкие линзы. 25.3
- •Тонкие линзы. 25.4
- •Тонкие линзы. 25.5
- •Тонкие линзы. 25.6
- •Тонкие линзы. 25.7
- •Тонкие линзы. 25.8
- •Тонкие линзы. 25.9
- •Тонкие линзы. 25.10
- •Интерференция света. Когерентные источники. Интерференция от двух когерентных источников. Бипризма Френеля. Интерференция при
- •Интерференция. 26.2
- •Интерференция. 26.3
- •Интерференция. 26.4
- •Интерференция. 26.5
- •Интерференция. 26.6
- •Интерференция. 26.7
- •Интерференция. 26.8
- •Интерференция. 26.9
- •Интерференция. 26.10
- •Интерференция. 26.11
- •Интерференция. 26.12
- •Лекция 27 Дифракция света. Принцип Гюйгенса-Френеля. Зоны
- •Дифракция. 27.2
- •Дифракция. 27.3
- •Колебания приходящие в точку Р от аналогичных точек двух соседних зон, находятся в
- •Дифракция. 27.5
- •Дифракция. 27.6
- •Дифракция. 27.7
- •Дифракция. 27.8
- •Дифракция. 27.9
- •Дифракция. 27.10
- •Дифракция Френеля от простейших преград. Дифракция от
- •Дифракция. 28.2
- •Дифракция. 28.3
- •Дифракция. 28.4
- •Дифракция. 28.5
- •Дифракция. 28.6
- •Дифракция. 28.7
- •Дифракция. 28.8
- •Дифракция. 28.9
- •Дифракция. 28.10
- •Закономерности в атомных спектрах. Опыт по рассеянию альфа частиц.
- •Атомная физика. 29.2
- •Атомная физика. 29.3
- •Атомная физика. 29.4
- •Атомная физика. 29.5
- •Атомная физика. 29.6
- •Атомная физика. 29.7
- •Атомная физика. 29.8
- •Атомная физика. 29.9
- •Атомная физика. 29.10
- •Лекция 30 Гипотеза де Бройля. Принцип неопределенности.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Лекция 31 Таблица Менделеева. Состав и характеристики атомного
- •Элементы атомной физики. 31.2
- •Элементы атомной физики. 31.3
- •Элементы атомной физики. 31.4
- •Элементы атомной физики. 31.5
- •Элементы атомной физики. 31.6
- •Элементы атомной физики. 31.7
- •Элементы атомной физики. 31.8
- •Элементы атомной физики. 31.9
- •Элементы атомной физики. 31.10
- •Элементы атомной физики. 31.11
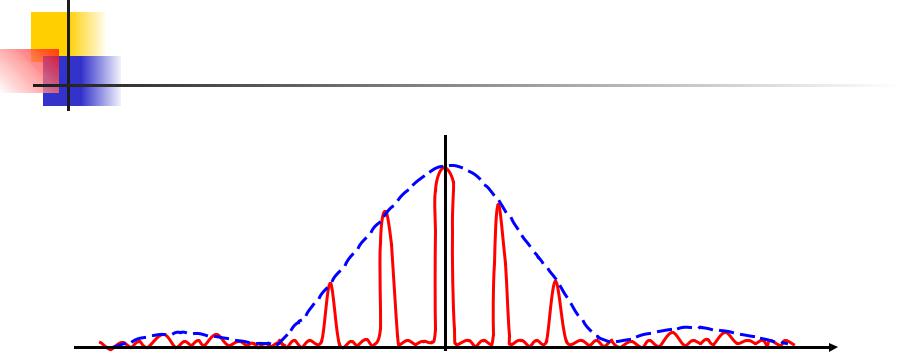
Дифракция. 28.10
 I
I
|
|
|
|
|
|
0 |
|
|
|
|
|
|
sin |
6 d |
5 d |
4 d |
3 d |
2 d |
d |
d |
2 d |
3 d |
4 d |
5 d |
6 d |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 b |
|
|
b |
|
|
|
|
|
b |
|
|
2 b |
|
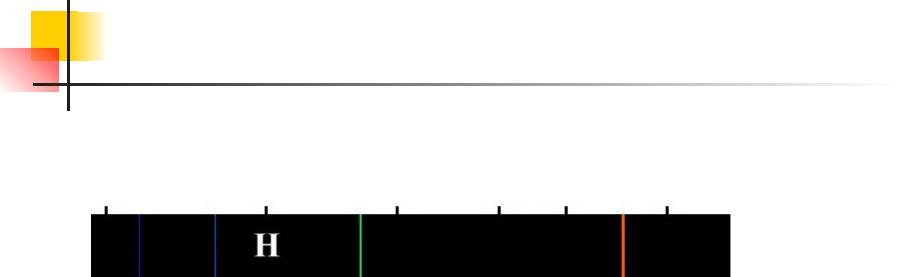
Закономерности в атомных спектрах. Опыт по рассеянию альфа частиц.
Модель атома Резерфорда. Постулаты Бора.
 Элементарная боровская теория водородоподобного атома.
Элементарная боровская теория водородоподобного атома.
Еще в начале XIX века были открыты дискретные спектральные линии в излучении атома водорода в видимой области (так называемый линейчатый спектр).
Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно (И. Бальмер, 1885 г.). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий:
|
1 |
|
1 |
|
|||
nm R |
|
|
|
|
|
|
|
|
|
2 |
n |
2 |
|||
m |
|
|
|
|
|||
Атомная физика. 29.2
Для серии Бальмера m = 2, n = 3, 4, 5, ... . Для ультрафиолетовой серии (серия Лаймана) m = 1, n = 2, 3, 4, ... . Постоянная R в этой формуле называется постоянной Ридберга. Ее численное значение
R = 3,29·1015 Гц.
Атомная физика. 29.3
Первая попытка создания модели атома на основе накопленных экспериментальных данных принадлежит Дж. Томсону (1903 г.). Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него. Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия.
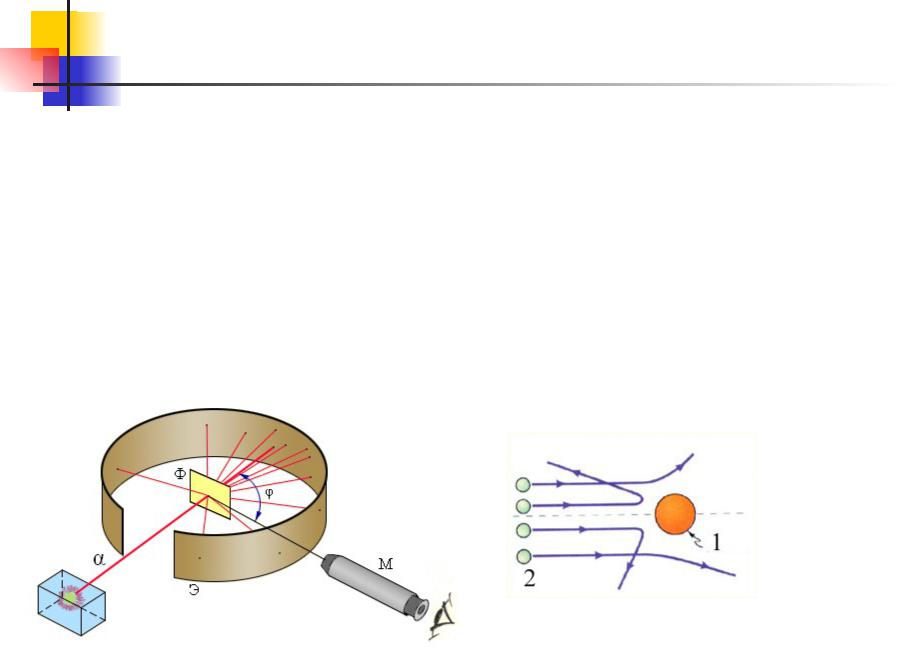
Атомная физика. 29.4
Первые прямые эксперименты по исследованию внутренней
структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах.
Резерфорд предложил применить зондирование атома с
помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц
приблизительно в 7300 раз больше массы электрона, а
положительный заряд равен удвоенному элементарному
заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но она все же значительно
стицы – это полностью

Атомная физика. 29.5
Опыты Резерфорда и его сотрудников привели к выводу, что в |
|||||||||
центре атома находится плотное положительно заряженное |
|||||||||
ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро |
|||||||||
занимает только 10–12 |
часть полного объема атома, но |
||||||||
содержит весь положительный заряд и не менее 99,95 % его |
|||||||||
массы. Веществу, составляющему ядро атома, следовало |
|||||||||
приписать плотность порядка ρ ≈ 1015 г/см3. Заряд ядра |
|||||||||
должен быть равен суммарному заряду всех электронов, |
|||||||||
входящих в состав атома. Опираясь на классические |
|||||||||
представления о движении микрочастиц, |
|||||||||
Резерфорд предложил |
планетарную модель |
||||||||
|
атома. Разработал классическую теорию |
||||||||
рассеяния α-частиц, и получил формулу для |
|||||||||
распределения рассеянных частиц по значению |
|||||||||
|
угла отклонения от первоначального |
||||||||
|
|
|
|
|
|
2 |
|
|
|
направления: |
|
dN |
Ze |
2 |
|
d |
|||
|
nd |
|
|
|
|||||
|
N |
m v2 |
sin4 ( / 2) |
|
|||||
|
|
|
|
|
|
|
|
|
|
Согласно планетарной модели, в центре атома располагается
положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно
планетам, вращаются под действием кулоновских сил со

Атомная физика. 29.6
По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Следующий шаг в развитии представлений об устройстве атома
сделал в 1913 году датский физик Н. Бор.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.

Атомная физика. 29.7
Второй постулат Бора (правило частот) формулируется |
|
следующим образом: при переходе атома из одного |
|
стационарного состояния с энергией En в другое стационарное |
|
состояние с энергией Em излучается или поглощается квант, |
|
энергия которого равна разности энергий стационарных |
|
состояний: |
h nm h nm En -Em |
где h – постоянная Планка h=6.626 10-34 Дж с
Третий постулат (Правило квантования). Бор предположил, что из всех возможных орбит электрона осуществляются только те для которых момент импульса равен целому кратному постоянной планка h, деленнойme vr nh на(n=1,2π:2, 3,....)
Число n – называется главным квантовым числом.

Атомная физика. 29.8
Применим полуклассический подход Бора к описанию движения
электрона в поле ядра с зарядом Ze. При Z=1 такая система соответствует атому водорода. Произведение массы
электрона на его центростремительное ускорение должно |
||||||||||
равняться силе кулона, действующей на электрон: |
||||||||||
|
v |
2 |
|
Ze |
2 |
|
|
2 |
|
|
me |
|
= |
r2 |
|
|
rn |
h |
n2 |
(n=1, 2, 3,...) |
|
r |
|
|||||||||
|
|
|||||||||
|
|
|
2 |
|||||||
me vr nh |
(n=1, 2, 3,....) |
|
|
me Ze |
|
|||||
|
|
|
|
|
||||||
Видно, что радиус может принимать только дискретные значения. Внутренняя энергия атома складывается из энергии взаимодействия электрона с ядром и кинетической электрона:
E = me v2 - Ze2 2 r

Атомная физика. 29.9
Кинетическую энергию находим следующим образом:
m |
|
v2 |
= |
Ze2 |
m |
v2 |
= |
Ze2 |
|
e |
r |
r2 |
e 2 |
2r |
|||||
|
|
|
|
||||||
огда внутренняя энергия атома |
|
|
|
|
|||||
E= |
Ze2 |
- |
Ze2 |
=- |
Ze2 |
|||
|
2r |
r |
2r |
|||||
Окончательно, получим: |
|
|
|
|
||||
m |
|
e4Z2 |
|
|
||||
En |
|
|
|
|||||
|
|
e |
|
|
(n=1, 2, 3,...) |
|||
|
|
2h2n2 |
|
|
|
|||
При переходе атома водорода (Z=1) из состояния n в состояние
m излучается квант |
|
|
m e4 |
|
1 |
|
|
1 |
|
|||||
h En -Em |
|
|
e 2 |
|
|
|
|
|
- |
|
|
|
||
|
|
|
2 |
|
m |
2 |
||||||||
|
|
|
2h |
n |
|
|
|
|
|
|||||
Частота испущенного свет равна: |
|
|
|
|
|
|
|
|
|
|||||
|
m |
e4 |
1 |
- |
1 |
|
|
|||||||
e |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
2 |
|
n |
2 |
|
|||||||
|
2h3 |
m |
|
|
|
|
|
|
||||||
