
- •Общая физика
- •Система отсчета. Материальная точка. Радиус-вектор и вектор перемещения, их связь с координатами точки.
- •Кинематика. 1.3
- •Кинематика. 1.4
- •Кинематика. 1.5
- •Кинематика. 1.6
- •Кинематика. 1.7
- •Кинематика. 1.8
- •Кинематика. 1.9
- •Кинематика. 1.10
- •Лекция 2
- •Кинематика. 2.2
- •Кинематика. 2.3
- •Кинематика. 2.4
- •Кинематика. 2.5
- •Кинематика. 2.6
- •Кинематика. 2.7
- •Кинематика. 2.8
- •Кинематика. 2.9
- •Кинематика. 2.10
- •Лекция 3
- •Динамика. 3.2
- •Динамика. 3.3
- •Динамика. 3.4
- •Динамика. 3.5
- •Динамика. 3.6
- •Динамика. 3.7
- •Динамика. 3.8
- •Динамика. 3.9
- •Динамика. 3.10
- •Динамика. 3.11
- •Замкнутая система материальных точек. Закон сохранения импульса. Момент импульса, закон сохранения момента импульса.
- •Законы сохранения. 4.2
- •Законы сохранения. 4.3
- •Законы сохранения. 4.4
- •Законы сохранения. 4.5
- •Законы сохранения. 4.7
- •Законы сохранения. 4.8
- •Законы сохранения. 4.9
- •Законы сохранения. 4.10
- •Законы сохранения. 4.11
- •Лекция 5
- •Законы сохранения. 5.2
- •Законы сохранения. 5.3
- •Законы сохранения. 5.4
- •Законы сохранения. 5.5
- •Законы сохранения. 5.6
- •Законы сохранения. 5.7
- •Законы сохранения. 5.8
- •Законы сохранения. 5.9
- •Законы сохранения. 5.10
- •Упругие и квазиупругие силы. Закон Гука. Гармонические
- •Колебания. 6.2
- •Колебания. 6.3
- •Колебания. 6.4
- •Колебания. 6.5
- •Колебания. 6.6
- •Колебания. 6.7
- •Колебания. 6.8
- •Колебания. 6.9
- •Колебания. 6.10
- •Лекция 7 Затухающие колебания. Коэффициент затухания и
- •Колебания. 7.2
- •Колебания. 7.3
- •Колебания. 7.4
- •Колебания. 7.5
- •Колебания. 7.6
- •Колебания. 7.7
- •Колебания. 7.8
- •Колебания. 7.9
- •Колебания. 7.10
- •Лекция 8 Вынужденные колебания. Резонанс
- •Вынужденные колебания. 8.2
- •Вынужденные колебания. 8.3
- •Вынужденные колебания. 8.4
- •Вынужденные колебания. 8.5
- •Вынужденные колебания. 8.6
- •Вынужденные колебания. 8.7
- •Вынужденные колебания. 8.8
- •Вынужденные колебания. 8.9
- •Вынужденные колебания. 8.10
- •Лекция 9
- •Основы МКТ. 9.2
- •Основы МКТ. 9.3
- •Основы МКТ. 9.4
- •Основы МКТ. 9.5
- •Основы МКТ. 9.6
- •Основы МКТ. 9.7
- •Основы МКТ. 9.8
- •Основы МКТ. 9.9
- •Основы МКТ. 9.10
- •Связь кинетической энергии молекул газа с температурой и
- •Основы МКТ. 10.2
- •Основы МКТ. 10.3
- •Основы МКТ. 10.4
- •Основы МКТ. 10.5
- •Основы МКТ. 10.6
- •Основы МКТ. 10.7
- •Основы МКТ. 10.8
- •Основы МКТ. 10.9
- •Основы МКТ. 10.10
- •Внутренняя энергия термодинамической системы. Теплоемкость. Работа, совершаемая газом при изменении объема
- •Термодинамика. 11.2
- •Термодинамика. 11.3
- •Термодинамика. 11.4
- •Термодинамика. 11.5
- •Термодинамика. 11.6
- •Термодинамика. 11.7
- •Термодинамика. 11.8
- •Термодинамика. 11.9
- •Термодинамика. 11.10
- •Лекция 12 Распределение молекул газа по скоростям. Функция
- •Распределение Максвелла. 12.2
- •Распределение Максвелла. 12.3
- •Распределение Максвелла. 12.4
- •Распределение Максвелла. 12.5
- •Распределение Максвелла. 12.6
- •Распределение Максвелла. 12.7
- •Распределение Максвелла. 12.8
- •Распределение Максвелла. 12.9
- •Распределение Максвелла. 12.10
- •Опыты Штерна и Ламмерта. Идеальный газ в поле силы тяжести, барометрическая формула. Распределения
- •Распределение Больцмана. 13.2
- •Распределение Больцмана. 13.3
- •Распределение Больцмана. 13.4
- •Распределение Больцмана. 13.5
- •Распределение Больцмана. 13.6
- •Распределение Больцмана. 13.7
- •Распределение Больцмана. 13.8
- •Распределение Больцмана. 13.9
- •Распределение Больцмана. 13.10
- •Лекция 14
- •Основы термодинамики. 14.2
- •Основы термодинамики. 14.3
- •Основы термодинамики. 14.4
- •Основы термодинамики. 14.5
- •Основы термодинамики. 14.6
- •Основы термодинамики. 14.7
- •Основы термодинамики. 14.8
- •Основы термодинамики. 14.9
- •Основы термодинамики. 14.10
- •Основы термодинамики. 14.11
- •Основы термодинамики. 14.12
- •Лекция 15 Электрические заряды. Точечный заряд. Закон Кулона.
- •Электростатика. 15.2
- •Электростатика. 15.3
- •Электростатика. 15.4
- •Электростатика. 15.5
- •Электростатика. 15.6
- •Электростатика. 15.7
- •Электростатика. 15.8
- •Электростатика. 15.9
- •Электростатика. 15.10
- •Лекция 16 Поток вектора напряженности электрического поля. Теорема
- •Электростатика. 16.2
- •Электростатика. 16.3
- •Электростатика. 16.4
- •Электростатика. 16.5
- •Электростатика. 16.6
- •Электростатика. 16.7
- •Электростатика. 16.8
- •Электростатика. 16.9
- •Электростатика. 16.10
- •Лекция 17 Работа сил электростатического поля. Потенциал.
- •Электростатика. 17.2
- •Электростатика. 17.3
- •Электростатика. 17.4
- •Электростатика. 17.5
- •Электростатика. 17.6
- •Электростатика. 17.7
- •Электростатика. 17.8
- •Электростатика. 17.9
- •Электростатика. 17.10
- •Лекция 18 Поле В. Сила Лоренца. Закон Био – Савара. Циркуляция и
- •Магнитное поле в вакууме 18.2
- •Магнитное поле в вакууме 18.3
- •Магнитное поле в вакууме 18.4
- •Магнитное поле в вакууме 18.5
- •Магнитное поле в вакууме 18.6
- •Магнитное поле в вакууме 18.7
- •Магнитное поле в вакууме 18.8
- •Магнитное поле в вакууме 18.9
- •Магнитное поле в вакууме 18.10
- •Лекция 19
- •Магнитное поле в вакууме 19.2
- •Магнитное поле в вакууме 19.3
- •Магнитное поле в вакууме 19.4
- •Магнитное поле в вакууме 19.5
- •Магнитное поле в вакууме 19.6
- •Магнитное поле в вакууме 19.7
- •Магнитное поле в вакууме 19.8
- •Магнитное поле в вакууме 19.9
- •Магнитное поле в вакууме 19.10
- •Магнитное поле в вакууме 19.11
- •Лекция 20 Сила Ампера. Работа поля В при перемещении контура
- •Магнитное поле в вакууме 20.2
- •Магнитное поле в вакууме 20.3
- •Магнитное поле в вакууме 20.4
- •Магнитное поле в вакууме 20.5
- •Магнитное поле в вакууме 20.6
- •Магнитное поле в вакууме 20.7
- •Магнитное поле в вакууме 20.8
- •Магнитное поле в вакууме 20.9
- •Магнитное поле в вакууме 20.10
- •Магнитное поле в вакууме 20.11
- •Магнитное поле в вакууме 20.12
- •Лекция 21
- •Диэлектрики 21.2
- •Диэлектрики 21.3
- •Диэлектрики 21.4
- •Диэлектрики 21.5
- •Диэлектрики 21.6
- •Диэлектрики 21.7
- •Диэлектрики 21.8
- •Диэлектрики 21.9
- •Диэлектрики 21.10
- •Лекция 22
- •Магнетики 22.2
- •Магнетики 22.3
- •Магнетики 22.4
- •Магнетики 22.5
- •Магнетики 22.6
- •Магнетики 22.7
- •Магнетики 22.8
- •Магнетики 22.9
- •Магнетики 22.10
- •Магнетики 22.11
- •Лекция 23 Законы геометрической оптики. Принцип Ферма. Явление
- •Геометрическая оптика 23.2
- •Геометрическая оптика 23.3
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.5
- •Геометрическая оптика 23.6
- •Геометрическая оптика 23.7
- •Геометрическая оптика 23.8
- •Геометрическая оптика 23.9
- •Геометрическая оптика 23.10
- •Лекция 24 Оптическая система. Кардинальные плоскости.
- •Оптическая система. 24.2
- •Оптическая система. 24.3
- •Оптическая система. 24.4
- •Оптическая система. 24.5
- •Оптическая система. 24.6
- •Оптическая система. 24.7
- •Оптическая система. 24.8
- •Оптическая система. 24.9
- •Оптическая система. 24.10
- •Лекция 25
- •Тонкие линзы. 25.2
- •Тонкие линзы. 25.3
- •Тонкие линзы. 25.4
- •Тонкие линзы. 25.5
- •Тонкие линзы. 25.6
- •Тонкие линзы. 25.7
- •Тонкие линзы. 25.8
- •Тонкие линзы. 25.9
- •Тонкие линзы. 25.10
- •Интерференция света. Когерентные источники. Интерференция от двух когерентных источников. Бипризма Френеля. Интерференция при
- •Интерференция. 26.2
- •Интерференция. 26.3
- •Интерференция. 26.4
- •Интерференция. 26.5
- •Интерференция. 26.6
- •Интерференция. 26.7
- •Интерференция. 26.8
- •Интерференция. 26.9
- •Интерференция. 26.10
- •Интерференция. 26.11
- •Интерференция. 26.12
- •Лекция 27 Дифракция света. Принцип Гюйгенса-Френеля. Зоны
- •Дифракция. 27.2
- •Дифракция. 27.3
- •Колебания приходящие в точку Р от аналогичных точек двух соседних зон, находятся в
- •Дифракция. 27.5
- •Дифракция. 27.6
- •Дифракция. 27.7
- •Дифракция. 27.8
- •Дифракция. 27.9
- •Дифракция. 27.10
- •Дифракция Френеля от простейших преград. Дифракция от
- •Дифракция. 28.2
- •Дифракция. 28.3
- •Дифракция. 28.4
- •Дифракция. 28.5
- •Дифракция. 28.6
- •Дифракция. 28.7
- •Дифракция. 28.8
- •Дифракция. 28.9
- •Дифракция. 28.10
- •Закономерности в атомных спектрах. Опыт по рассеянию альфа частиц.
- •Атомная физика. 29.2
- •Атомная физика. 29.3
- •Атомная физика. 29.4
- •Атомная физика. 29.5
- •Атомная физика. 29.6
- •Атомная физика. 29.7
- •Атомная физика. 29.8
- •Атомная физика. 29.9
- •Атомная физика. 29.10
- •Лекция 30 Гипотеза де Бройля. Принцип неопределенности.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Лекция 31 Таблица Менделеева. Состав и характеристики атомного
- •Элементы атомной физики. 31.2
- •Элементы атомной физики. 31.3
- •Элементы атомной физики. 31.4
- •Элементы атомной физики. 31.5
- •Элементы атомной физики. 31.6
- •Элементы атомной физики. 31.7
- •Элементы атомной физики. 31.8
- •Элементы атомной физики. 31.9
- •Элементы атомной физики. 31.10
- •Элементы атомной физики. 31.11

Распределение Больцмана. 13.9
1)притяжение молекул газа к земле под действием силы тяжести
2)тепловое движение, стремящееся распределить молекулы равномерно по всем высотам.
На разной высоте молекула обладает разной потенциальной энергией: EП =mgh
Следовательно, распределение молекул газа по высоте,
является в то же время распределение их по значениям
потенциальной энергии. Таким обраЕП зом, получим:
n=n0e kT
Данное выражение называется распределением Больцмана. Из этого соотношения следует, что молекулы располагаются с большей концентрацией (плотностью) там, где их потенциальная энергия меньше, и, наоборот, с меньшей
плотностью в местах, где их потенциальная энергия больше.

Распределение Больцмана. 13.10
Закон Максвелла дает распределение частиц по кинетической энергии (из распределения по v2, просто получить распределение по кинетической энергии), распределение Больцмана зависимость от потенциальной энергии. Эти распределения можно объединить в один закон Максвелла- Больцмана, согласно которому содержащееся в единице объема количество молекул, скорость которых лежит между v
и v+dv, равно: |
m |
3 2 |
|
|
ЕП + |
mv2 |
|
|
E |
|
|||
|
|
|
2 |
|
|
|
|
||||||
|
|
|
|
|
|
2 |
dv : |
|
|
2 |
|
||
|
|
|
|
|
|
||||||||
dnЕП ,v n0 |
4 |
|
|
e |
|
kT v |
e |
kT v |
dv |
||||
|
|
||||||||||||
|
2 kT |
|
|
|
|
|
|
|
|
|
|
||
где n0 – число молекул в единице объема в той точке, в которой |
||
Е =0, а полная энергия молекулы Е. Интегрирование этого |
||
П |
|
приводит к распределению |
выражения в пределах от 0 до |
||
Больцмана
Лекция 14
Основы термодинамики. Работа газа при различных процессах. Адиабатический процесс. Круговой процесс. Тепловые двигатели, их КПД Цикл Карно. КПД цикла Карно.
Термодинамическая система может разными способами обмениваться энергией с окружающей средой, поглощая или отдавая количество теплоты и совершая работу.
Количество теплоты, поступающее в систему, считается положительны (Q > 0).
Если система отдает количество теплоты окружающей среде, то Q < 0.
Если система совершает работу, то эта работа принимается положительной (А > 0).
Если работа совершается внешними источниками над системой, то A < 0.
Работа, совершаемая системой при переходе 1 в 2, зависит от пути, т.е. от конкретных деталей процесса, при этом совершаемая работа будет разной. Точно так же будут разными
количества теплоты, поступающие в
систему или отдаваемые системой при таком переходе

Основы термодинамики. 14.2
Многочисленные эксперименты показывают, что разность Q - A не зависит от характера протекания процесса и определяется только начальным и конечным состояниями системы. Так как эти состояния обладают определенной внутренней энергией U, которая для идеального газа зависит только от температуры газа, то на основании закона сохранения энергии, обобщенного на случай тепловых явлений, можно записать:
Q- A = dU = U2 - U1.
Втепловом процессе, в котором количество теплоты Q поступает в систему и сама система совершает работу A, полная энергия, переданная системе, равна изменению
внутренней энергии системы dU. – Первое начало термодинамики
Если на РV-диаграмме отмечены две точки (два состояния) и с помощью любой комбинации тепловых процессов
осуществлен переход из состояния 1 в состояние 2, то
Основы термодинамики. 14.3
Для любого замкнутого цикла, в результате которого система возвращается в исходное состояние, изменение внутренней
энергии равно нулю
Но это не означает, что в замкнутом цикле не совершается работа или не поглощается (выделяется) количество теплоты.
В формуле, выражающей содержание первого закона, знаки A и Q могут быть разными в зависимости от характера процесса. Соответственно dU может быть как положительной, так и
отрицательной величиной.
Основы термодинамики. 14.4
Другая формулировка первого закона (начала) термодинамики:
количество тепла, сообщенное системе идет на приращение внутренней энергии системы и на совершение системой
работы над внешними телами:
Q U+A
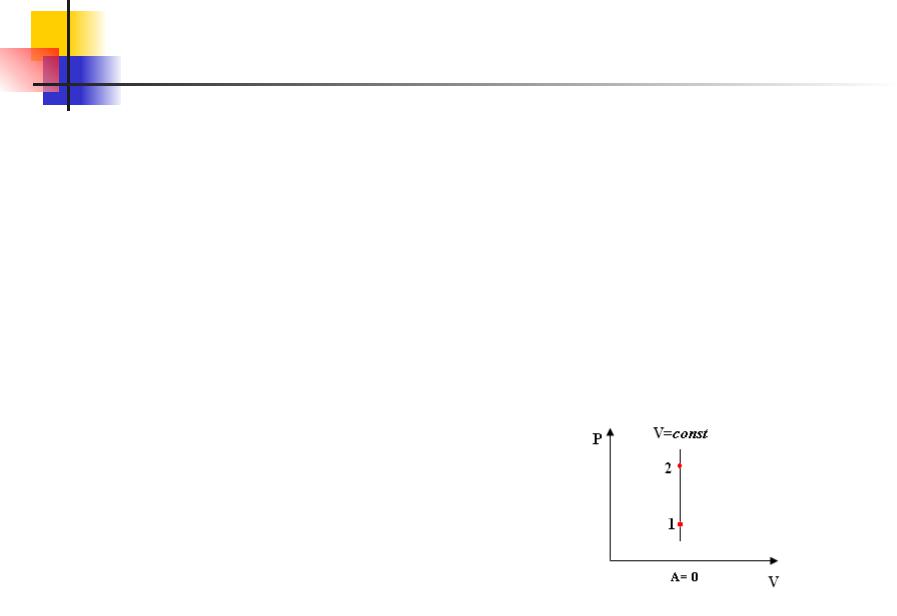
В изохорном процессе (V = const) газ работы не совершает,
A = 0. Следовательно, Q = ΔU . Внутренняя энергия идеального
газа зависит только от температуры. При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия
увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
Основы термодинамики. 14.5
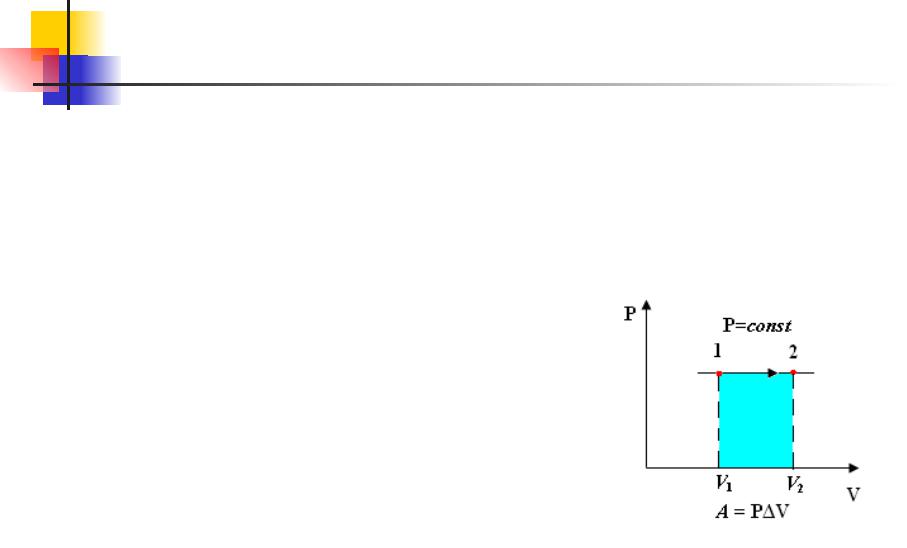
В изобарном процессе (Р = const) работа, совершаемая газом,
выражается соотношениемA = Р(V2 – V1) = РΔV.
Первый закон термодинамики для изобарного процесса дает:
Q = U(T2) – U(T1) + Р(V2 – V1) = ΔU + РΔV
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при
изобарном сжатии уменьшается,
T2 < T1; внутренняя энергия убывает, ΔU < 0.
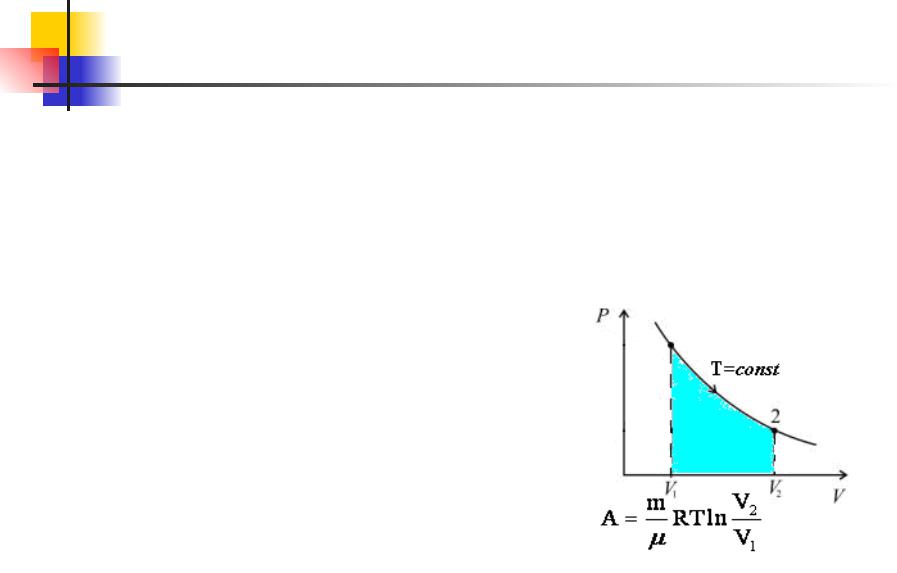
Основы термодинамики. 14.6
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа,
U = 0. Первый закон термодинамики для изотермического
процесса выражается соотношением Q = A.
Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло,
которое передается окружающим телам.

Основы термодинамики. 14.7
Наряду с изохорным, изобарным и |
|
изотермическим процессами в термодинамике |
|
часто рассматриваются процессы, |
|
протекающие в отсутствие теплообмена с |
|
окружающими телами. Сосуды с |
|
теплонепроницаемыми стенками называют |
|
адиабатическими оболочками, а процессы |
|
расширения или сжатия газа в |
|
таких сосудах называются адиабатическими. В адиабатическом |
|
процессе Q = 0; поэтому первый закон термодинамики принимает |
|
вид: |
A = –ΔU |
|
|
При адиабатическом расширении газ совершает положительную работу (A > 0); поэтому его внутренняя энергия уменьшается (ΔU < 0). Это приводит к понижению температуры газа. Вследствие этого давление газа при адиабатическом
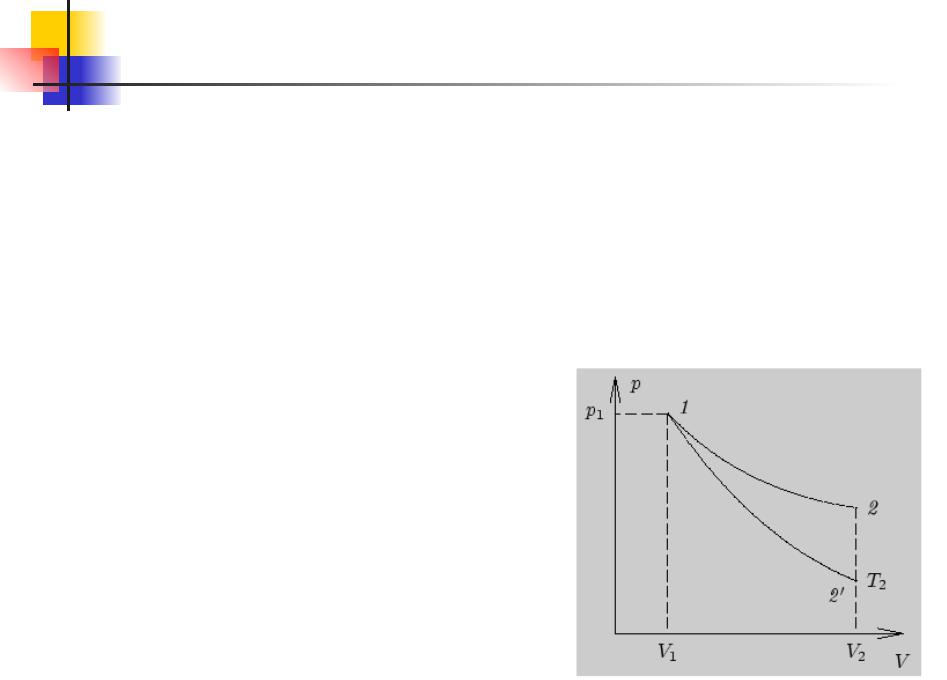
расширении убывает быстрее, чем при изотермическом расширении.

Основы термодинамики. 14.8
В термодинамике выводится уравнение адиабатического процесса для идеального газа.
В координатах (p, V) это уравнение имеет вид
РVγ = const
Это соотношение называют уравнением Пуассона. Здесь
γ = Cp / CV – показатель адиабаты, Cp и CV – теплоемкости газа в
процессах с постоянным давлением и с постоянным объемом. Работа газа в адиабатическом процессе просто выражается
через температуры T |
1 |
и T |
2 |
начального и конечного состояний: |
|
|
A = CV(T2 – T1). |
Второе начало термодинамики, как и первое, может быть сформулировано несколькими способами. В наиболее очевидной формулировке второе начало гласит, что невозможен
самопроизвольный переход тепла от тела менее нагретого, к телу, более нагретому. Более строго, невозможны такие
процессы, единственным конечным результатом которых был бы
переход тепла от тела, менее нагретого, к телу более
