
- •Общая физика
- •Система отсчета. Материальная точка. Радиус-вектор и вектор перемещения, их связь с координатами точки.
- •Кинематика. 1.3
- •Кинематика. 1.4
- •Кинематика. 1.5
- •Кинематика. 1.6
- •Кинематика. 1.7
- •Кинематика. 1.8
- •Кинематика. 1.9
- •Кинематика. 1.10
- •Лекция 2
- •Кинематика. 2.2
- •Кинематика. 2.3
- •Кинематика. 2.4
- •Кинематика. 2.5
- •Кинематика. 2.6
- •Кинематика. 2.7
- •Кинематика. 2.8
- •Кинематика. 2.9
- •Кинематика. 2.10
- •Лекция 3
- •Динамика. 3.2
- •Динамика. 3.3
- •Динамика. 3.4
- •Динамика. 3.5
- •Динамика. 3.6
- •Динамика. 3.7
- •Динамика. 3.8
- •Динамика. 3.9
- •Динамика. 3.10
- •Динамика. 3.11
- •Замкнутая система материальных точек. Закон сохранения импульса. Момент импульса, закон сохранения момента импульса.
- •Законы сохранения. 4.2
- •Законы сохранения. 4.3
- •Законы сохранения. 4.4
- •Законы сохранения. 4.5
- •Законы сохранения. 4.7
- •Законы сохранения. 4.8
- •Законы сохранения. 4.9
- •Законы сохранения. 4.10
- •Законы сохранения. 4.11
- •Лекция 5
- •Законы сохранения. 5.2
- •Законы сохранения. 5.3
- •Законы сохранения. 5.4
- •Законы сохранения. 5.5
- •Законы сохранения. 5.6
- •Законы сохранения. 5.7
- •Законы сохранения. 5.8
- •Законы сохранения. 5.9
- •Законы сохранения. 5.10
- •Упругие и квазиупругие силы. Закон Гука. Гармонические
- •Колебания. 6.2
- •Колебания. 6.3
- •Колебания. 6.4
- •Колебания. 6.5
- •Колебания. 6.6
- •Колебания. 6.7
- •Колебания. 6.8
- •Колебания. 6.9
- •Колебания. 6.10
- •Лекция 7 Затухающие колебания. Коэффициент затухания и
- •Колебания. 7.2
- •Колебания. 7.3
- •Колебания. 7.4
- •Колебания. 7.5
- •Колебания. 7.6
- •Колебания. 7.7
- •Колебания. 7.8
- •Колебания. 7.9
- •Колебания. 7.10
- •Лекция 8 Вынужденные колебания. Резонанс
- •Вынужденные колебания. 8.2
- •Вынужденные колебания. 8.3
- •Вынужденные колебания. 8.4
- •Вынужденные колебания. 8.5
- •Вынужденные колебания. 8.6
- •Вынужденные колебания. 8.7
- •Вынужденные колебания. 8.8
- •Вынужденные колебания. 8.9
- •Вынужденные колебания. 8.10
- •Лекция 9
- •Основы МКТ. 9.2
- •Основы МКТ. 9.3
- •Основы МКТ. 9.4
- •Основы МКТ. 9.5
- •Основы МКТ. 9.6
- •Основы МКТ. 9.7
- •Основы МКТ. 9.8
- •Основы МКТ. 9.9
- •Основы МКТ. 9.10
- •Связь кинетической энергии молекул газа с температурой и
- •Основы МКТ. 10.2
- •Основы МКТ. 10.3
- •Основы МКТ. 10.4
- •Основы МКТ. 10.5
- •Основы МКТ. 10.6
- •Основы МКТ. 10.7
- •Основы МКТ. 10.8
- •Основы МКТ. 10.9
- •Основы МКТ. 10.10
- •Внутренняя энергия термодинамической системы. Теплоемкость. Работа, совершаемая газом при изменении объема
- •Термодинамика. 11.2
- •Термодинамика. 11.3
- •Термодинамика. 11.4
- •Термодинамика. 11.5
- •Термодинамика. 11.6
- •Термодинамика. 11.7
- •Термодинамика. 11.8
- •Термодинамика. 11.9
- •Термодинамика. 11.10
- •Лекция 12 Распределение молекул газа по скоростям. Функция
- •Распределение Максвелла. 12.2
- •Распределение Максвелла. 12.3
- •Распределение Максвелла. 12.4
- •Распределение Максвелла. 12.5
- •Распределение Максвелла. 12.6
- •Распределение Максвелла. 12.7
- •Распределение Максвелла. 12.8
- •Распределение Максвелла. 12.9
- •Распределение Максвелла. 12.10
- •Опыты Штерна и Ламмерта. Идеальный газ в поле силы тяжести, барометрическая формула. Распределения
- •Распределение Больцмана. 13.2
- •Распределение Больцмана. 13.3
- •Распределение Больцмана. 13.4
- •Распределение Больцмана. 13.5
- •Распределение Больцмана. 13.6
- •Распределение Больцмана. 13.7
- •Распределение Больцмана. 13.8
- •Распределение Больцмана. 13.9
- •Распределение Больцмана. 13.10
- •Лекция 14
- •Основы термодинамики. 14.2
- •Основы термодинамики. 14.3
- •Основы термодинамики. 14.4
- •Основы термодинамики. 14.5
- •Основы термодинамики. 14.6
- •Основы термодинамики. 14.7
- •Основы термодинамики. 14.8
- •Основы термодинамики. 14.9
- •Основы термодинамики. 14.10
- •Основы термодинамики. 14.11
- •Основы термодинамики. 14.12
- •Лекция 15 Электрические заряды. Точечный заряд. Закон Кулона.
- •Электростатика. 15.2
- •Электростатика. 15.3
- •Электростатика. 15.4
- •Электростатика. 15.5
- •Электростатика. 15.6
- •Электростатика. 15.7
- •Электростатика. 15.8
- •Электростатика. 15.9
- •Электростатика. 15.10
- •Лекция 16 Поток вектора напряженности электрического поля. Теорема
- •Электростатика. 16.2
- •Электростатика. 16.3
- •Электростатика. 16.4
- •Электростатика. 16.5
- •Электростатика. 16.6
- •Электростатика. 16.7
- •Электростатика. 16.8
- •Электростатика. 16.9
- •Электростатика. 16.10
- •Лекция 17 Работа сил электростатического поля. Потенциал.
- •Электростатика. 17.2
- •Электростатика. 17.3
- •Электростатика. 17.4
- •Электростатика. 17.5
- •Электростатика. 17.6
- •Электростатика. 17.7
- •Электростатика. 17.8
- •Электростатика. 17.9
- •Электростатика. 17.10
- •Лекция 18 Поле В. Сила Лоренца. Закон Био – Савара. Циркуляция и
- •Магнитное поле в вакууме 18.2
- •Магнитное поле в вакууме 18.3
- •Магнитное поле в вакууме 18.4
- •Магнитное поле в вакууме 18.5
- •Магнитное поле в вакууме 18.6
- •Магнитное поле в вакууме 18.7
- •Магнитное поле в вакууме 18.8
- •Магнитное поле в вакууме 18.9
- •Магнитное поле в вакууме 18.10
- •Лекция 19
- •Магнитное поле в вакууме 19.2
- •Магнитное поле в вакууме 19.3
- •Магнитное поле в вакууме 19.4
- •Магнитное поле в вакууме 19.5
- •Магнитное поле в вакууме 19.6
- •Магнитное поле в вакууме 19.7
- •Магнитное поле в вакууме 19.8
- •Магнитное поле в вакууме 19.9
- •Магнитное поле в вакууме 19.10
- •Магнитное поле в вакууме 19.11
- •Лекция 20 Сила Ампера. Работа поля В при перемещении контура
- •Магнитное поле в вакууме 20.2
- •Магнитное поле в вакууме 20.3
- •Магнитное поле в вакууме 20.4
- •Магнитное поле в вакууме 20.5
- •Магнитное поле в вакууме 20.6
- •Магнитное поле в вакууме 20.7
- •Магнитное поле в вакууме 20.8
- •Магнитное поле в вакууме 20.9
- •Магнитное поле в вакууме 20.10
- •Магнитное поле в вакууме 20.11
- •Магнитное поле в вакууме 20.12
- •Лекция 21
- •Диэлектрики 21.2
- •Диэлектрики 21.3
- •Диэлектрики 21.4
- •Диэлектрики 21.5
- •Диэлектрики 21.6
- •Диэлектрики 21.7
- •Диэлектрики 21.8
- •Диэлектрики 21.9
- •Диэлектрики 21.10
- •Лекция 22
- •Магнетики 22.2
- •Магнетики 22.3
- •Магнетики 22.4
- •Магнетики 22.5
- •Магнетики 22.6
- •Магнетики 22.7
- •Магнетики 22.8
- •Магнетики 22.9
- •Магнетики 22.10
- •Магнетики 22.11
- •Лекция 23 Законы геометрической оптики. Принцип Ферма. Явление
- •Геометрическая оптика 23.2
- •Геометрическая оптика 23.3
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.5
- •Геометрическая оптика 23.6
- •Геометрическая оптика 23.7
- •Геометрическая оптика 23.8
- •Геометрическая оптика 23.9
- •Геометрическая оптика 23.10
- •Лекция 24 Оптическая система. Кардинальные плоскости.
- •Оптическая система. 24.2
- •Оптическая система. 24.3
- •Оптическая система. 24.4
- •Оптическая система. 24.5
- •Оптическая система. 24.6
- •Оптическая система. 24.7
- •Оптическая система. 24.8
- •Оптическая система. 24.9
- •Оптическая система. 24.10
- •Лекция 25
- •Тонкие линзы. 25.2
- •Тонкие линзы. 25.3
- •Тонкие линзы. 25.4
- •Тонкие линзы. 25.5
- •Тонкие линзы. 25.6
- •Тонкие линзы. 25.7
- •Тонкие линзы. 25.8
- •Тонкие линзы. 25.9
- •Тонкие линзы. 25.10
- •Интерференция света. Когерентные источники. Интерференция от двух когерентных источников. Бипризма Френеля. Интерференция при
- •Интерференция. 26.2
- •Интерференция. 26.3
- •Интерференция. 26.4
- •Интерференция. 26.5
- •Интерференция. 26.6
- •Интерференция. 26.7
- •Интерференция. 26.8
- •Интерференция. 26.9
- •Интерференция. 26.10
- •Интерференция. 26.11
- •Интерференция. 26.12
- •Лекция 27 Дифракция света. Принцип Гюйгенса-Френеля. Зоны
- •Дифракция. 27.2
- •Дифракция. 27.3
- •Колебания приходящие в точку Р от аналогичных точек двух соседних зон, находятся в
- •Дифракция. 27.5
- •Дифракция. 27.6
- •Дифракция. 27.7
- •Дифракция. 27.8
- •Дифракция. 27.9
- •Дифракция. 27.10
- •Дифракция Френеля от простейших преград. Дифракция от
- •Дифракция. 28.2
- •Дифракция. 28.3
- •Дифракция. 28.4
- •Дифракция. 28.5
- •Дифракция. 28.6
- •Дифракция. 28.7
- •Дифракция. 28.8
- •Дифракция. 28.9
- •Дифракция. 28.10
- •Закономерности в атомных спектрах. Опыт по рассеянию альфа частиц.
- •Атомная физика. 29.2
- •Атомная физика. 29.3
- •Атомная физика. 29.4
- •Атомная физика. 29.5
- •Атомная физика. 29.6
- •Атомная физика. 29.7
- •Атомная физика. 29.8
- •Атомная физика. 29.9
- •Атомная физика. 29.10
- •Лекция 30 Гипотеза де Бройля. Принцип неопределенности.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Лекция 31 Таблица Менделеева. Состав и характеристики атомного
- •Элементы атомной физики. 31.2
- •Элементы атомной физики. 31.3
- •Элементы атомной физики. 31.4
- •Элементы атомной физики. 31.5
- •Элементы атомной физики. 31.6
- •Элементы атомной физики. 31.7
- •Элементы атомной физики. 31.8
- •Элементы атомной физики. 31.9
- •Элементы атомной физики. 31.10
- •Элементы атомной физики. 31.11
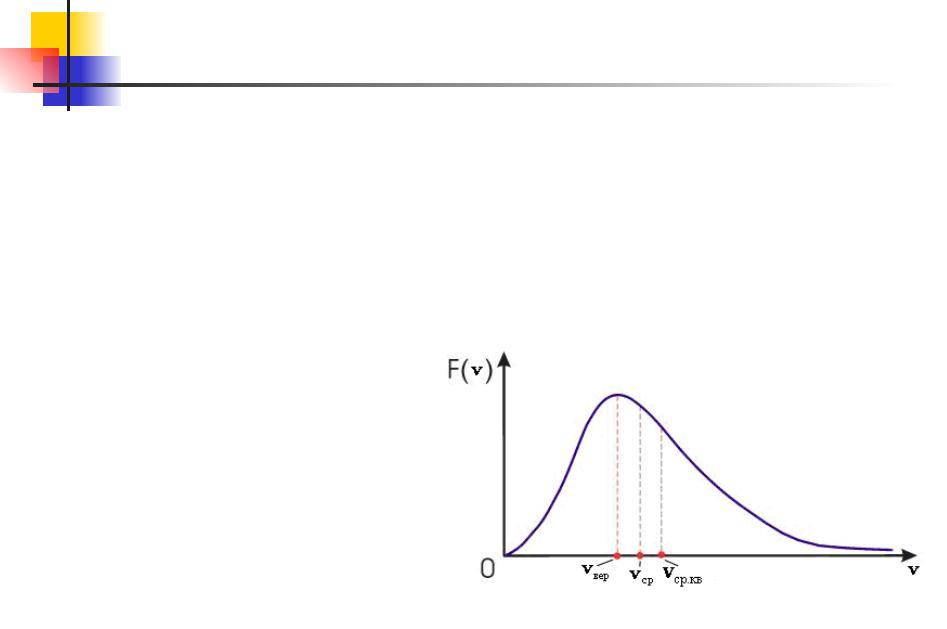
Распределение Максвелла. 12.9
Сопоставляя значения vвер, vср и vср.кв, можно заметить, что они одинаковым образом зависят от температуры и массы молекулы.
Если принять vвер=1, vср=1.13 и vср.кв=1.22. Необходимо подчеркнуть, что закон распределения молекул газа по
скоростям и все вытекающие из него следствия справедливы только для газа, находящегося в равновесном состоянии.
Относительное количество молекул, скорость которых превышает некоторое значение v0, определяется
выражением:
F(v)dv
v0
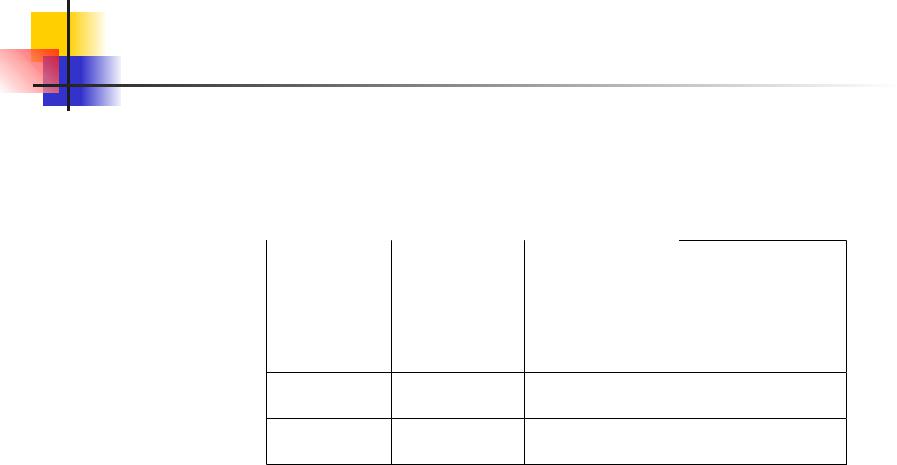
Распределение Максвелла. 12.10
Относительное число молекул, скорость которых превышает
некоторое значение v0, сильно растет с температурой. В
таблице приведены относительные количества молекул
скорости которых лежат в определенных интервалов
относительно наиболv ее вероятной,% |
скорости. |
ΔN |
|
|
|
ΔN |
v |
|
,% |
vвер |
N |
vвер |
N |
|
|
|
|
||
0 – 0.5 |
8.1 |
2 – 3 |
4.6 |
|
0.5 – 1.5 |
70.7 |
>3 |
0.04 |
|
1.5 – 2 |
16.6 |
>5 |
8 10-9 |
|
Как видно из таблицы, более чем у 70% всех молекул скорость отличается от наиболее вероятной не больше чем
на 50%. Скоростью, более чем в 3 раза превышающей vвер, обладает в среднем только 0.04% молекул.

Опыты Штерна и Ламмерта. Идеальный газ в поле силы тяжести, барометрическая формула. Распределения Больцмана.
Первое экспериментальное определение скоростей молекул было проведено Штерном в1920 г. Прибор, использованный для этой цели, состоял из двух коаксиальных цилиндров. По оси цилиндров была натянута платиновая нить, покрытая серебром. При нагревании нити электрическим током с ее поверхности испарялись атомы серебра
Покинув нить, атомы двигались по
радиальным направлениям. Внутренний цилиндр имел узкую продольную щель, через которую проходил наружу узкий пучок атомов. Весь прибор был помещен в вакуум, за счет этого удавалось избавиться от рассеивания
молекулярного(атомного) пучка.
Если привести прибор во вращение то произойдет размытие полоски в результате того, что атомы обладают различными скоростями, вследствие чего
будут преодолевать расстояние между цилиндрами за
различное время.

 Распределение Больцмана. 13.2
Распределение Больцмана. 13.2
Смещение относительно первоначального положение равно
Δs = RΔφ R – радиус внешнего цилиндра.
Δφ – угол на который повернутся цилиндры.
Всвою очередь Δφ связано с угловой скоростью относительного вращения цилиндров
Δφ=ωt,
где t – время за которое атом серебра пролетает зазор между цилиндрами.
t =R/v.
Радиус внутреннего цилиндра мал. Окончательно получаем:
v R2
s
Измерив, смещение следа Δs и скорость вращения цилиндров, можно определить скорость атомов v. Исследование профиля следа позволяет составить примерное представление о
распределении атомов серебра по скоростям. Результаты опыта Штерна подтвердили правильность оценки средней скорости
атомов, которая вытекает из распределения Максвелла.
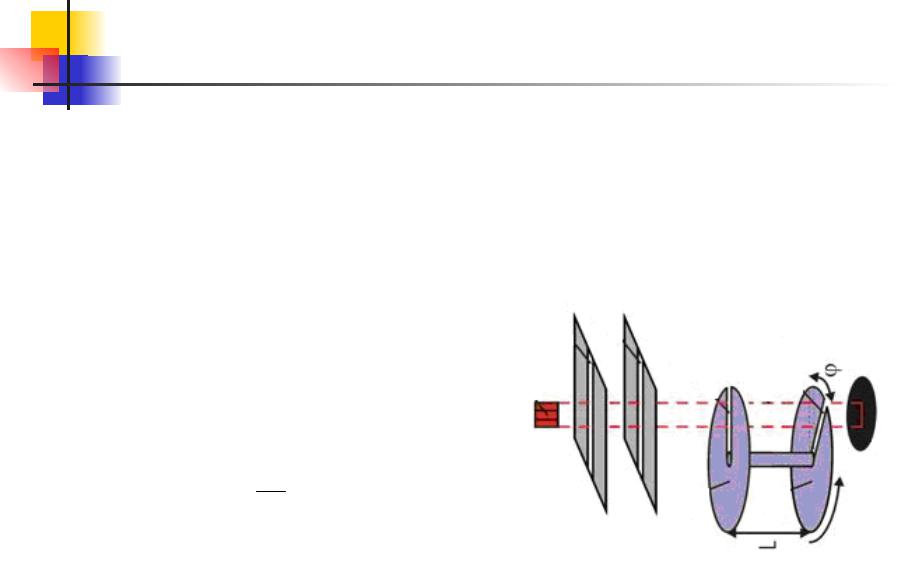
Распределение Больцмана. 13.3
В опыте Ламмерта (1929 г.) закон распределения был проверен
более точно. Молекулярный пучок, выходящий из отверстия в сосуде, в котором находится газ в равновесном состоянии,
проходил сквозь два вращающихся на одной оси диска. В
дисках были щели вдоль радиусов. Если щели повернуты на угол φ относительно друг друга,
диски повернутся на угол φ в Поэтомуt=φ/ω. через обе щели расстояние между
которыми l, пройдут только
молекулы со скоростью: v l
Меняя угловую скорость ω или угол φ между радиальными щелями, можно выделить из пучка
молекулы разных скоростей. Улавливая детектором эти молекулы в течение одинакового
времени, можно найти их относительной

Распределение Больцмана. 13.4
В отсутствии внешних сил концентрация молекул газа в
состоянии термодинамического равновесия всюду одинакова. Если же газ находится во внешнем поле сил, например в поле
силы тяжести, то ситуация становится иной. При отсутствии
теплового движение все молекулы “упали” бы на поверхность Земли. Наличие же теплового движения мешает этому. В
результате совместного действия этих двух факторов
устанавливается равновесия, и концентрация молекул
становится зависящей от высоты. При тепловом равновесии температура Т должна быть одинакова по всей толщине газа,
иначе бы возникли потоки тепла, и состояние газа не было бы
равновесным, т.е. будет рассматриваться изотермическая атмосфера.

Распределение Больцмана. 13.5
Атмосферное давление на какой-либо высоте h обусловлено весом вышележащих слоев газа. Пусть Р давление газа на высоте h. Тогда давление на высоте h+dh, будет P+dP, причем, если dh больше нуля, то dP будет меньше нуля, так как вес вышележащих слоев атмосферы, а следовательно, и давление с высотой убывают. Разность давлений P и P+dP равна весу газа, заключенного в объеме цилиндра с площадью основания,P-(P+dP) gdh
равной единице, и высотой dh:
где ρ – плотность газа на высоте h. Отсюда:
dP gdh

Распределение Больцмана. 13.6
Плотность газа можно выразить, через давление и температуру, используя уравнение состояния. Так как при условиях близких к нормальным, атмосферные газы можно рассматривать как идеальные.
m P V RT
одставив это выражение в dP, получим:
откуда,
dP PRTg gdh dPP RTg gdh
Для случая, когда температура постоянна, интегрирование этого
соотношения дает: gh
ln P RT ln C
Распределение Больцмана. 13.7
где С – постоянная. Произведя потенцирование этого |
|
выражения, получаем: |
gh |
P Ce |
RT |
Значение постоянной С, находим из того условия, что давление при h=0 нам известно и равно P0. Подставив h=0, получим Р0=С.
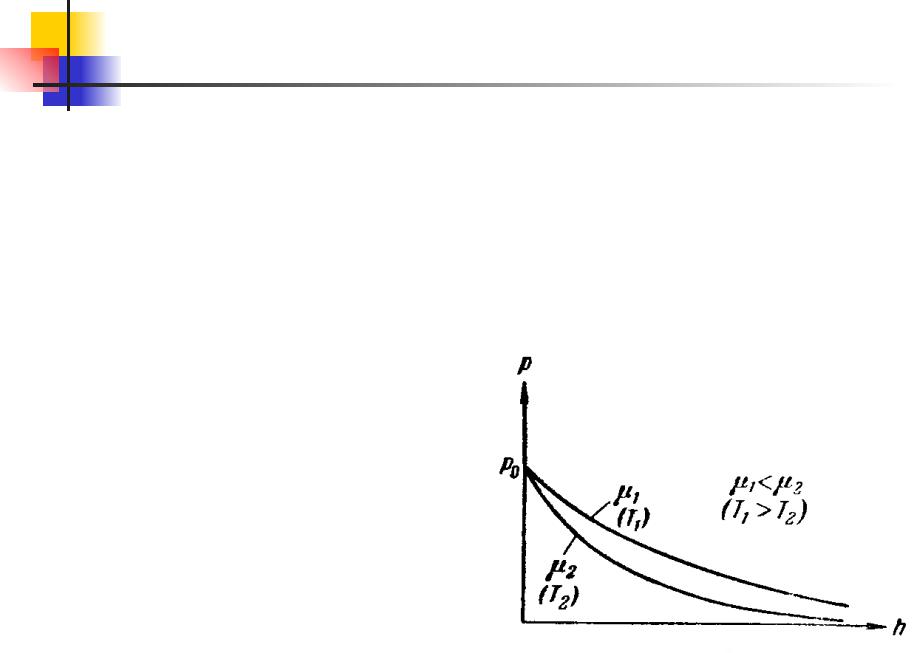
Таким образом в случае изотермической атмосферы
зависимость давления от высотыgh
P P0e RT
Эта формула называется
барометрической. Из анализа этого соотношения следует, что давление с высотой убывает тем быстрее, чем тяжелее газ и чем
ниже температура.

Распределение Больцмана. 13.8
Заменив в барометрической формуле P через nkT, получим
закон изменения концентрации газа с высотой:
gh
n=n0e RT
где n0 – концентрация газа на высоте равной нулю. Полученное
соотношение можно преобразовать, заменив μ/R равным ему
отношением m/k, где m – масса одной молекулы, k – постоянная Больцмана n=n0e mghkT
Из этого выражение следует, что с уменьшением температуры концентрация газа на высотах отличных от нуля, убывает, обращаясь в нуль при Т=0. При абсолютном нуле все молекулы воздуха расположились бы на земной поверхности. При больших температурах наоборот концентрация слабо уменьшается с высотой. Данный факт имеет простое физическое объяснение.
Действительно распределение молекул газа получается в результате действия двух “конкурирующих” тенденций
