
- •Общая физика
- •Система отсчета. Материальная точка. Радиус-вектор и вектор перемещения, их связь с координатами точки.
- •Кинематика. 1.3
- •Кинематика. 1.4
- •Кинематика. 1.5
- •Кинематика. 1.6
- •Кинематика. 1.7
- •Кинематика. 1.8
- •Кинематика. 1.9
- •Кинематика. 1.10
- •Лекция 2
- •Кинематика. 2.2
- •Кинематика. 2.3
- •Кинематика. 2.4
- •Кинематика. 2.5
- •Кинематика. 2.6
- •Кинематика. 2.7
- •Кинематика. 2.8
- •Кинематика. 2.9
- •Кинематика. 2.10
- •Лекция 3
- •Динамика. 3.2
- •Динамика. 3.3
- •Динамика. 3.4
- •Динамика. 3.5
- •Динамика. 3.6
- •Динамика. 3.7
- •Динамика. 3.8
- •Динамика. 3.9
- •Динамика. 3.10
- •Динамика. 3.11
- •Замкнутая система материальных точек. Закон сохранения импульса. Момент импульса, закон сохранения момента импульса.
- •Законы сохранения. 4.2
- •Законы сохранения. 4.3
- •Законы сохранения. 4.4
- •Законы сохранения. 4.5
- •Законы сохранения. 4.7
- •Законы сохранения. 4.8
- •Законы сохранения. 4.9
- •Законы сохранения. 4.10
- •Законы сохранения. 4.11
- •Лекция 5
- •Законы сохранения. 5.2
- •Законы сохранения. 5.3
- •Законы сохранения. 5.4
- •Законы сохранения. 5.5
- •Законы сохранения. 5.6
- •Законы сохранения. 5.7
- •Законы сохранения. 5.8
- •Законы сохранения. 5.9
- •Законы сохранения. 5.10
- •Упругие и квазиупругие силы. Закон Гука. Гармонические
- •Колебания. 6.2
- •Колебания. 6.3
- •Колебания. 6.4
- •Колебания. 6.5
- •Колебания. 6.6
- •Колебания. 6.7
- •Колебания. 6.8
- •Колебания. 6.9
- •Колебания. 6.10
- •Лекция 7 Затухающие колебания. Коэффициент затухания и
- •Колебания. 7.2
- •Колебания. 7.3
- •Колебания. 7.4
- •Колебания. 7.5
- •Колебания. 7.6
- •Колебания. 7.7
- •Колебания. 7.8
- •Колебания. 7.9
- •Колебания. 7.10
- •Лекция 8 Вынужденные колебания. Резонанс
- •Вынужденные колебания. 8.2
- •Вынужденные колебания. 8.3
- •Вынужденные колебания. 8.4
- •Вынужденные колебания. 8.5
- •Вынужденные колебания. 8.6
- •Вынужденные колебания. 8.7
- •Вынужденные колебания. 8.8
- •Вынужденные колебания. 8.9
- •Вынужденные колебания. 8.10
- •Лекция 9
- •Основы МКТ. 9.2
- •Основы МКТ. 9.3
- •Основы МКТ. 9.4
- •Основы МКТ. 9.5
- •Основы МКТ. 9.6
- •Основы МКТ. 9.7
- •Основы МКТ. 9.8
- •Основы МКТ. 9.9
- •Основы МКТ. 9.10
- •Связь кинетической энергии молекул газа с температурой и
- •Основы МКТ. 10.2
- •Основы МКТ. 10.3
- •Основы МКТ. 10.4
- •Основы МКТ. 10.5
- •Основы МКТ. 10.6
- •Основы МКТ. 10.7
- •Основы МКТ. 10.8
- •Основы МКТ. 10.9
- •Основы МКТ. 10.10
- •Внутренняя энергия термодинамической системы. Теплоемкость. Работа, совершаемая газом при изменении объема
- •Термодинамика. 11.2
- •Термодинамика. 11.3
- •Термодинамика. 11.4
- •Термодинамика. 11.5
- •Термодинамика. 11.6
- •Термодинамика. 11.7
- •Термодинамика. 11.8
- •Термодинамика. 11.9
- •Термодинамика. 11.10
- •Лекция 12 Распределение молекул газа по скоростям. Функция
- •Распределение Максвелла. 12.2
- •Распределение Максвелла. 12.3
- •Распределение Максвелла. 12.4
- •Распределение Максвелла. 12.5
- •Распределение Максвелла. 12.6
- •Распределение Максвелла. 12.7
- •Распределение Максвелла. 12.8
- •Распределение Максвелла. 12.9
- •Распределение Максвелла. 12.10
- •Опыты Штерна и Ламмерта. Идеальный газ в поле силы тяжести, барометрическая формула. Распределения
- •Распределение Больцмана. 13.2
- •Распределение Больцмана. 13.3
- •Распределение Больцмана. 13.4
- •Распределение Больцмана. 13.5
- •Распределение Больцмана. 13.6
- •Распределение Больцмана. 13.7
- •Распределение Больцмана. 13.8
- •Распределение Больцмана. 13.9
- •Распределение Больцмана. 13.10
- •Лекция 14
- •Основы термодинамики. 14.2
- •Основы термодинамики. 14.3
- •Основы термодинамики. 14.4
- •Основы термодинамики. 14.5
- •Основы термодинамики. 14.6
- •Основы термодинамики. 14.7
- •Основы термодинамики. 14.8
- •Основы термодинамики. 14.9
- •Основы термодинамики. 14.10
- •Основы термодинамики. 14.11
- •Основы термодинамики. 14.12
- •Лекция 15 Электрические заряды. Точечный заряд. Закон Кулона.
- •Электростатика. 15.2
- •Электростатика. 15.3
- •Электростатика. 15.4
- •Электростатика. 15.5
- •Электростатика. 15.6
- •Электростатика. 15.7
- •Электростатика. 15.8
- •Электростатика. 15.9
- •Электростатика. 15.10
- •Лекция 16 Поток вектора напряженности электрического поля. Теорема
- •Электростатика. 16.2
- •Электростатика. 16.3
- •Электростатика. 16.4
- •Электростатика. 16.5
- •Электростатика. 16.6
- •Электростатика. 16.7
- •Электростатика. 16.8
- •Электростатика. 16.9
- •Электростатика. 16.10
- •Лекция 17 Работа сил электростатического поля. Потенциал.
- •Электростатика. 17.2
- •Электростатика. 17.3
- •Электростатика. 17.4
- •Электростатика. 17.5
- •Электростатика. 17.6
- •Электростатика. 17.7
- •Электростатика. 17.8
- •Электростатика. 17.9
- •Электростатика. 17.10
- •Лекция 18 Поле В. Сила Лоренца. Закон Био – Савара. Циркуляция и
- •Магнитное поле в вакууме 18.2
- •Магнитное поле в вакууме 18.3
- •Магнитное поле в вакууме 18.4
- •Магнитное поле в вакууме 18.5
- •Магнитное поле в вакууме 18.6
- •Магнитное поле в вакууме 18.7
- •Магнитное поле в вакууме 18.8
- •Магнитное поле в вакууме 18.9
- •Магнитное поле в вакууме 18.10
- •Лекция 19
- •Магнитное поле в вакууме 19.2
- •Магнитное поле в вакууме 19.3
- •Магнитное поле в вакууме 19.4
- •Магнитное поле в вакууме 19.5
- •Магнитное поле в вакууме 19.6
- •Магнитное поле в вакууме 19.7
- •Магнитное поле в вакууме 19.8
- •Магнитное поле в вакууме 19.9
- •Магнитное поле в вакууме 19.10
- •Магнитное поле в вакууме 19.11
- •Лекция 20 Сила Ампера. Работа поля В при перемещении контура
- •Магнитное поле в вакууме 20.2
- •Магнитное поле в вакууме 20.3
- •Магнитное поле в вакууме 20.4
- •Магнитное поле в вакууме 20.5
- •Магнитное поле в вакууме 20.6
- •Магнитное поле в вакууме 20.7
- •Магнитное поле в вакууме 20.8
- •Магнитное поле в вакууме 20.9
- •Магнитное поле в вакууме 20.10
- •Магнитное поле в вакууме 20.11
- •Магнитное поле в вакууме 20.12
- •Лекция 21
- •Диэлектрики 21.2
- •Диэлектрики 21.3
- •Диэлектрики 21.4
- •Диэлектрики 21.5
- •Диэлектрики 21.6
- •Диэлектрики 21.7
- •Диэлектрики 21.8
- •Диэлектрики 21.9
- •Диэлектрики 21.10
- •Лекция 22
- •Магнетики 22.2
- •Магнетики 22.3
- •Магнетики 22.4
- •Магнетики 22.5
- •Магнетики 22.6
- •Магнетики 22.7
- •Магнетики 22.8
- •Магнетики 22.9
- •Магнетики 22.10
- •Магнетики 22.11
- •Лекция 23 Законы геометрической оптики. Принцип Ферма. Явление
- •Геометрическая оптика 23.2
- •Геометрическая оптика 23.3
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.5
- •Геометрическая оптика 23.6
- •Геометрическая оптика 23.7
- •Геометрическая оптика 23.8
- •Геометрическая оптика 23.9
- •Геометрическая оптика 23.10
- •Лекция 24 Оптическая система. Кардинальные плоскости.
- •Оптическая система. 24.2
- •Оптическая система. 24.3
- •Оптическая система. 24.4
- •Оптическая система. 24.5
- •Оптическая система. 24.6
- •Оптическая система. 24.7
- •Оптическая система. 24.8
- •Оптическая система. 24.9
- •Оптическая система. 24.10
- •Лекция 25
- •Тонкие линзы. 25.2
- •Тонкие линзы. 25.3
- •Тонкие линзы. 25.4
- •Тонкие линзы. 25.5
- •Тонкие линзы. 25.6
- •Тонкие линзы. 25.7
- •Тонкие линзы. 25.8
- •Тонкие линзы. 25.9
- •Тонкие линзы. 25.10
- •Интерференция света. Когерентные источники. Интерференция от двух когерентных источников. Бипризма Френеля. Интерференция при
- •Интерференция. 26.2
- •Интерференция. 26.3
- •Интерференция. 26.4
- •Интерференция. 26.5
- •Интерференция. 26.6
- •Интерференция. 26.7
- •Интерференция. 26.8
- •Интерференция. 26.9
- •Интерференция. 26.10
- •Интерференция. 26.11
- •Интерференция. 26.12
- •Лекция 27 Дифракция света. Принцип Гюйгенса-Френеля. Зоны
- •Дифракция. 27.2
- •Дифракция. 27.3
- •Колебания приходящие в точку Р от аналогичных точек двух соседних зон, находятся в
- •Дифракция. 27.5
- •Дифракция. 27.6
- •Дифракция. 27.7
- •Дифракция. 27.8
- •Дифракция. 27.9
- •Дифракция. 27.10
- •Дифракция Френеля от простейших преград. Дифракция от
- •Дифракция. 28.2
- •Дифракция. 28.3
- •Дифракция. 28.4
- •Дифракция. 28.5
- •Дифракция. 28.6
- •Дифракция. 28.7
- •Дифракция. 28.8
- •Дифракция. 28.9
- •Дифракция. 28.10
- •Закономерности в атомных спектрах. Опыт по рассеянию альфа частиц.
- •Атомная физика. 29.2
- •Атомная физика. 29.3
- •Атомная физика. 29.4
- •Атомная физика. 29.5
- •Атомная физика. 29.6
- •Атомная физика. 29.7
- •Атомная физика. 29.8
- •Атомная физика. 29.9
- •Атомная физика. 29.10
- •Лекция 30 Гипотеза де Бройля. Принцип неопределенности.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Лекция 31 Таблица Менделеева. Состав и характеристики атомного
- •Элементы атомной физики. 31.2
- •Элементы атомной физики. 31.3
- •Элементы атомной физики. 31.4
- •Элементы атомной физики. 31.5
- •Элементы атомной физики. 31.6
- •Элементы атомной физики. 31.7
- •Элементы атомной физики. 31.8
- •Элементы атомной физики. 31.9
- •Элементы атомной физики. 31.10
- •Элементы атомной физики. 31.11

Основы МКТ. 10.9
В одноатомном газе молекула имеет три степени свободы, соответствующие трем пространственным координатам. Вследствие равноправности этих координат, можно, на основании связи кинетической энергии с температурой, сделать предположение, что на каждую степень свободы молекулы одноатомного газа приходится в среднем кинетическая энергия, равная
12 kT
В случае многоатомного газа распределение энергии по степеням свободы его молекул подчиняется закону
равнораспределения энергии по степеням свободы, который гласит:
Средняя кинетическая энергия, приходящаяся при тепловом
равновесии на одну степень св1ободы молекулы равна
2 kT

Основы МКТ. 10.10
Таким образом, средняя энергия молекулы должна равняться:
Е= 2i kT
где i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
i=nпост + nвращ + 2nколеб
Для молекулы с жесткой связью между атомами i совпадает с числом степеней молекулы.

Внутренняя энергия термодинамической системы. Теплоемкость. Работа, совершаемая газом при изменении объема
Полная энергия термодинамической системы представляет собой сумму кинетической энергии движения всех тел, входящих в систему, потенциальной энергии взаимодействия их между собой и с внешними телами и энергии, содержащейся внутри тел системы. Если из полной энергии вычесть кинетическую энергию, характеризующую макроскопическое движение системы как целого, и потенциальную энергию взаимодействия её тел с внешними макроскопическими телами, то оставшаяся часть будет представлять собой внутреннюю энергию термодинамической системы.
Внутренняя энергия термодинамической системы включает в себя энергию микроскопического движения и взаимодействия частиц системы, а так же их внутримолекулярную и внутриядерную энергии.
Вследствие того, что молекулы идеального газа на расстоянии не взаимодействуют друг с другом внутренняя энергия такого газа будет складываться из энергий отдельных молекул. Следовательно, внутренняя энергия произвольной массы идеального газа m будет равна произведению числа молекул в данной массе газа на энергию одной молекулы

Термодинамика. 11.2
U m Na 2i kT= m 2i RT
Как показывают результаты экспериментов, во многих случаях приращение температуры тела прямо пропорционально количеству теплоты, сообщенного ему. Для количественного описания этого соотношения вводится
коэффициент пропорциональности Стела между количеством
теплоты, сообщаемого телу, и изменением его температуры, называемый теплоемкостью: dQ
Cтела = dT
Этот коэффициент позволяет определить количество теплоты dQ’, которое необходимо сообщить телу для повышения его температуры на величину dT.

Термодинамика. 11.3
Очевидно, что теплоемкость термодинамической системы изменяется при изменении количества вещества в ней. Для систем, находящихся в состоянии термодинамического равновесия, их теплоемкость пропорциональна количеству вещества. Это позволяет ввести для описания свойств тела удельную теплоемкость:
c
и, соответственно, молярную теплоемкость:
C Cтела
Эти теплоемкости связаны между собой через молярную
массу μ следующим соотношением:
c C

Термодинамика. 11.4
Теплоемкость, так же как и количество переданной телу теплоты, зависит от того, каким образом, а точнее при осуществлении какого процесса, теплота передавалась этому телу. Обычно рассматриваются два значения теплоемкости газов:
CV – молярная теплоемкость в изохорном процессе (V = const) и Cp
– молярная теплоемкость в изобарном процессе (p = const).
Если нагревание происходит при постоянном объеме, тело не
совершает работы над внешними телами и, следовательно, все тепло идет на приращение внутренней энергии тела:
dQV dU
Отсюда следует, что теплоемкость любого тела при постоянном объеме равна: dU
CV dT

Термодинамика. 11.5
Следовательно, чтобы получить теплоемкость моля идеального газа при постоянном объеме, нужно продифференцировать по температуре
выражение для моля внутренней энергии идеального газа.
U= m 2i RT= 2i RT
оизведя дифференцирование, получим:
CV 2i R
При изменении объема газа им совершается работа и, соответственно, подведенная теплота и изменение внутренней энергии становятся не равными друг другу. При расширении газа часть подведенной теплоты затрачивается на совершение им работы. Для процесса при постоянном давлении первый
закон термодинамики дает:
QP U P V CV T P V

Термодинамика. 11.6
Отсюда следует: |
C |
P |
QP |
C |
P V |
|
T |
V |
T |
||
|
|
|
|
Отношение V / T может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
При Р = const
PV RT
P V R T , V R
T P
Таким образом, соотношение, выражающее связь между |
|
молярными теплоемкостями CР и CV, имеет вид (формула |
|
Майера): |
CP CV R |
|
|
Термодинамика. 11.7
Молярная теплоемкость CР газа в процессе с постоянным давлением всегда больше молярной теплоемкости CV в процессе с постоянным объемом. Из этой теоремы следует, что молярные теплоемкости газа CР и CV и их отношение γ могут быть записаны в виде
C |
i |
R, C |
P |
C |
R i+2 |
R, = |
CP |
i+2 |
|
|
|||||||
V |
2 |
|
V |
2 |
|
CV i |
||
|
|
|
|
|
||||
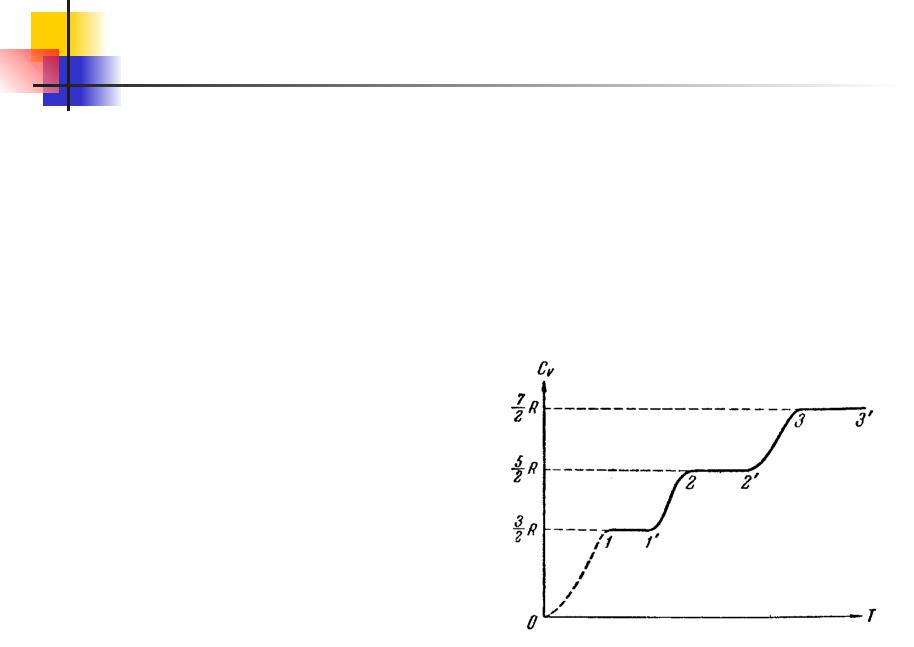
Существует зависимость количества учитываемых при расчете степеней свободы от температуры. Это приводит к тому, что при значительных изменениях температуры теплоемкость газа может
существенно изменяться.

Термодинамика. 11.8
Например, для молекул водорода, при температуре порядка 50 К вращательные степени свободы как бы "вымерзают" и его
молярная теплоёмкость CV становится3близкой к |
. А при |
|
|
2 R |
|
температурах порядка 300 - 400 К вращательные степени |
||
свободы "включаются" и его теплоёмкость CVRприобретает |
||
|
5 |
|
значение |
. При дальнейшем, значительном2 |
по сравнению с |
комнатной, повышении температуры начинают проявляться колебательные степени свободы. Для двухатомного газа, например водорода, это приводит к увеличению энергии его молекулы на величину kT, и соответственно к возрастанию молярной теплоемкости на R. Поэтому при очень высоких
температурах молярная теплоёмкость водорода стремится к значению 72 R .
