
- •Общая физика
- •Система отсчета. Материальная точка. Радиус-вектор и вектор перемещения, их связь с координатами точки.
- •Кинематика. 1.3
- •Кинематика. 1.4
- •Кинематика. 1.5
- •Кинематика. 1.6
- •Кинематика. 1.7
- •Кинематика. 1.8
- •Кинематика. 1.9
- •Кинематика. 1.10
- •Лекция 2
- •Кинематика. 2.2
- •Кинематика. 2.3
- •Кинематика. 2.4
- •Кинематика. 2.5
- •Кинематика. 2.6
- •Кинематика. 2.7
- •Кинематика. 2.8
- •Кинематика. 2.9
- •Кинематика. 2.10
- •Лекция 3
- •Динамика. 3.2
- •Динамика. 3.3
- •Динамика. 3.4
- •Динамика. 3.5
- •Динамика. 3.6
- •Динамика. 3.7
- •Динамика. 3.8
- •Динамика. 3.9
- •Динамика. 3.10
- •Динамика. 3.11
- •Замкнутая система материальных точек. Закон сохранения импульса. Момент импульса, закон сохранения момента импульса.
- •Законы сохранения. 4.2
- •Законы сохранения. 4.3
- •Законы сохранения. 4.4
- •Законы сохранения. 4.5
- •Законы сохранения. 4.7
- •Законы сохранения. 4.8
- •Законы сохранения. 4.9
- •Законы сохранения. 4.10
- •Законы сохранения. 4.11
- •Лекция 5
- •Законы сохранения. 5.2
- •Законы сохранения. 5.3
- •Законы сохранения. 5.4
- •Законы сохранения. 5.5
- •Законы сохранения. 5.6
- •Законы сохранения. 5.7
- •Законы сохранения. 5.8
- •Законы сохранения. 5.9
- •Законы сохранения. 5.10
- •Упругие и квазиупругие силы. Закон Гука. Гармонические
- •Колебания. 6.2
- •Колебания. 6.3
- •Колебания. 6.4
- •Колебания. 6.5
- •Колебания. 6.6
- •Колебания. 6.7
- •Колебания. 6.8
- •Колебания. 6.9
- •Колебания. 6.10
- •Лекция 7 Затухающие колебания. Коэффициент затухания и
- •Колебания. 7.2
- •Колебания. 7.3
- •Колебания. 7.4
- •Колебания. 7.5
- •Колебания. 7.6
- •Колебания. 7.7
- •Колебания. 7.8
- •Колебания. 7.9
- •Колебания. 7.10
- •Лекция 8 Вынужденные колебания. Резонанс
- •Вынужденные колебания. 8.2
- •Вынужденные колебания. 8.3
- •Вынужденные колебания. 8.4
- •Вынужденные колебания. 8.5
- •Вынужденные колебания. 8.6
- •Вынужденные колебания. 8.7
- •Вынужденные колебания. 8.8
- •Вынужденные колебания. 8.9
- •Вынужденные колебания. 8.10
- •Лекция 9
- •Основы МКТ. 9.2
- •Основы МКТ. 9.3
- •Основы МКТ. 9.4
- •Основы МКТ. 9.5
- •Основы МКТ. 9.6
- •Основы МКТ. 9.7
- •Основы МКТ. 9.8
- •Основы МКТ. 9.9
- •Основы МКТ. 9.10
- •Связь кинетической энергии молекул газа с температурой и
- •Основы МКТ. 10.2
- •Основы МКТ. 10.3
- •Основы МКТ. 10.4
- •Основы МКТ. 10.5
- •Основы МКТ. 10.6
- •Основы МКТ. 10.7
- •Основы МКТ. 10.8
- •Основы МКТ. 10.9
- •Основы МКТ. 10.10
- •Внутренняя энергия термодинамической системы. Теплоемкость. Работа, совершаемая газом при изменении объема
- •Термодинамика. 11.2
- •Термодинамика. 11.3
- •Термодинамика. 11.4
- •Термодинамика. 11.5
- •Термодинамика. 11.6
- •Термодинамика. 11.7
- •Термодинамика. 11.8
- •Термодинамика. 11.9
- •Термодинамика. 11.10
- •Лекция 12 Распределение молекул газа по скоростям. Функция
- •Распределение Максвелла. 12.2
- •Распределение Максвелла. 12.3
- •Распределение Максвелла. 12.4
- •Распределение Максвелла. 12.5
- •Распределение Максвелла. 12.6
- •Распределение Максвелла. 12.7
- •Распределение Максвелла. 12.8
- •Распределение Максвелла. 12.9
- •Распределение Максвелла. 12.10
- •Опыты Штерна и Ламмерта. Идеальный газ в поле силы тяжести, барометрическая формула. Распределения
- •Распределение Больцмана. 13.2
- •Распределение Больцмана. 13.3
- •Распределение Больцмана. 13.4
- •Распределение Больцмана. 13.5
- •Распределение Больцмана. 13.6
- •Распределение Больцмана. 13.7
- •Распределение Больцмана. 13.8
- •Распределение Больцмана. 13.9
- •Распределение Больцмана. 13.10
- •Лекция 14
- •Основы термодинамики. 14.2
- •Основы термодинамики. 14.3
- •Основы термодинамики. 14.4
- •Основы термодинамики. 14.5
- •Основы термодинамики. 14.6
- •Основы термодинамики. 14.7
- •Основы термодинамики. 14.8
- •Основы термодинамики. 14.9
- •Основы термодинамики. 14.10
- •Основы термодинамики. 14.11
- •Основы термодинамики. 14.12
- •Лекция 15 Электрические заряды. Точечный заряд. Закон Кулона.
- •Электростатика. 15.2
- •Электростатика. 15.3
- •Электростатика. 15.4
- •Электростатика. 15.5
- •Электростатика. 15.6
- •Электростатика. 15.7
- •Электростатика. 15.8
- •Электростатика. 15.9
- •Электростатика. 15.10
- •Лекция 16 Поток вектора напряженности электрического поля. Теорема
- •Электростатика. 16.2
- •Электростатика. 16.3
- •Электростатика. 16.4
- •Электростатика. 16.5
- •Электростатика. 16.6
- •Электростатика. 16.7
- •Электростатика. 16.8
- •Электростатика. 16.9
- •Электростатика. 16.10
- •Лекция 17 Работа сил электростатического поля. Потенциал.
- •Электростатика. 17.2
- •Электростатика. 17.3
- •Электростатика. 17.4
- •Электростатика. 17.5
- •Электростатика. 17.6
- •Электростатика. 17.7
- •Электростатика. 17.8
- •Электростатика. 17.9
- •Электростатика. 17.10
- •Лекция 18 Поле В. Сила Лоренца. Закон Био – Савара. Циркуляция и
- •Магнитное поле в вакууме 18.2
- •Магнитное поле в вакууме 18.3
- •Магнитное поле в вакууме 18.4
- •Магнитное поле в вакууме 18.5
- •Магнитное поле в вакууме 18.6
- •Магнитное поле в вакууме 18.7
- •Магнитное поле в вакууме 18.8
- •Магнитное поле в вакууме 18.9
- •Магнитное поле в вакууме 18.10
- •Лекция 19
- •Магнитное поле в вакууме 19.2
- •Магнитное поле в вакууме 19.3
- •Магнитное поле в вакууме 19.4
- •Магнитное поле в вакууме 19.5
- •Магнитное поле в вакууме 19.6
- •Магнитное поле в вакууме 19.7
- •Магнитное поле в вакууме 19.8
- •Магнитное поле в вакууме 19.9
- •Магнитное поле в вакууме 19.10
- •Магнитное поле в вакууме 19.11
- •Лекция 20 Сила Ампера. Работа поля В при перемещении контура
- •Магнитное поле в вакууме 20.2
- •Магнитное поле в вакууме 20.3
- •Магнитное поле в вакууме 20.4
- •Магнитное поле в вакууме 20.5
- •Магнитное поле в вакууме 20.6
- •Магнитное поле в вакууме 20.7
- •Магнитное поле в вакууме 20.8
- •Магнитное поле в вакууме 20.9
- •Магнитное поле в вакууме 20.10
- •Магнитное поле в вакууме 20.11
- •Магнитное поле в вакууме 20.12
- •Лекция 21
- •Диэлектрики 21.2
- •Диэлектрики 21.3
- •Диэлектрики 21.4
- •Диэлектрики 21.5
- •Диэлектрики 21.6
- •Диэлектрики 21.7
- •Диэлектрики 21.8
- •Диэлектрики 21.9
- •Диэлектрики 21.10
- •Лекция 22
- •Магнетики 22.2
- •Магнетики 22.3
- •Магнетики 22.4
- •Магнетики 22.5
- •Магнетики 22.6
- •Магнетики 22.7
- •Магнетики 22.8
- •Магнетики 22.9
- •Магнетики 22.10
- •Магнетики 22.11
- •Лекция 23 Законы геометрической оптики. Принцип Ферма. Явление
- •Геометрическая оптика 23.2
- •Геометрическая оптика 23.3
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.4
- •Геометрическая оптика 23.5
- •Геометрическая оптика 23.6
- •Геометрическая оптика 23.7
- •Геометрическая оптика 23.8
- •Геометрическая оптика 23.9
- •Геометрическая оптика 23.10
- •Лекция 24 Оптическая система. Кардинальные плоскости.
- •Оптическая система. 24.2
- •Оптическая система. 24.3
- •Оптическая система. 24.4
- •Оптическая система. 24.5
- •Оптическая система. 24.6
- •Оптическая система. 24.7
- •Оптическая система. 24.8
- •Оптическая система. 24.9
- •Оптическая система. 24.10
- •Лекция 25
- •Тонкие линзы. 25.2
- •Тонкие линзы. 25.3
- •Тонкие линзы. 25.4
- •Тонкие линзы. 25.5
- •Тонкие линзы. 25.6
- •Тонкие линзы. 25.7
- •Тонкие линзы. 25.8
- •Тонкие линзы. 25.9
- •Тонкие линзы. 25.10
- •Интерференция света. Когерентные источники. Интерференция от двух когерентных источников. Бипризма Френеля. Интерференция при
- •Интерференция. 26.2
- •Интерференция. 26.3
- •Интерференция. 26.4
- •Интерференция. 26.5
- •Интерференция. 26.6
- •Интерференция. 26.7
- •Интерференция. 26.8
- •Интерференция. 26.9
- •Интерференция. 26.10
- •Интерференция. 26.11
- •Интерференция. 26.12
- •Лекция 27 Дифракция света. Принцип Гюйгенса-Френеля. Зоны
- •Дифракция. 27.2
- •Дифракция. 27.3
- •Колебания приходящие в точку Р от аналогичных точек двух соседних зон, находятся в
- •Дифракция. 27.5
- •Дифракция. 27.6
- •Дифракция. 27.7
- •Дифракция. 27.8
- •Дифракция. 27.9
- •Дифракция. 27.10
- •Дифракция Френеля от простейших преград. Дифракция от
- •Дифракция. 28.2
- •Дифракция. 28.3
- •Дифракция. 28.4
- •Дифракция. 28.5
- •Дифракция. 28.6
- •Дифракция. 28.7
- •Дифракция. 28.8
- •Дифракция. 28.9
- •Дифракция. 28.10
- •Закономерности в атомных спектрах. Опыт по рассеянию альфа частиц.
- •Атомная физика. 29.2
- •Атомная физика. 29.3
- •Атомная физика. 29.4
- •Атомная физика. 29.5
- •Атомная физика. 29.6
- •Атомная физика. 29.7
- •Атомная физика. 29.8
- •Атомная физика. 29.9
- •Атомная физика. 29.10
- •Лекция 30 Гипотеза де Бройля. Принцип неопределенности.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Элементы квантовой механики.
- •Лекция 31 Таблица Менделеева. Состав и характеристики атомного
- •Элементы атомной физики. 31.2
- •Элементы атомной физики. 31.3
- •Элементы атомной физики. 31.4
- •Элементы атомной физики. 31.5
- •Элементы атомной физики. 31.6
- •Элементы атомной физики. 31.7
- •Элементы атомной физики. 31.8
- •Элементы атомной физики. 31.9
- •Элементы атомной физики. 31.10
- •Элементы атомной физики. 31.11
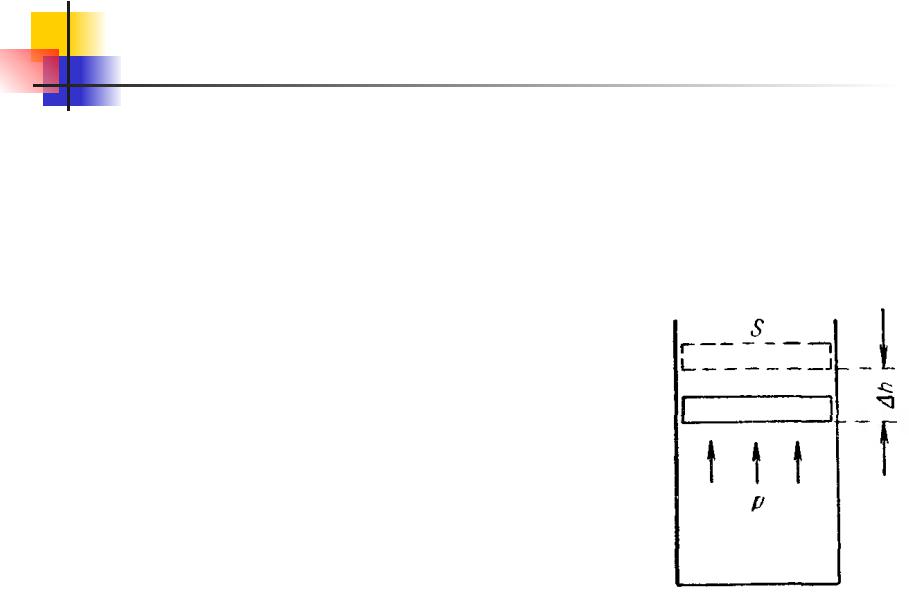
Термодинамика. 11.9
Пусть газ заключен в цилиндрический сосуд, закрытый плотно пригнанным легко скользящим поршнем. Если вследствие каких- либо причин газ станет расширяться, он будет перемещать поршень и совершать над ним работу. Элементарная работа, совершаемая газом при перемещении поршня на отрезок dh,
равна |
dA=fdh, |
|
где f – сила, с которой газ действует на поршень. Заменяя эту силу произведением давления газа P на площадь поршня S, получаем: dA=PSdh
Но Sdh представляет собой приращение объема газа dV. Поэтому выражение для элементарной работы можно записать
следующим образом: |
dA=PdV |
|
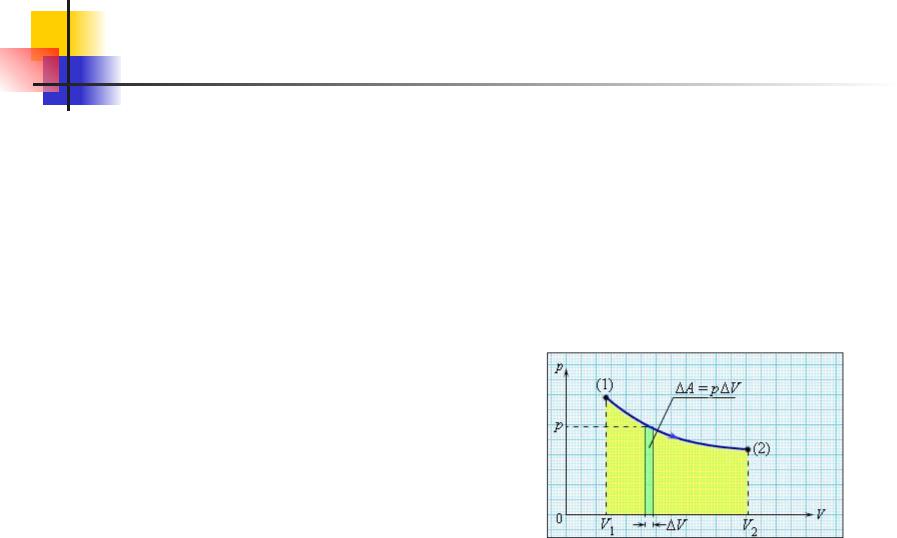
Термодинамика. 11.10
При сжатии газа направления перемещения dh и силы f, с которой газ действует на поршень, противоположны, вследствие чего элементарная работа dA будет отрицательна. Приращение объема dV в этом случае также будет отрицательным. Если при изменении объема давление не остается постоянным, работа должна вычисляться путем интегрирования:
V2
A12 PdV
V1
Если давление газа остается постоянным, работа, совершаемая при изменении объема от значения
V1 до значения V2, будет равна
A12 =P(V2 -V1 )
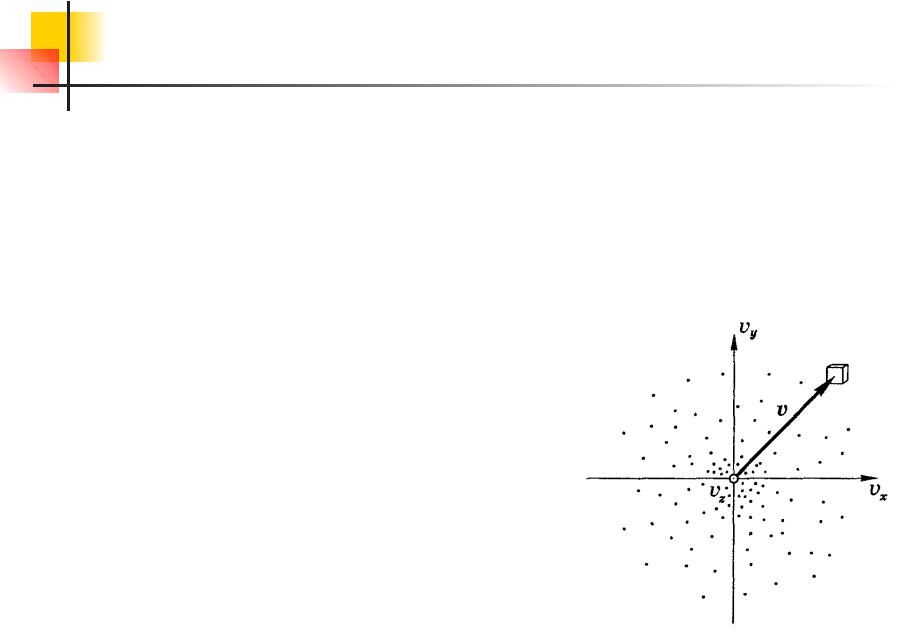
Лекция 12 Распределение молекул газа по скоростям. Функция
распределения Максвелла. Наиболее вероятная, средняя и  средне квадратичные скорости молекул.
средне квадратичные скорости молекул.
В сосуде, содержащем большое число молекул,
устанавливается некоторое статистическое распределение
молекул по скоростям, зависящее от абсолютной
температуры T. При этом все направления векторов
скоростей молекул оказываются равноправными
(равновероятными), а величины скоростей подчиняются
определенной закономерности. Распределение молекул газа по величине скоростей называется ПредставимМак велла. себе пространство
скоростей с прямоугольными координатными осями, по которой будем откладывать значения проекций vx, vy, vz отдельных
молекул. Тогда скорости каждой молекулы будет соответствовать точка в этом пространстве – конец
вектора v.

Распределение Максвелла. 12.2
Плотность точек может зависеть только от модуля скорости v. Предположим, что в газе содержится N молекул. Выделим в окрестности некоторой точки малый объем – dvxdvydvz.
Относительное число точек (молекул) в этом объеме, или другими словами, вероятность dP того, что скорость молекулы, т.е. конец вектора v, попадает в этот объем, можно записать так:
dP(vx ,vy ,vz ) dN(vx ,vy ,vz ) f(v)dvxdvydvz N
где f(v) – имеет смысл объемной плотности вероятности. Вероятности того, что молекула имеет проекции скорости в интервалах (vx,vx+dvx), (vy,vy+dvy) и (vz,vz+dvz) являются статистически
независимыми, поэтому в соответствии с теоремой об умножении вероятностей независимых событий можно записать:
dP(vx ,vy ,vz )=dP(vx )dP(vy )dP(vz )

Распределение Максвелла. 12.3
где dРх – вероятность того, что молекула будет иметь проекции
скорости в интервале (vx,vx+dvx), есть
dP(vx )= dN(vx ) (vx )dvx N
где φ(vx) – функция распределения по vx. С учетом,
полученного соотношения, вероятности того, что молекула
имеет проекции скорости в интервалах (vx,vx+dvx), (vy,vy+dvy) и
(v ,v +dv ) будет иметь вид:
z z dP(vz x ,vy ,vz )=dP(vx )dP(vy )dP(vz )= (vx ) (vy ) (vz )dvxdvydvz
Из соображений равноправия осей vx, vy и vz ясно, что функции φ
должны одинаковым образом зависеть от соответствующих проекций скоростей. Таким образом, функция объемной плотности вероятности может быть представлена следующим
образом: |
f(v) (vx ) (vy ) (vz ) |
|

Распределение Максвелла. 12.4
В результате теоретических расчетов был получен аналитический вид функции распределения молекул газа по проекции скорости:
|
m |
1 2 |
|
mv2 |
|
|
|
||||||
(vx ) |
|
|
|
exp |
x |
|
|
|
|||||
2 kT |
|
2kT |
|
|||
ункция φ(vх) нормирована на единицу, т.е. площадь по кривой
(vх)
(vх ) dvx 1
Распределение Максвелла. 12.5
Интегрирование в пределах от до не означает, что в газе есть молекулы с такими большими скоростями. Молекул с весьма большими скоростями очень мало, и они практически не вносят никакого вклада в нормировочный интеграл. Это и позволяет записывать такие пределы. Аналогичный вид имеют функции φ(vy) и φ(vz). Тогда f(v) будет иметь вид:
|
m |
3 2 |
|
2 |
2 |
2 |
|
f (v) |
|
exp |
|
m(vx vy |
vz ) |
||
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
2kT |
|
|||
2 kT |
|
|
|
|
|||
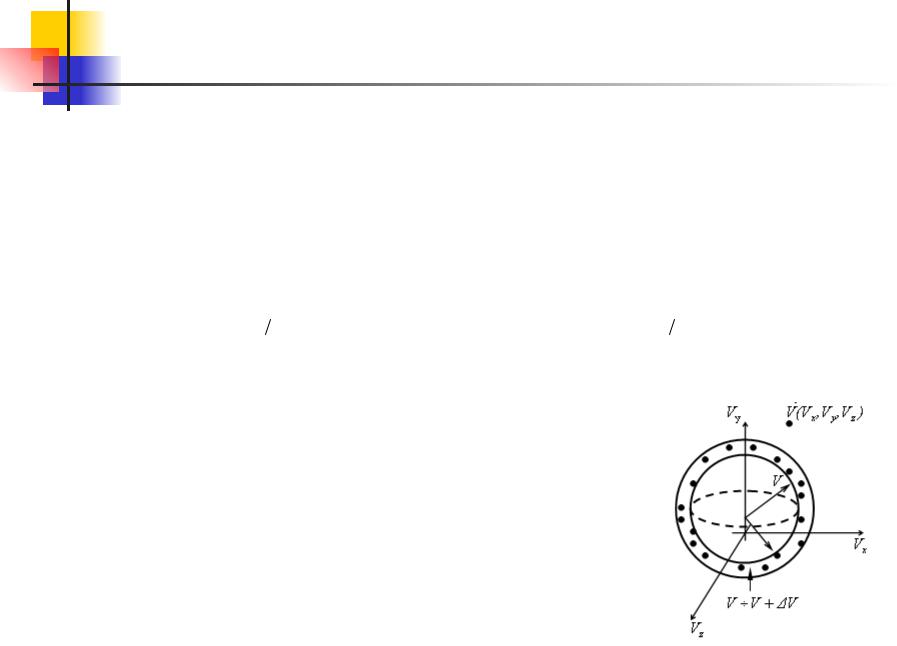
Довольно часто возникает вопрос сколько (какая относительная часть) молекул газа имеют скорость модуль в пределах от (v, v+dv). Таким молекулам соответствуют все точки,
попадающие в шаровой слой с
радиусами v и v+dv .
|
|
m |
3 2 |
|
|
2 |
|
|
|
|
|||||
|
|
exp |
mv |
|
|
||
|
|
||||||
|
|
|
2kT |
||||
|
|
2 kT |
|
|
|
||
|
|
|
|
||||

Распределение Максвелла. 12.6
Объем этого слоя равен произведению этого слоя на его толщину, т.е. 4πv2dv, объемная плотность вероятности f(v) во всех точках слоя одинакова. Следовательно, согласно
теореме сложения вероятностей, попадания в этот слой:
dP=f(v) 4 v2dv
Величина dP/dv – характеризует вероятность молекуле иметь
скорость в пределах от (v, v+dv): |
3 2 |
|
|
2 |
|
||
F(v) 4 |
|
m |
|
v2 exp |
mv |
|
|
|
|
|
|
||||
|
|
2kT |
|||||
|
2 kT |
|
|
||||
Данное соотношение представляет собой закон распределения Максвелла по модулю скорости. Эта функция тоже нормирована
на единицу |
|
|
F(v) dv 1 |
|
0 |
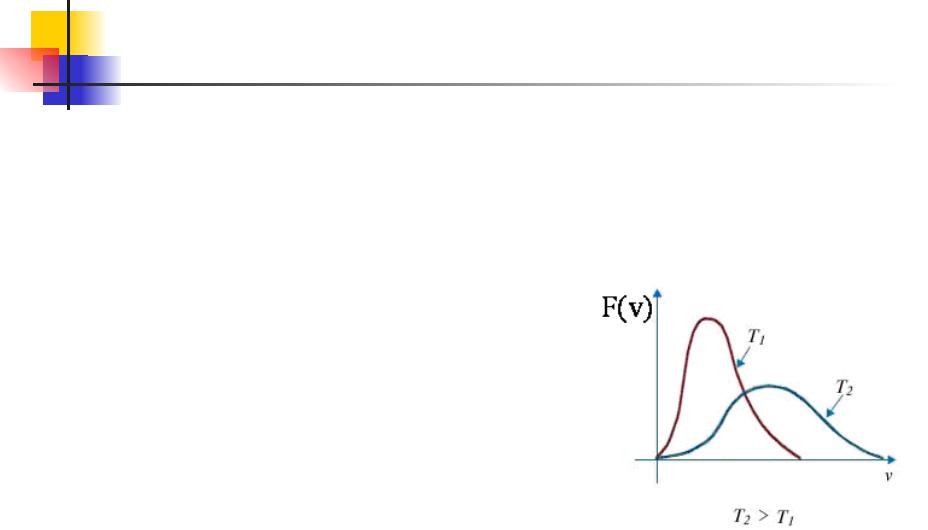
Распределение Максвелла. 12.7
Как и можно было ожидать, конкретный вид функции зависит от рода газа ( от массы молекул) и от параметра состояния (от температуры Т). Необходим отметить, что давление и объем газа на распределение молекул по скоростям не влияют.
Скорость, отвечающая максимальному значению функции распределения, будет, очевидно, наиболее вероятной.
Действительно, если сравнить числа
молекул ΔNv, скорости которых лежат в
пределах различным образом выбранных, но равных по величине
интервалов Δv, то наибольшим будет
ΔNv, соответствующее интервалу,
расположенному в окрестности максимума. Таким образом, найдя
максимум функции распределения F(v),
Распределение Максвелла. 12.8
Продифференцировав F(v) по v и приравняв полученное |
||||||
выражение нулю, будем иметь: |
|
|
2 |
|
||
dF(v) |
- |
mv2 |
|
mv |
|
|
Ae |
2kT v |
2- |
|
0 |
||
|
|
|
||||
dv |
|
|
|
kT |
|
|
|
|
|
|
|||
Удовлетворяющие этому уравнению значения v=0 и v= соответствуют минимуму F(v). Значение v, обращающее в нуль
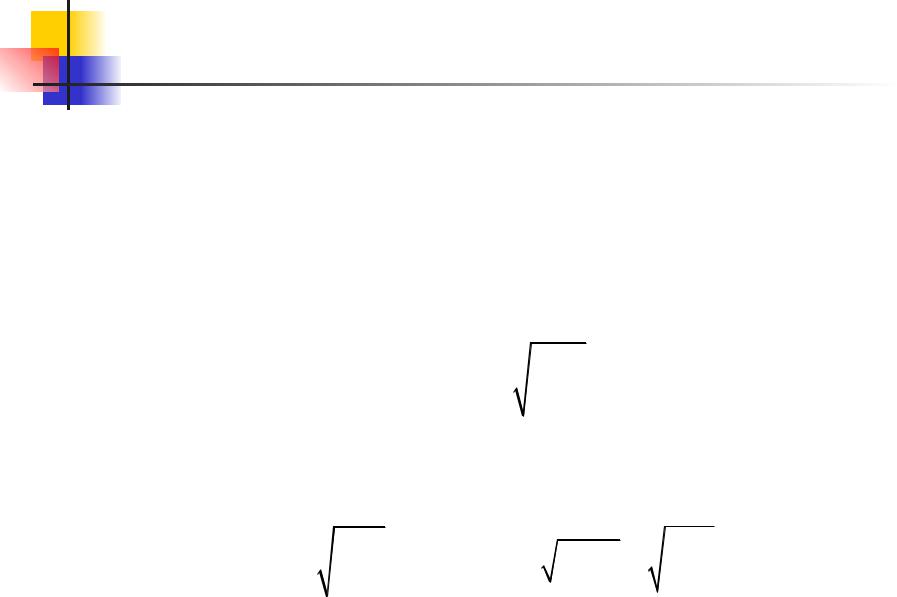
выражение, стоящее в скобках, представляет собой vвер:
vвер 2kT
m
Также можно найти, зная распределение молекул по
скоростям, среднее значение скорости, и v2.
|
8kT |
|
|
3kT |
vср vF(v)dv |
vср.кв |
(v2 )ср |
||
0 |
m |
|
|
m |
