- •Механика. Механическое движение. Скорость, ускорение материальной точки.
- •Прямолинейное движение и движение по окружности материальной точки
- •Законы Ньютона.
- •Силы в механике.
- •Закон сохранения импульса.
- •Основной закон динамики вращательного движения твердого тела.
- •Работа. Энергия. Мощность.
- •Колебания.
- •Волны. Звук.
- •Закон Паскаля. Сила Архимеда. Уравнение Бернулли, следствия из него.
- •Температура. Температурные шкалы: шкала Цельсия, идеальная газовая и абсолютная термодинамическая шкала температур.
- •Уравнение состояния идеального газа. Закон Дальтона. Изопроцессы и их уравнения.
- •Взаимосвязь теплоты и работы. Первое начало термодинамики. Работа, совершаемая телом при изменении объема. Работа газа в различных изопроцессах.
- •Теплоемкость тела, удельная, молярная, теплоемкости Cp и Cv. Второе начало термодинамики.
- •Основные положения мкт. Масса и размеры молекул. Основное уравнение мкт. Кинетическая энергия молекулы. Средняя квадратичная скорость молекул. Длина свободного пробега.
- •Барометрическая формула.
- •Явления переноса.
- •Электроемкость. Конденсатор. Емкость плоского конденсатора. Емкость батареи конденсаторов. Энергия конденсатора.
- •Электрический ток. Условия существования электрического тока. Сила тока. Плотность тока. Электродвижущая сила. Напряжение.
- •Закон Ома для однородного, неоднородного участка цепи и замкнутой (полной) цепи. Сопротивление проводников. Дифференциальная форма закона Ома.
- •Работа и мощность электрического тока. Закон Джоуля – Ленца.
- •Разветвленные цепи. Правила Кирхгофа. Последовательное и параллельное соединение проводников.
- •Действие электрического тока на тело человека. Риск поражения электрическим током в быту.
- •Электролиты. Законы Фарадея для электролиза.
- •Электропроводность газов. Несамостоятельный и самостоятельный разряд Виды самостоятельного разряда.
- •Магнитное взаимодействие. Опыт Эрстеда. Магнитное поле. Изображение магнитных полей. Принцип суперпозиции. Сила Ампера.
- •Сила Лоренца. Полярные сияния.
- •Контур с током в магнитное поле. Индукция магнитного поля. Работа по перемещению проводника с током в магнитном поле. Закон Био - Савара - Лапласа.
- •Электромагнитное поле. Явление электромагнитной индукции. Закон Фарадея для электромагнитной индукции. Правило Ленца.
- •Электромагнитная теория света. Интерференция света.
- •Явление дифракции. Дифракционная решетка. Разрешающая способность оптических приборов.
- •Зеркала. Тонкие линзы. Формула линзы. Оптическая сила линзы.
- •Глаз как оптическая система. Лупа, микроскоп, телескоп.
- •Понятие о нелинейной оптике. Прохождение света через оптически неоднородную среду. Закон Рэлея. Цвет неба и зорь. Радуга. Миражи. Гало.
- •Тепловое излучение. Количественные характеристики излучения. Законы Стефана-Больцмана и Вина. Законы Кирхгофа для излучения. Формулы Вина.
- •Фотоэффект Закономерности Столетова. Уравнение Эйнштейна.
- •Опыты Резерфорда по рассеянию альфа-частиц. Атом Резерфорда.
- •Постулаты Бора. Правила отбора. Элементарная теория атома водорода.
- •Квантово-механическая теория атома водорода. Электронные оболочки атомов. Периодическая система элементов Менделеева.
- •Состав ядра. Ядерные силы. Энергия связи ядра.
- •Реакции синтеза. Условия их осуществления Управляемый термоядерный синтез.
- •Радиоактивность. Закон радиоактивного распада.
-
Уравнение состояния идеального газа. Закон Дальтона. Изопроцессы и их уравнения.
В молекулярно-кинетической теории пользуются моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным, а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
Хаотическое движение молекул связано с тепловым состоянием тела. В процессе движения молекулы газа ударяются о стенки сосуда. Из-за множества молекул ограждающие газ поверхности воспринимают их удары как действие непрерывной, постоянной и нормально направленной силы. Отнесенная к единице площади сила представляет собой давление газа. На величину давления не влияет ориентация поверхности, на которую давит газ. Обусловлено это беспорядочностью теплового движения молекул, при котором ни одно из направлений не имеет преимущества. Таким образом, давление есть результат силового действия молекул на стенки сосуда. Следует ожидать, что сила удара, а значит, и давление зависят от скорости или кинетической энергии поступательного движения молекул.
Основное уравнение кинетической теории выражает зависимость давления от концентрации молекул идеального газа, от среднего значения кинетической энергии теплового движения молекул.
![]()
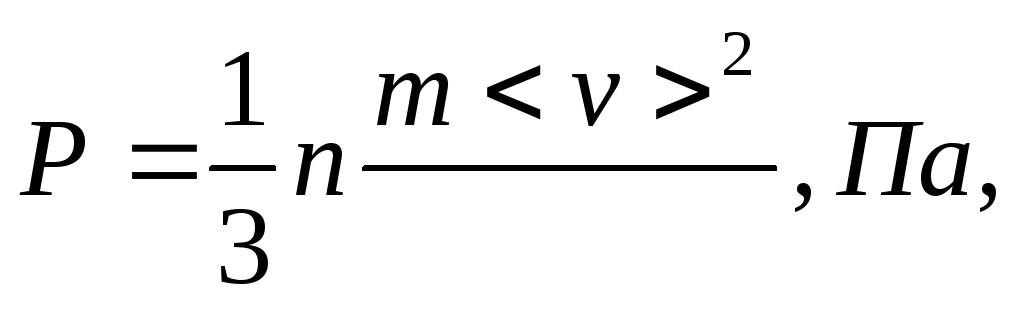
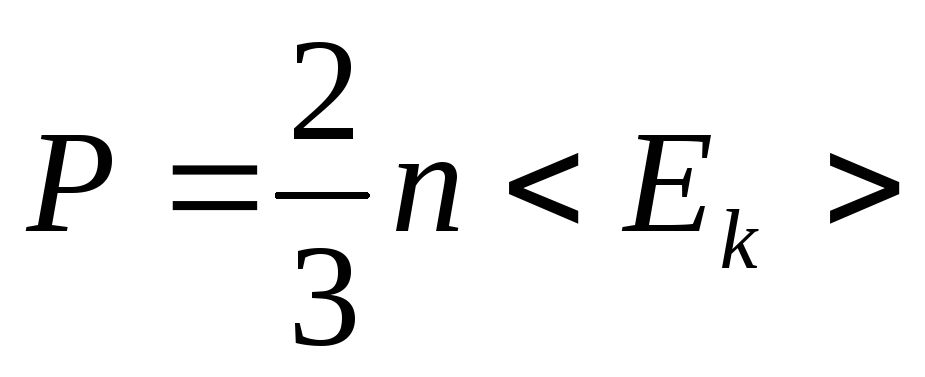 ,Па
,Па
где <Ек> — средняя кинетическая энергия поступательного движения молекул газа, Дж; n – концентрация молекул; k – постоянная Больцмана; T – абсолютная температура; <v> - средняя квадратичная скорость теплового движения молекул.
В молекулярно-кинетической теории пользуются моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным, а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
Принимая во внимание, что n=N/V, м -3, R=Nаk, для 1 моля идеального газа:
![]()
![]()
Уравнению рV =RT (1.10) удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клайперона - Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (1.10), полагая, что моль газа находится при нормальных условиях(р0 = 1,013·105 Па, T0= 273,15 К, Vm = 22,41·10-3 м3/моль): R = 8,31 Дж/(мольК).
От уравнения (1.10) для моля газа можно перейти к уравнению Клапейрона - Менделеева для произвольной массы газа. Если при некоторых заданных давлении и температуре один моль газа занимает молярный объем Vm, то при тех же условиях масса m газа займет объем V = (m/М)Vm, где М - молярная масса (масса одного моля вещества). Единица молярной массы - килограмм на моль (кг/моль). Уравнение Клайперона - Менделеева для массы m газа
pV=m/M RT = vRT (1.11)
где v = m/М - количество вещества;
p, V, Т- термодинамические параметры данного состояния;
R - универсальная газовая постоянная;
М - молярная масса газа.
Уравнению рV =RT (1.10) удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клайперона - Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (1.10), полагая, что моль газа находится при нормальных условиях(р0 = 1,013·105 Па, T0= 273,15 К, Vm = 22,41·10-3 м3/моль): R = 8,31 Дж/(мольК).
Рассмотрим законы, описывающие поведение идеальных газов.
Закон Бойля - Мариотта [Р. Бойль (1627-1691) – английский ученый; Э.Мариотт (1620-1684) - французский физик]: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
рV = соnst при T = соnst:, m = const. (1.2)
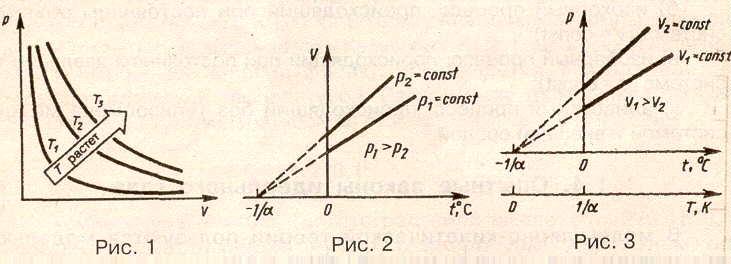
Кривая, изображающая зависимость между величинами р и V, характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (рис. 1).
|
|
Закон Шарля [(Ж. Шарль (1746-1823) - французский ученый]: давление данной массы газа при постоянном объеме изменяется линейно с температурой:
р = р0 (1 + αt) при V = const, m = соnst. (1.3)
Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах V, t (рис. 2) этот процесс изображается прямой, называемой изобарой.
Закон Гей-Люссака [Ж. Гей-Люссак (1778-1850.) - французский ученый]: объем данной массы газа при постоянном давлении изменяется линейно с температурой:
V = V0 (1 + αt) при V = const, m = соnst. (1.4)
Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме в координатах p, t (рис. 3) он изображается прямой, называемой изохорой.
В уравнениях (1.3) и (1.4) t - температура по шкале Цельсия, р0 и V0 - давление и объем при 0°С, коэффициент α = 1/273,15 К-1.
Если в формулы (1.3) и (1.4) подставить данный коэффициент, то они соответственно примут вид
р = р0( 1 + t/273, 1 5) = p0 [(273, 1 5 +t)/0/273, 15];
V = V0 (1 + t/273,15) = V0[(273,15 + t)/273,15].
Учитывая формулу (1.1), можно перейти к термодинамической температуре
P=TP0/273,15= α p0T; V=TV0/273,15= α V0T
или
V/Т = соnst при р - const, m = сonst; (1.5)
р/Т= соnst при V= соnst, m = сonst ( 1.6)
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,41 • 10-3 м3/моль.
Закон Дальтона [Дж. Дальтон (1766 - 1844) - английский химик и физик]: давление смеси идеальных газов равно сумме парциальных давлений р., ря р2,..., рn входящих в нее газов:
p=р1+р2+…+pn
Парциальное давление - давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.