- •Механика. Механическое движение. Скорость, ускорение материальной точки.
- •Прямолинейное движение и движение по окружности материальной точки
- •Законы Ньютона.
- •Силы в механике.
- •Закон сохранения импульса.
- •Основной закон динамики вращательного движения твердого тела.
- •Работа. Энергия. Мощность.
- •Колебания.
- •Волны. Звук.
- •Закон Паскаля. Сила Архимеда. Уравнение Бернулли, следствия из него.
- •Температура. Температурные шкалы: шкала Цельсия, идеальная газовая и абсолютная термодинамическая шкала температур.
- •Уравнение состояния идеального газа. Закон Дальтона. Изопроцессы и их уравнения.
- •Взаимосвязь теплоты и работы. Первое начало термодинамики. Работа, совершаемая телом при изменении объема. Работа газа в различных изопроцессах.
- •Теплоемкость тела, удельная, молярная, теплоемкости Cp и Cv. Второе начало термодинамики.
- •Основные положения мкт. Масса и размеры молекул. Основное уравнение мкт. Кинетическая энергия молекулы. Средняя квадратичная скорость молекул. Длина свободного пробега.
- •Барометрическая формула.
- •Явления переноса.
- •Электроемкость. Конденсатор. Емкость плоского конденсатора. Емкость батареи конденсаторов. Энергия конденсатора.
- •Электрический ток. Условия существования электрического тока. Сила тока. Плотность тока. Электродвижущая сила. Напряжение.
- •Закон Ома для однородного, неоднородного участка цепи и замкнутой (полной) цепи. Сопротивление проводников. Дифференциальная форма закона Ома.
- •Работа и мощность электрического тока. Закон Джоуля – Ленца.
- •Разветвленные цепи. Правила Кирхгофа. Последовательное и параллельное соединение проводников.
- •Действие электрического тока на тело человека. Риск поражения электрическим током в быту.
- •Электролиты. Законы Фарадея для электролиза.
- •Электропроводность газов. Несамостоятельный и самостоятельный разряд Виды самостоятельного разряда.
- •Магнитное взаимодействие. Опыт Эрстеда. Магнитное поле. Изображение магнитных полей. Принцип суперпозиции. Сила Ампера.
- •Сила Лоренца. Полярные сияния.
- •Контур с током в магнитное поле. Индукция магнитного поля. Работа по перемещению проводника с током в магнитном поле. Закон Био - Савара - Лапласа.
- •Электромагнитное поле. Явление электромагнитной индукции. Закон Фарадея для электромагнитной индукции. Правило Ленца.
- •Электромагнитная теория света. Интерференция света.
- •Явление дифракции. Дифракционная решетка. Разрешающая способность оптических приборов.
- •Зеркала. Тонкие линзы. Формула линзы. Оптическая сила линзы.
- •Глаз как оптическая система. Лупа, микроскоп, телескоп.
- •Понятие о нелинейной оптике. Прохождение света через оптически неоднородную среду. Закон Рэлея. Цвет неба и зорь. Радуга. Миражи. Гало.
- •Тепловое излучение. Количественные характеристики излучения. Законы Стефана-Больцмана и Вина. Законы Кирхгофа для излучения. Формулы Вина.
- •Фотоэффект Закономерности Столетова. Уравнение Эйнштейна.
- •Опыты Резерфорда по рассеянию альфа-частиц. Атом Резерфорда.
- •Постулаты Бора. Правила отбора. Элементарная теория атома водорода.
- •Квантово-механическая теория атома водорода. Электронные оболочки атомов. Периодическая система элементов Менделеева.
- •Состав ядра. Ядерные силы. Энергия связи ядра.
- •Реакции синтеза. Условия их осуществления Управляемый термоядерный синтез.
- •Радиоактивность. Закон радиоактивного распада.
-
Взаимосвязь теплоты и работы. Первое начало термодинамики. Работа, совершаемая телом при изменении объема. Работа газа в различных изопроцессах.
Термодинамика — это наука о закономерностях превращения одних видов энергии в другие. Значение термодинамики состоит в том, что она устанавливает принципы наиболее эффективного и оптимального преобразования энергии. Этим термодинамика дает ответ на вопрос, как нужно организовать рабочий процесс в тепловом двигателе, чтобы КПД его был максимальным.
Термодинамической системой называют совокупность макроскопических тел, находящихся в энергетическом (механическом и тепловом) взаимодействии друг с другом и другими телами, окружающими их, а также обменивающихся друг с другом веществом.
В термодинамике производится сопоставление рассматриваемой системы с окружающей средой, изучаются взаимодействия как внутри системы, так и между системой и окружающей средой. Если между системой и окружающей средой возможны все три типа взаимодействия, система называется открытой. В закрытой системе обмен веществом с другими системами отсутствует. Адиабатной называют систему, в которой отсутствует теплообмен с другими системами. Адиабатными могут быть как открытая, так и закрытая системы. Система, не взаимодействующая с окружающей средой или другими системами ни энергетически, ни веществом, называется изолированной.
Различают термодинамические системы: однородные (однофазные), или гомогенные, и неоднородные (многофазные), или гетерогенные. Гомогенные системы имеют одинаковые или непрерывно и равномерно изменяющиеся химический состав и физические свойства. Например, газ, находящийся в баллоне; атмосферный воздух, давление которого изменяется непрерывно jio высоте; чистые, без сажи, продукты сгорания.
Гетерогенная система состоит из двух или более гомогенных областей, называемых фазами. На границах фаз скачкообразно изменяются химический состав или физические свойства вещества. Например, гетерогенная система из воды и льда имеет одинаковый химический состав, но разные физические свойства, а гетерогенная система из воды и куска сливочного масла — и разный состав, и разные свойства.
Совокупность физических свойств термодинамической системы в рассматриваемых условиях называют состоянием системы. Величины, характеризующие состояние термодинамической системы, называют термодинамическими параметрами: давление — Р, удельный объем — V, температура— Т, внутренняя энергия — U, энтальпия — h, энтропия — s и др. Параметры, не зависящие от размеров системы (ее протяженности, массы), например температуру, давление, называют интенсивными, зависящие же, например объем, энтальпию, энтропию, — экстенсивными или аддитивными.
Если параметры с течением времени не изменяются, то состояние системы называется стационарным.
Состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты, называют равновесным.
Процесс передачи энергии направленного движения микрочастиц от рассматриваемого тела к другим телам и наоборот представляет собой работу А, Дж. Процесс отдачи или восприятия энергии хаотического молекулярного и внутримолекулярного движения называется теплотой, а количество переданной энергии — количеством теплоты Q, Дж. Другие формы передачи энергии неизвестны. Таким образом, принимается, что теплота и работа являются двумя единственно возможными формами передачи энергии.
Для конечного состояния изменения системы первое начало термодинамики: Q=∆U+А,
где: Q - количество теплоты, подводимое к системе; ∆U – изменение внутренней энергии газа; А – работа, совершаемая газом против внешних сил в изопроцессах.
Следует напомнить еще одну из формулировок первого закона — вечный двигатель первого рода невозможен. Вечный двигатель первого рода — это такой воображаемый механизм, который при наличии первоначального энергетического импульса способен безостановочно двигать сам себя и, кроме того, производить полезную работу.
Работа, совершаемая газом против внешних сил в изопроцессах:
а) изохорном (V=const), А=0;
б) изобарном (р=const)
A =pV= mR(T2-T1)/M
в) изотермическом (Т==const)
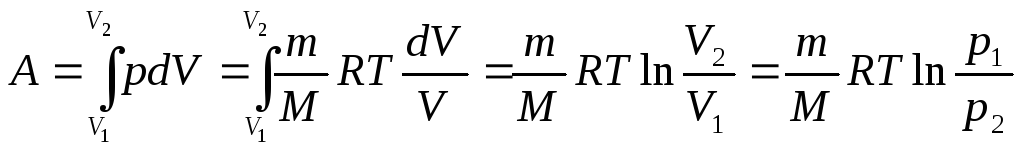
г) адиабатическом (Q=0)