
- •Механика. Механическое движение. Скорость, ускорение материальной точки.
- •Прямолинейное движение и движение по окружности материальной точки
- •Законы Ньютона.
- •Силы в механике.
- •Закон сохранения импульса.
- •Основной закон динамики вращательного движения твердого тела.
- •Работа. Энергия. Мощность.
- •Колебания.
- •Волны. Звук.
- •Закон Паскаля. Сила Архимеда. Уравнение Бернулли, следствия из него.
- •Температура. Температурные шкалы: шкала Цельсия, идеальная газовая и абсолютная термодинамическая шкала температур.
- •Уравнение состояния идеального газа. Закон Дальтона. Изопроцессы и их уравнения.
- •Взаимосвязь теплоты и работы. Первое начало термодинамики. Работа, совершаемая телом при изменении объема. Работа газа в различных изопроцессах.
- •Теплоемкость тела, удельная, молярная, теплоемкости Cp и Cv. Второе начало термодинамики.
- •Основные положения мкт. Масса и размеры молекул. Основное уравнение мкт. Кинетическая энергия молекулы. Средняя квадратичная скорость молекул. Длина свободного пробега.
- •Барометрическая формула.
- •Явления переноса.
- •Электроемкость. Конденсатор. Емкость плоского конденсатора. Емкость батареи конденсаторов. Энергия конденсатора.
- •Электрический ток. Условия существования электрического тока. Сила тока. Плотность тока. Электродвижущая сила. Напряжение.
- •Закон Ома для однородного, неоднородного участка цепи и замкнутой (полной) цепи. Сопротивление проводников. Дифференциальная форма закона Ома.
- •Работа и мощность электрического тока. Закон Джоуля – Ленца.
- •Разветвленные цепи. Правила Кирхгофа. Последовательное и параллельное соединение проводников.
- •Действие электрического тока на тело человека. Риск поражения электрическим током в быту.
- •Электролиты. Законы Фарадея для электролиза.
- •Электропроводность газов. Несамостоятельный и самостоятельный разряд Виды самостоятельного разряда.
- •Магнитное взаимодействие. Опыт Эрстеда. Магнитное поле. Изображение магнитных полей. Принцип суперпозиции. Сила Ампера.
- •Сила Лоренца. Полярные сияния.
- •Контур с током в магнитное поле. Индукция магнитного поля. Работа по перемещению проводника с током в магнитном поле. Закон Био - Савара - Лапласа.
- •Электромагнитное поле. Явление электромагнитной индукции. Закон Фарадея для электромагнитной индукции. Правило Ленца.
- •Электромагнитная теория света. Интерференция света.
- •Явление дифракции. Дифракционная решетка. Разрешающая способность оптических приборов.
- •Зеркала. Тонкие линзы. Формула линзы. Оптическая сила линзы.
- •Глаз как оптическая система. Лупа, микроскоп, телескоп.
- •Понятие о нелинейной оптике. Прохождение света через оптически неоднородную среду. Закон Рэлея. Цвет неба и зорь. Радуга. Миражи. Гало.
- •Тепловое излучение. Количественные характеристики излучения. Законы Стефана-Больцмана и Вина. Законы Кирхгофа для излучения. Формулы Вина.
- •Фотоэффект Закономерности Столетова. Уравнение Эйнштейна.
- •Опыты Резерфорда по рассеянию альфа-частиц. Атом Резерфорда.
- •Постулаты Бора. Правила отбора. Элементарная теория атома водорода.
- •Квантово-механическая теория атома водорода. Электронные оболочки атомов. Периодическая система элементов Менделеева.
- •Состав ядра. Ядерные силы. Энергия связи ядра.
- •Реакции синтеза. Условия их осуществления Управляемый термоядерный синтез.
- •Радиоактивность. Закон радиоактивного распада.
-
Постулаты Бора. Правила отбора. Элементарная теория атома водорода.
Н. Бор пришел к убеждению в том, что планетарная модель атома Э. Резерфорда в основном верна и что законы классической физики неприменимы к внутриатомным процессам. Усовершенствовав модель Э. Резерфорда, Н. Бор создал квантовую теорию строения атома, в основу которой положены три постулата, названные постулатами Бора.
1-й постулат Бора: электроны в атоме могут вращаться вокруг ядра не по любым, а только по разрешенным орбитам, вполне определенного радиуса, определяемого для атома водорода по формуле

где n — целое положительное число, называемое главным квантовым и обозначающее номер электронной оболочки, n = 1, 2, 3,...; h — постоянная Планка, Дж·с;
2-й постулат Бора: электрон на каждой орбите обладает определенной энергией. Такие орбиты называются стационарными. Движение электронов по стационарным орбитам не сопровождается излучением или поглощением энергии атомом;
![]()
 щением
атомом кванта энергии.
щением
атомом кванта энергии.
где Ев и Ен — энергия электрона соответственно на верхней и нижней стационарных орбитах, Дж. Очевидно, что частота излучаемых или поглощаемых атомом электромагнитных волн зависит не от частоты вращения электрона в атоме, а от разности энергий разрешенных состояний атома
![]()
Постулаты Н. Бора излагаются также общей формулировкой: атом устойчив только в стационарных состояниях, соответствующих дискретным разрешенным значениям энергии E1, Е2, Е3, ... Переход атома из одного устойчивого энергетического состояния в другое сопровождается излучением или поглощением кванта энергии, определяемого условием частот.
-
Квантово-механическая теория атома водорода. Электронные оболочки атомов. Периодическая система элементов Менделеева.
В обычном, нормальном — стационарном энергетическом состоянии электрон в атоме водорода находится на первой, ближайшей к ядру, оболочке. Энергия электрона в данном состоянии — Ег Низший энергетический уровень Е1 соответствует основному состоянию атома водорода. Для перевода электрона на L-оболочку ему необходимо сообщить квант энергии. На второй оболочке электрон будет иметь энергию Е2= El + hv, Дж. Все состояния атома водорода, в которых электрон находится не на ближайшей к ядру орбите, называют возбужденными состояниями. Если связать это понятие с главными квантовыми числами орбит, то возбужденными называют состояния водорода с главным квантовым числом, превышающим единицу.
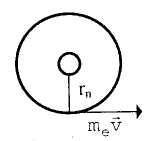
![]()
здесь r п —радиус n-й разрешенной орбиты, м.
На электрон действует сила притяжения со стороны положительно заряженного ядра, равная с позиций закона Кулона
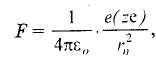
Для
атома водорода
![]()
Кулоновская сила F, действующая на электрон, сообщает ему центростремительное ускорение
а = v2/rn. He вызывает сомнения, что рассматриваемая сила может быть представлена и через второй закон И. Ньютона:
![]()



 Из
изложенного вытекает равенство
Из
изложенного вытекает равенство
![]()
Подставив в него значение скорости электрона на n-й орбите из формулы (23.2) , получим

Это соотношение позволяет рассчитать любой из радиусов разрешенных орбит в боровской модели атома водорода.
Рассмотрим теперь расчет энергии Е электрона на любой из разрешенных орбит. Полная энергия электрона равна сумме кинетической и потенциальной составляющих Еп = Ек + Ер. Так как Ек = mv2/2, а потенциальная энергия притяжения электрона к ядру равна произведению потенциала электрического поля ядра на заряд электрона, то
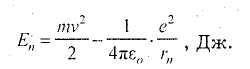
Знак «минус» присутствует в этой формуле потому, что за ноль потенциальной энергии принята энергия такого состояния атома, когда электрон удален от ядра на бесконечное расстояние, то есть атом ионизирован.
Орбиты или оболочки, которые занимает электрон в атоме, обозначают прописными буквами латинского алфавита, начиная от К, затем L, М, N и т. д. Поэтому электрон, расположенный на ближайшей к ядру оболочке, называют К-электроном. Кроме этого, оболочки нумеруют числами 1, 2, 3... Эти числа, как известно, называют главными квантовыми и обозначают символом n.
