
- •Харків – 2015
- •Фізика Навчальний посібник
- •З м і с т
- •1. Кінематика матеріальної точки
- •1.1. Кінематика поступального руху
- •Основні характеристики механічного руху
- •1.2. Кінематика обертального руху
- •Зв’язок між лінійними і кутовими параметрами
- •З формули (1.12) видно, що лінійна швидкість зростає із збільшенням радіуса. Враховуючи, що і, то для обертального руху:
- •1.3. Повне прискорення при криволінійному русі
- •Контрольні запитання
- •2. Динаміка поступального руху
- •2.1. Закони динаміки матеріальної точки
- •2.2. Імпульс. Закон збереження імпульсу.
- •2.3. Центр мас (центр інерції) механічної системи
- •2.4. Робота змінної сили. Потужність
- •2.5. Механічний принцип відносності
- •Контрольні запитання
- •3. Енергія. Силове потенціальне поле сили в механиці
- •3.1. Енергія. Кінетична енергія
- •3.2. Силове потенціальне поле. Потенціал
- •3.3. Графічне подання енергії
- •3.4. Сили в механіці
- •3.5. Деформація біологічних тканин
- •Контрольні запитання
- •4. Динаміка обертального руху
- •4.1. Момент сили
- •4.2. Момент інерції
- •Моменти інерції геометричних тіл масою
- •4.3. Момент імпульсу
- •4.4. Робота та кінетична енергія при обертальному русі
- •4.5. Основний закон динаміки обертального руху.
- •4.6. Вільні осі обертання. Гіроскопи
- •4.7. Статика твердого тіла
- •Контрольні запитання
- •5. Механічні фактори навколишнього середовища
- •5.1. Тиск. Атмосферний тиск
- •5.2. Вітер. Рух повітряних потоків
- •5.3. Вплив вібрацій на живі організми. Землетруси
- •5.4. Фізичні механізми механорецепції
- •6. Механіка рідинних і газових потоків
- •6.1. Потік рідини. Рівняння нерозривності
- •6.2. Тиск в рідині. Рівняння Бернуллі
- •Контрольні запитання
- •7. Основи молекулярної фізики
- •7.1. Основні положення молекулярно-кінетичної теорії речовини
- •Рух молекул газів, рідин і твердих тіл
- •7.2. Ідеальний газ. Основне рівняння молекулярно-кінетичної теорії (мкт) ідеального газу
- •7.3. Ізопроцеси у газах
- •7.4. Рівняння Менделєєва-Клапейрона
- •7.5. Закон Дальтона
- •7.6. Вологість повітря
- •7.7. Органи відчуття. Нюх і смак
- •Контрольні запитання
- •8. Основи класичної статистики. Явища переносу
- •8.1. Розподіл Максвелла. Швидкості молекул газу
- •8.2. Барометрична формула. Розподіл Больцмана
- •8.3. Середня довжина вільного пробігу молекул газу
- •8.4. Явища переносу
- •8.4.1. Теплопровідність. Закон Фур’є
- •8.4.2. В’язке тертя. Закон Ньютона
- •8.4.3. Дифузія. Закон Фіка. Осмос
- •Контрольні запитання
- •9. Реальні гази. Властивості рідини
- •9.1. Реальні гази. Рівняння Ван-дер-Ваальса
- •9.2. Властивості рідини
- •9.2.1. Структура і властивості води
- •9.2.2. Поверхневий натяг. Капілярні явища
- •9.3. Рідкі кристали
- •Контрольні запитання
- •10. Основи термодинаміки
- •10.1. Внутрішня енергія
- •10.2. Робота ідеального газу
- •10.3. Перший закон термодинаміки
- •10.4. Фазові перетворення. Діаграма стану системи
- •10.5. Адіабатичний процес. Рівняння Пуассона
- •10.6. Ефект Джоуля-Томсона. Зрідження газів
- •10.7. Теплова машина. Другий закон термодинаміки
- •10.8. Ентропія. Статистична інтерпретація ентропії
- •10.9. Вплив теплових факторів на живі організми
- •10.10. Фізичні механізми терморецепції
- •Контрольні запитання
- •11. Твердий стан речовини
- •Контрольні запитання
- •12. Механічні властивості біологічних тканин
- •13. Теплові властивості землі і атмосфери
- •13.1. Тепловий режим атмосфери
- •13.2. Теплофізичні характеристики ґрунту
- •13.3. Теплове забруднення води
- •13.4. Вимірювання температури
7.3. Ізопроцеси у газах
Термодинамічною системою називається будь-яка фізична система, яка складається з великого числа атомів і молекул, які здійснюють невпорядкований тепловий рух і, взаємодіючи між собою, обмінюються енергією. Будь-яка зміна в термодинамічній системі, яка пов`язана із зміною хоча б одного з термодинамічних параметрів (p, V, T) стану системи, називається термодинамічним процесом. Ізопроцесами у газах називають термодинамічні процеси, які відбуваються при постійному значенні одного з параметрів стану системи (p, V, T).
Рівноважними (квазістатичними) називаються такі процеси, під час яких зміна стану системи відбувається дуже повільно і система проходить неперервний ряд нескінченно близьких рівноважних термодинамічних станів, тобто час переходу значно більше часу релаксації системи.
Нестатичними називаються такі процеси, під час яких час переходу значно менше часу релаксації системи. Розглянемо закони ідеального газу, які були отримані дослідним шляхом.
Ізотермічний процес – це процес, що відбувається при постійній температурі T = const (рис. 6.2). Бойль і Маріотт (Р. Бойль (1627 – 1691), Маріотт (1620 – 1684) довели, що для даної маси газу (m) при постійній температурі (T) добуток тиску на об'єм є величина стала. У цьому процесі параметри р і V змінюються обернено пропорційно:
![]() (7.10)
(7.10)
Ізобаричний процес у газах – це процес, що відбувається при постійному тиску (p = const) (рис.6.3). У цьому процесі параметри V і T змінюються прямо пропорційно,
Гей-Люссак довів, що в ізобарному процесі (p = const) для даної маси газу при постійному тиску об'єм газу змінюється пропорційно до температури:
![]() (7.11)
(7.11)
де
![]() об’єм
газу при нормальній температурі;
об’єм
газу при нормальній температурі;
![]() температурний коефіцієнт. Виявилось,
що для всіх газів він дорівнює
температурний коефіцієнт. Виявилось,
що для всіх газів він дорівнює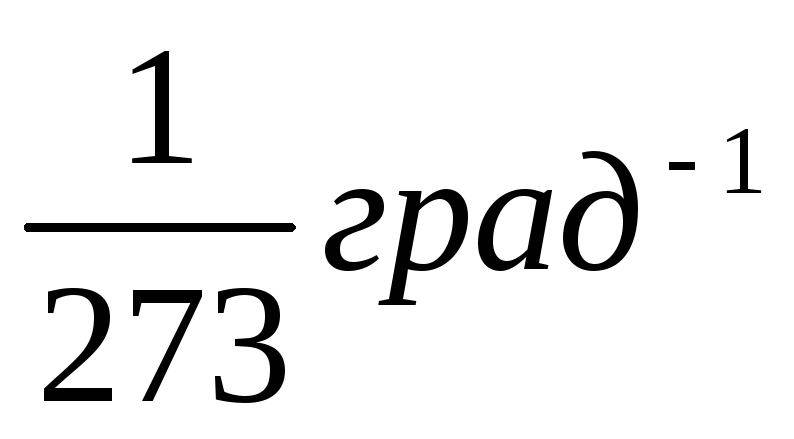 .
.
У
1848 р. Уільям Томсон (1824–1907) ввів поняття
абсолютної температури
![]()
![]() :
:
 (7.12)
(7.12)
Тоді закон Гей-Люссака формулюється так: для даної маси газу
при постійному тиску відношення об'єму до температури є величина стала:
![]() .
(7.13)
.
(7.13)
При ізохорному процесі (V = const) ідеальний газ підпорядковується закону Шарля (1746-1823): для даної маси газу при постійному об'ємі відношення тиску до температури є величина стала:
![]() .
(7.14)
.
(7.14)
Графіки ізопроцесів показані на рис. 7.2, 7.3, 7.4.
p
|
T = сonst
0 V Рис. 7.2 |
V
p = сonst
Рис. 7.3 |
V = сonst
0 Т Рис. 7.4 |
Абсолютний нуль – це температура, при якій тиск газу стає рівним нулю, тому що припиняється поступальний і обертовий рух молекул. Залишаються тільки так звані «нульові» коливання молекул речовини.


 p
ізотерма
p
ізотерма ізобара
ізобара p
ізохора
p
ізохора