
- •Харків – 2015
- •Фізика Навчальний посібник
- •З м і с т
- •1. Кінематика матеріальної точки
- •1.1. Кінематика поступального руху
- •Основні характеристики механічного руху
- •1.2. Кінематика обертального руху
- •Зв’язок між лінійними і кутовими параметрами
- •З формули (1.12) видно, що лінійна швидкість зростає із збільшенням радіуса. Враховуючи, що і, то для обертального руху:
- •1.3. Повне прискорення при криволінійному русі
- •Контрольні запитання
- •2. Динаміка поступального руху
- •2.1. Закони динаміки матеріальної точки
- •2.2. Імпульс. Закон збереження імпульсу.
- •2.3. Центр мас (центр інерції) механічної системи
- •2.4. Робота змінної сили. Потужність
- •2.5. Механічний принцип відносності
- •Контрольні запитання
- •3. Енергія. Силове потенціальне поле сили в механиці
- •3.1. Енергія. Кінетична енергія
- •3.2. Силове потенціальне поле. Потенціал
- •3.3. Графічне подання енергії
- •3.4. Сили в механіці
- •3.5. Деформація біологічних тканин
- •Контрольні запитання
- •4. Динаміка обертального руху
- •4.1. Момент сили
- •4.2. Момент інерції
- •Моменти інерції геометричних тіл масою
- •4.3. Момент імпульсу
- •4.4. Робота та кінетична енергія при обертальному русі
- •4.5. Основний закон динаміки обертального руху.
- •4.6. Вільні осі обертання. Гіроскопи
- •4.7. Статика твердого тіла
- •Контрольні запитання
- •5. Механічні фактори навколишнього середовища
- •5.1. Тиск. Атмосферний тиск
- •5.2. Вітер. Рух повітряних потоків
- •5.3. Вплив вібрацій на живі організми. Землетруси
- •5.4. Фізичні механізми механорецепції
- •6. Механіка рідинних і газових потоків
- •6.1. Потік рідини. Рівняння нерозривності
- •6.2. Тиск в рідині. Рівняння Бернуллі
- •Контрольні запитання
- •7. Основи молекулярної фізики
- •7.1. Основні положення молекулярно-кінетичної теорії речовини
- •Рух молекул газів, рідин і твердих тіл
- •7.2. Ідеальний газ. Основне рівняння молекулярно-кінетичної теорії (мкт) ідеального газу
- •7.3. Ізопроцеси у газах
- •7.4. Рівняння Менделєєва-Клапейрона
- •7.5. Закон Дальтона
- •7.6. Вологість повітря
- •7.7. Органи відчуття. Нюх і смак
- •Контрольні запитання
- •8. Основи класичної статистики. Явища переносу
- •8.1. Розподіл Максвелла. Швидкості молекул газу
- •8.2. Барометрична формула. Розподіл Больцмана
- •8.3. Середня довжина вільного пробігу молекул газу
- •8.4. Явища переносу
- •8.4.1. Теплопровідність. Закон Фур’є
- •8.4.2. В’язке тертя. Закон Ньютона
- •8.4.3. Дифузія. Закон Фіка. Осмос
- •Контрольні запитання
- •9. Реальні гази. Властивості рідини
- •9.1. Реальні гази. Рівняння Ван-дер-Ваальса
- •9.2. Властивості рідини
- •9.2.1. Структура і властивості води
- •9.2.2. Поверхневий натяг. Капілярні явища
- •9.3. Рідкі кристали
- •Контрольні запитання
- •10. Основи термодинаміки
- •10.1. Внутрішня енергія
- •10.2. Робота ідеального газу
- •10.3. Перший закон термодинаміки
- •10.4. Фазові перетворення. Діаграма стану системи
- •10.5. Адіабатичний процес. Рівняння Пуассона
- •10.6. Ефект Джоуля-Томсона. Зрідження газів
- •10.7. Теплова машина. Другий закон термодинаміки
- •10.8. Ентропія. Статистична інтерпретація ентропії
- •10.9. Вплив теплових факторів на живі організми
- •10.10. Фізичні механізми терморецепції
- •Контрольні запитання
- •11. Твердий стан речовини
- •Контрольні запитання
- •12. Механічні властивості біологічних тканин
- •13. Теплові властивості землі і атмосфери
- •13.1. Тепловий режим атмосфери
- •13.2. Теплофізичні характеристики ґрунту
- •13.3. Теплове забруднення води
- •13.4. Вимірювання температури
10. Основи термодинаміки
10.1. Внутрішня енергія
Термодинаміка – це розділ фізики, у якому вивчають теплові явища в газах, рідинах і твердих тілах на основі процесів перетворення енергії. Молекули і атоми речовини безупинно рухаються і взаємодіють між собою, тому речовина має внутрішню енергію.
Внутрішня
енергія термодинамічної
системи
![]() це
сума
це
сума
кінетичних
![]() і
потенціальних
і
потенціальних
![]() енергій
усіх частинок (молекул або атомів), які
утворюють систему:
енергій
усіх частинок (молекул або атомів), які
утворюють систему:
![]() .
(10.1)
.
(10.1)
Кінетичну енергію частинки і тіла набувають унаслідок руху, а потенціальну – внаслідок взаємодії між собою. Кінетична енергія молекул залежить від числа незалежних координат (ступенів вільності), які має тіло в процесі руху. Рух твердого тіла в просторі визначається трьома поступальними ступенями вільності і трьома обертальними. Одноатомна молекула має три поступальних ступені вільності, двохатомна – три поступальних і два обертальних, трьохатомна – три поступальних і три обертальних. Якщо атоми в молекулі коливаються (при високих температурах), то виникають і коливальні ступені вільності. Взагалі число ступенів вільності становить:
![]() (10.2)
(10.2)
На коливальну ступінь вільності припадає кінетична і потенціальна енергія, тому з’являється коефіцієнт 2. Больцман встановив
закон рівномірного розподілу енергії за ступенями вільності: в середньому на кожну ступінь вільності припадає однакова енергія:
 (10.3)
(10.3)
де
![]() стала
Больцмана.
стала
Больцмана.
Внутрішня
енергія ідеального газу дорівнює добутку
числа молекул
![]() на середню кінетичну енергію однієї
молекули:
на середню кінетичну енергію однієї
молекули:
 (10.4)
(10.4)
Підставимо
число молей
![]() .
Тоді внутрішня енергія ідеального газу:
.
Тоді внутрішня енергія ідеального газу:
![]() (10.5)
(10.5)
де
![]() –
універсальна газова стала.
–
універсальна газова стала.
З
формули (10.5) видно, що для заданої маси
m
внутрішня енергія ідеального газу і її
зміна
![]() залежать тільки від температури і тому
є функцією стану термодинамічної
системи.
залежать тільки від температури і тому
є функцією стану термодинамічної
системи.
10.2. Робота ідеального газу
Розглянемо
процес квазістатичного розширення газу
в циліндрі об’ємом
![]() під
поршнем площею
під
поршнем площею
![]() при
постійному тиску (рис. 10.1). Газ, розширюючись,
тисне на поршень, і виконує роботу:
при
постійному тиску (рис. 10.1). Газ, розширюючись,
тисне на поршень, і виконує роботу:
![]() (10.6)
(10.6)
де
![]() переміщення поршня.
переміщення поршня.
Під
час розширення газ виконує додатну
роботу, тому що напрямок сили і напрямок
переміщення поршня збігаються. Якщо
тиск газу змінюється, то робота дорівнює
сумі робіт при малих змінах об'єму
![]() :
:
 (10.7)
(10.7)
Робота
газу при
постійному тиску дорівнює добутку тиску
на зміну об'єму (рис.10.1).
Якщо термодинамічна система тіл виконує
роботу, то внутрішня енергія зменшується
(![]() ). Робота над системою приводить до
збільшення внутрішньої енергії системи:
). Робота над системою приводить до
збільшення внутрішньої енергії системи:
![]()

Рис. 10.1
Розглянемо роботу газу при ізопроцесах:
1.
Ізотермічний процес
![]() :
:
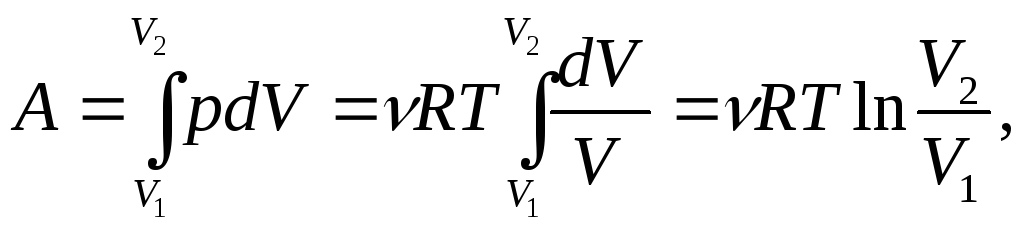 (10.8)
(10.8)
де
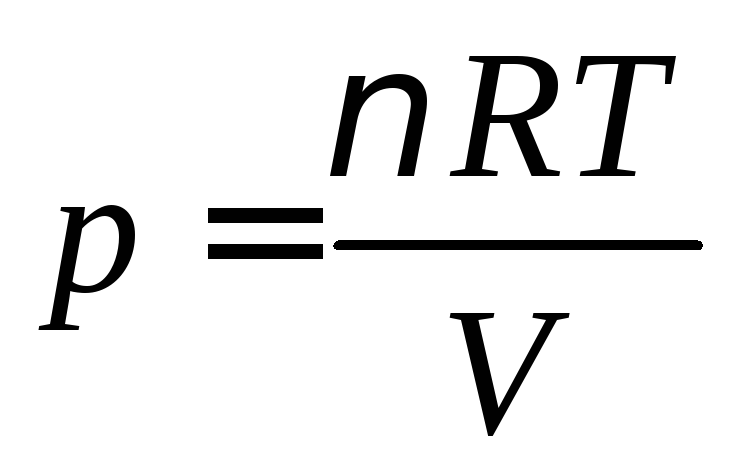 – рівняння Менделеева- Клапейрона.
– рівняння Менделеева- Клапейрона.
2.
Ізобарний процес
![]() :
:
 (10.9)
(10.9)
3.
Ізохорний процес
![]() :
:
![]() (10.10)
(10.10)
Розглянемо круговий термодинамічний квазістатичний процес (цикл). Циклічним називається процес, у результаті якого система переходячи через проміжні стани, повертається в початковий стан.
Нехай
термодинамічна система переходить з
точки 1 з параметрами
![]() у точку 2 з параметрами
у точку 2 з параметрами![]() по шляху 1-а-2, а з точки 2 в точку 1 по шляху
2-б-1 (рис. 10.2). У такому процесі робота
дорівнює різниці робіт, тому робота по
замкненому шляху не дорівнює нулю:
по шляху 1-а-2, а з точки 2 в точку 1 по шляху
2-б-1 (рис. 10.2). У такому процесі робота
дорівнює різниці робіт, тому робота по
замкненому шляху не дорівнює нулю:
![]() (10.11)
(10.11)
Таким чином, робота не є функцією стану тому, що не характеризує термодинамічну систему, оскільки залежить від форми шляху переходу.

Рис 10.2
Теплопередачею
(теплообміном)
називається
процес зміни внутрішньої енергії
![]() термодинамічної
системи без виконання роботи.
Мірою
зміни внутрішньої енергії
термодинамічної
системи без виконання роботи.
Мірою
зміни внутрішньої енергії
![]() при
теплопередачі є кількість теплоти
при
теплопередачі є кількість теплоти
![]() .
.
