
- •Специфика органической химии
- •Теория гибридизации
- •Типы гибридных орбиталей
- •Первое валентное состояние атома углерода Гибридизация sp3
- •Мезомерный эффект (эффект сопряжения) [±m]
- •Понятие сопряжения
- •Эффекты сопряжения
- •Правило Морковникова
- •Донорно-акцепторные связи. Семиполярные связи
- •Водородная связь
- •Названия ненасыщенных и ароматических углеводородов
- •Номенклатура гетероциклических соединений
- •Номенклатура июпак для производных различных классов органических соединений
- •Изомерия органических соединений
- •Структурная изомерия
- •Изомерия положения
- •Геометрическая изомерия (зеркальная, цис- транс- изомерия)
- •Оптическая изомерия
- •Устройство поляриметра
- •Диастереомеры
- •Номенклатура стереоизомеров
- •Номенклатура Кана, Ингольда, Прелога (кип)
- •Номенклатура стереоизомеров Потапова в.М., Терентьева а.П. И сотрудников
- •2(Ρ),3-диоксипропаналь
- •3(Ρ),4-дихлорпентен-4-аль
- •Классификация органических реакций и реагентов
- •По способу разрыва (образования) химических связей.
- •Классификация реакций по типу превращений в органических веществах
- •Свободные радикалы
- •Понятие о граничных структурах
- •Алканы (парафины)
- •Физические свойства
- •Промышленная переработка алканов (нефти)
- •Некоторые лабораторные способы получения алканов
- •Нитрование алканов
- •Строение малых циклов (циклопропан, циклобутан)
- •Некоторые закономерности реакции отщепления
- •Дегидратация спиртов (отщепление воды)
- •Дегалогенирование дигалогенпроизводных
- •Восстановление алкинов (ацетиленов)
- •Расщепление четвертичных аммонийных солей по Гофману
- •Присоединение галогенов
- •Строение диенов
- •Химические свойства диенов
- •Реакции присоединения
- •Механизм реакции [ae] для сопряженных диенов
- •Некоторые аспекты применения сопряженных диенов
- •Алкины (ацетилены)
- •Способы получения ацетилена
- •Некоторые способы получения гомологов ацетилена
- •Общая характеристика реакционной способности ацетиленов
- •Физические свойства ацетилена
- •Химические свойства
- •Реакции присоединения
- •Реакции нуклеофильного присоединения к ацетиленам
- •Некоторые свойства виниловых эфиров
- •Ароматические углеводороды
- •Признаки ароматичности
- •Направление реакций ароматических соединений
- •II стадия:
- •Мнемоническое правилосмещения электронной плотности под действием заместителя в ядре
- •Нуклеофильное замещение в ароматических системах (snAr)
- •Механизм реакции snAr
- •Галогенпроизводные углеводородов
- •Методы получения галогенпроизводных
- •Замещение водорода на галоген в условиях радикальных процессов (прямое галогенирование алканов)
- •Галогенирование непредельных углеводородов
- •Получение галогенпроизводных из непредельных углеводородов
- •Общая характеристика реакционной способности галогенпроизводных
- •Важнейшие реакции галогенпроизводных
- •Образование металлорганических соединений
- •Содержание
Некоторые закономерности реакции отщепления
Механизм Е2 протекает исключительно как транс-элиминирование и не сопровождается перегруппировками (т.е. на промежуточной стадии не образуется карбокатион).
Реакции Е1 сопровождаются нуклеофильным замещением и перегруппировкой. На самом деле вещества не реагируют исключительнопо механизму Е1 или Е2. Так, если галогенпроизводное является третичным, наиболее вероятен механизм Е1. Если галогенпроизводное первичное, то наиболее предпочтителен механизм Е2. В случае вторичных галогенпроизводных возможно протекание реакции по обоим механизмам.
Скорость реакции зависит также от основности алкоголят-аниона.
![]()
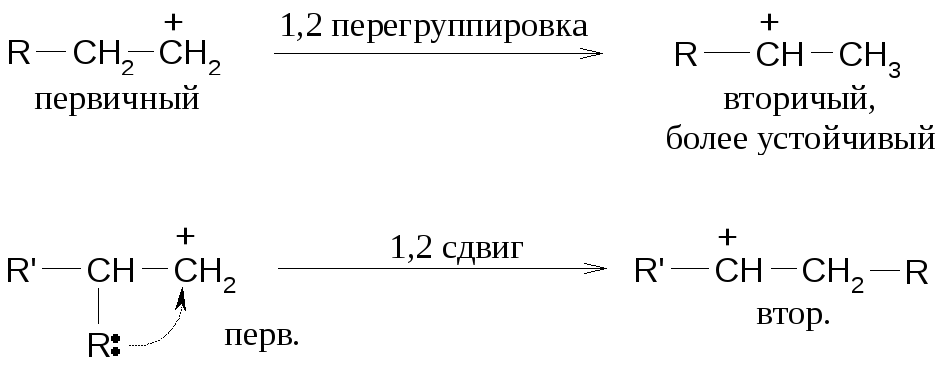
Если радикал R–третичный
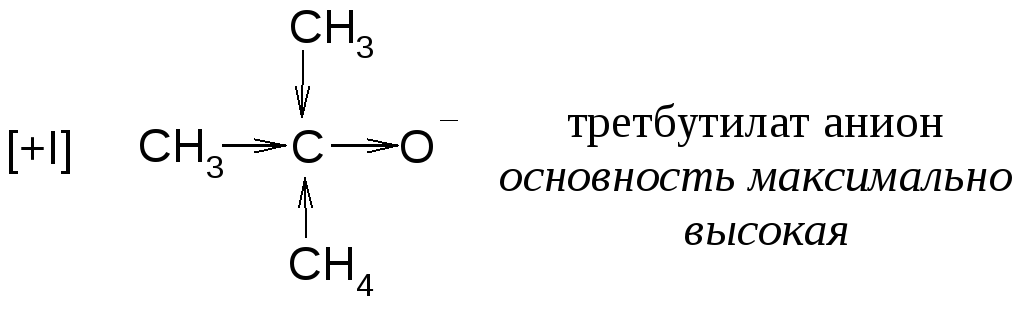
В нуклеофильных перегруппировках (реакции Е1) может участвовать как углеводородный заместитель с парой электронов, так и гидрид-анион:
Дегидратация спиртов (отщепление воды)
Подчиняется тем же закономерностям, что и другие реакции элиминирования.
Катализаторы отщепления
Окислы алюминия и силикаты:
![]()
При химической дегидратации катализаторами являются H2SO4, H3PO4и их соли. Схема реакции та же, но механизм элиминирования особый, только для спиртов.
Механизм:
Протонизация спиртов
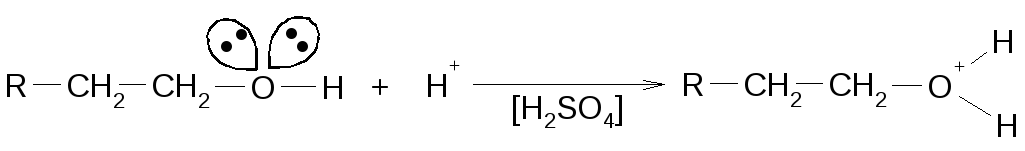
Отщепление воды
![]()
[первая стадия механизма Е1]
Выброс протона от α-углеродного атома
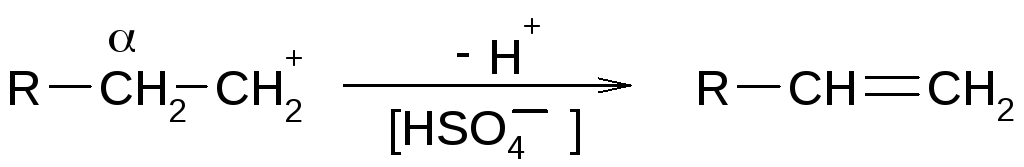
[вторая стадия – как в механизме Е1]
Таким образом, реакция может сопровождаться перегруппировками углерод-углеродного скелета. Реакция легче протекает с третичными спиртами (стабильные карбокатионы). Менее гидрогенизированный атом углерода на последней стадии легче отдает протон.
Одна из разновидностей химической дегидратации это дегидратация в присутствии кислот Льюиса.
Механизм:
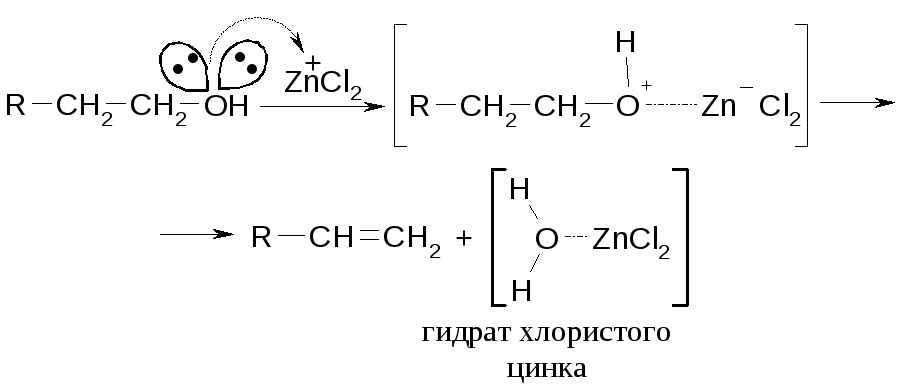
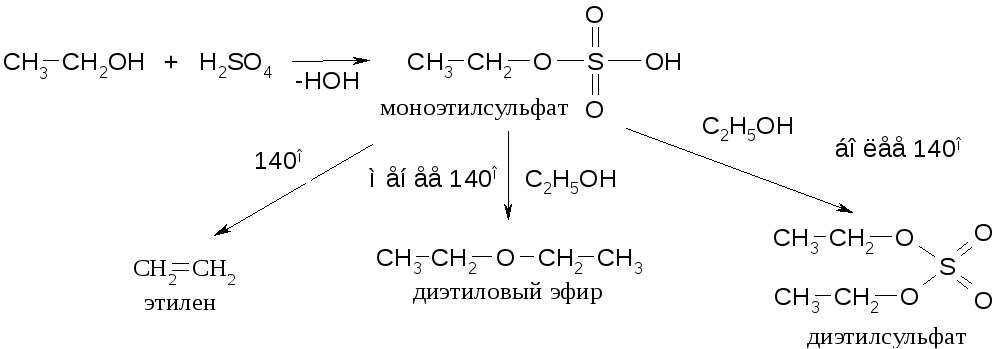
В условиях реакции с серной кислотой в промышленности процесс проводят в две стадии через получение сернокислых эфиров.
Это дает возможность получать не только алкены, но и дисульфоэфиры и простые эфиры.
Пример:
Дегалогенирование дигалогенпроизводных
Вицинальные дигалогенпроизводные в условиях реакции Вюрца образуют алкены
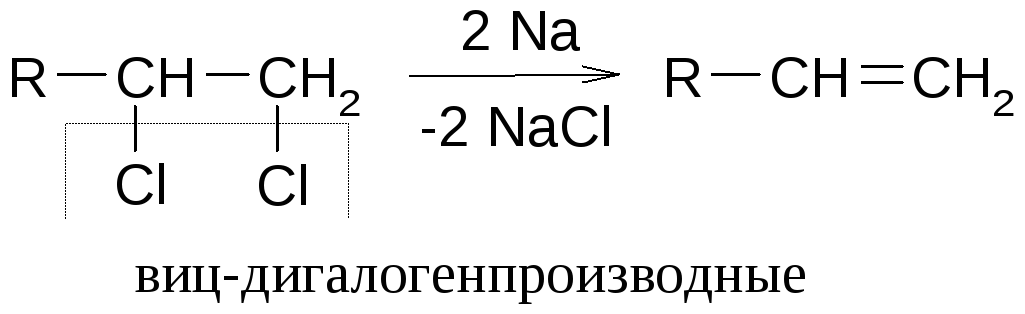
Более стабильные результаты получают при использовании вместо Naцинковой пыли.
Восстановление алкинов (ацетиленов)
Алкины можно восстанавливать до цис- или транс-алкенов.
Для получения цис-конфигурации двойной связи восстановление проводят водородом на катализаторе Линдлара или частично отравленных благородных катализаторах.
4% Pd(CaCO3)Pb(OCOCH3) (ацетат свинца или нитрат свинца)
Подтравливать можно хинолином. При использовании PdнаCaCO3алкины восстанавливаются до алкенов.
Транс-алкены можно получить при восстановлении натрием в жидком аммиаке.

Сильным химическим восстановителем является алюмогидрид лития или его алкоголяты:
LiAlH4 алюмогидрид лития, твердый, порошкообразный, пирофорный.
AlH(OR)2алкоголят, жидкий, светло-зеленого цвета, не загорается, не пирофорный.
Расщепление четвертичных аммонийных солей по Гофману
Протекает противправила Зайцева.
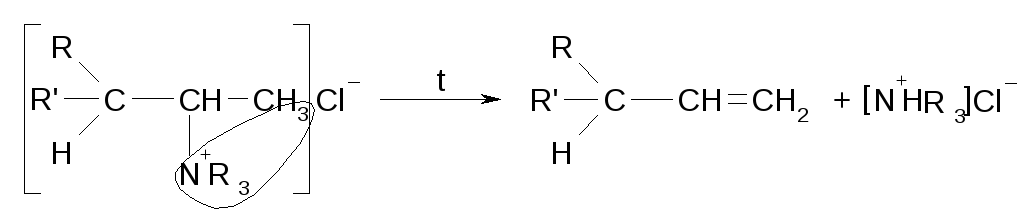
Термическое расщепление сложных эфиров по Коупу
При нагревании ацетатов выше температуры кипения (плавления) они разлагаются, образуя продукты элиминирования по правилу Зайцева:
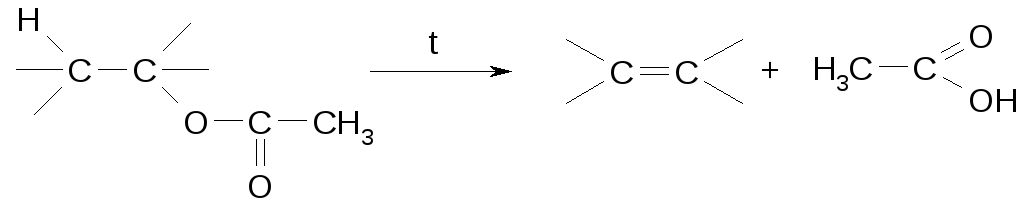
Реакция Фиттига
На первой стадии получают комплекс алкилгалогенида с трифенилфосфином.

Далее комплекс вводят в реакцию с карбонильным соединением:
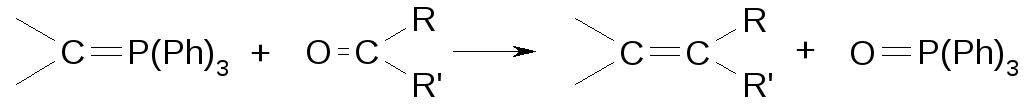
Образующееся соединение фосфора называют трифенилфосфиноксид (окись трифенилфосфина). Реакцию проводят в растворе супероснования (смесь гидроксид калия диметил сульфоксид):

Реакция Фиттига дает цис-алкены.
Химические свойства алкенов
Гидрирование (восстановление)
Проводят на катализаторах благородной группы (палладий, платина) или на металлах переходной группы (Fe,Co,Ni). Чаще всегоNi.
NiReсплавNiсAl,с последующим выщелачиваниемAlщелочью (NaOH):
![]()
Катализаторы на основе Niтребуют повышенных температур и давлений (до 200 ºС и до 250·105Па).
Существуют катализаторы гомогенного гидрирования (жидкости, легко растворимы в органических растворителях).
Трифенилфосфинпалладий хлорид [P(Ph)3]PdCl
Трифенилфосфинрутений гидрохлорид [P(Ph)3]Ru·HCl
Пространственные эффекты гидрирования
На основании наблюдений за процессом гидрирования алкенов на гетерогенных катализаторах (Ni,Pd) был предложен следующий механизм:

Разрыхление связей между атомами водорода приводит к более активной форме восстановителя (атомарный водород). Процесс протекает какцис-гидрирование.
За открытие катализаторов гомогенного гидрирования а Джеффри и Уилкинс стали Нобелевскими лауреатами 1973 года. Данные катализаторы работают региоспецифично.

Соединения бора с водородом – бораны также являются сильными восстановителями. Например:

