
- •Специфика органической химии
- •Теория гибридизации
- •Типы гибридных орбиталей
- •Первое валентное состояние атома углерода Гибридизация sp3
- •Мезомерный эффект (эффект сопряжения) [±m]
- •Понятие сопряжения
- •Эффекты сопряжения
- •Правило Морковникова
- •Донорно-акцепторные связи. Семиполярные связи
- •Водородная связь
- •Названия ненасыщенных и ароматических углеводородов
- •Номенклатура гетероциклических соединений
- •Номенклатура июпак для производных различных классов органических соединений
- •Изомерия органических соединений
- •Структурная изомерия
- •Изомерия положения
- •Геометрическая изомерия (зеркальная, цис- транс- изомерия)
- •Оптическая изомерия
- •Устройство поляриметра
- •Диастереомеры
- •Номенклатура стереоизомеров
- •Номенклатура Кана, Ингольда, Прелога (кип)
- •Номенклатура стереоизомеров Потапова в.М., Терентьева а.П. И сотрудников
- •2(Ρ),3-диоксипропаналь
- •3(Ρ),4-дихлорпентен-4-аль
- •Классификация органических реакций и реагентов
- •По способу разрыва (образования) химических связей.
- •Классификация реакций по типу превращений в органических веществах
- •Свободные радикалы
- •Понятие о граничных структурах
- •Алканы (парафины)
- •Физические свойства
- •Промышленная переработка алканов (нефти)
- •Некоторые лабораторные способы получения алканов
- •Нитрование алканов
- •Строение малых циклов (циклопропан, циклобутан)
- •Некоторые закономерности реакции отщепления
- •Дегидратация спиртов (отщепление воды)
- •Дегалогенирование дигалогенпроизводных
- •Восстановление алкинов (ацетиленов)
- •Расщепление четвертичных аммонийных солей по Гофману
- •Присоединение галогенов
- •Строение диенов
- •Химические свойства диенов
- •Реакции присоединения
- •Механизм реакции [ae] для сопряженных диенов
- •Некоторые аспекты применения сопряженных диенов
- •Алкины (ацетилены)
- •Способы получения ацетилена
- •Некоторые способы получения гомологов ацетилена
- •Общая характеристика реакционной способности ацетиленов
- •Физические свойства ацетилена
- •Химические свойства
- •Реакции присоединения
- •Реакции нуклеофильного присоединения к ацетиленам
- •Некоторые свойства виниловых эфиров
- •Ароматические углеводороды
- •Признаки ароматичности
- •Направление реакций ароматических соединений
- •II стадия:
- •Мнемоническое правилосмещения электронной плотности под действием заместителя в ядре
- •Нуклеофильное замещение в ароматических системах (snAr)
- •Механизм реакции snAr
- •Галогенпроизводные углеводородов
- •Методы получения галогенпроизводных
- •Замещение водорода на галоген в условиях радикальных процессов (прямое галогенирование алканов)
- •Галогенирование непредельных углеводородов
- •Получение галогенпроизводных из непредельных углеводородов
- •Общая характеристика реакционной способности галогенпроизводных
- •Важнейшие реакции галогенпроизводных
- •Образование металлорганических соединений
- •Содержание
Ароматические углеводороды
Признаки ароматичности
В 19 веке ученные обнаружили, что некоторые циклические соединения обладают черезвычайной устойчивостью к восстановлению и окислению. Подобные непредельные соединения не склонны к реакциям присоединения, поэтому долгое время не могли прогидрировать. Например, бензол прогидрировали лишь через сто лет после его открытия.
Брутто формула бензола – С6Н6. Однако, зная брутто формулу бензола, не могли определиться с его структурной формулой. Например:
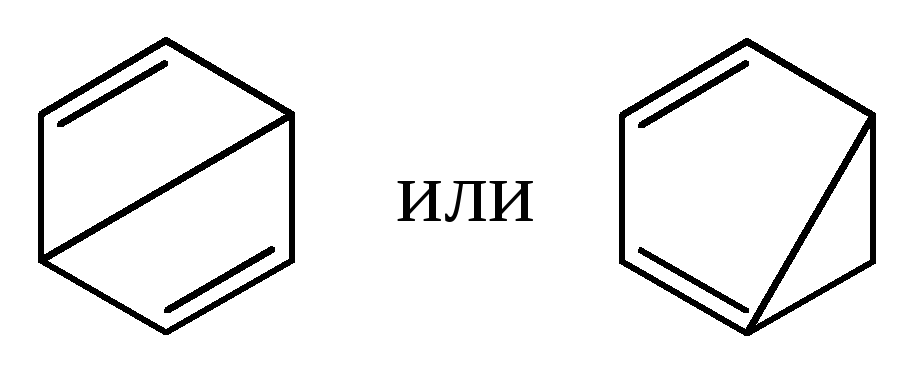
Большой вклад в определение структуры и термодинамических характеристик ароматических соединений внесли английские ученые: Ингланд, Илиел Э. и Кекуле.
В основе теории лежат три постулатаопределяющие особенности ароматических структур:
1) все ароматические соединения являются непредельными и циклическими;
2) все элементы цикличнеской структуры находятся в sp2гибридном состоянии;
3) ароматическая структура должна иметь плоскостное строение, то есть все атомы, входящие в цикл компланарны.
Непременным условием ароматичности является правило Хюккеля:
Количество электронов, участвующих в образовании π-системы подчиняется правилу q=4n+2, гдеn– любое целое положительное число. То есть, приn=0,q=2(минимальное количество π-электоронов). Для молекулы бензолаq=6 (три двойных связи), следовательно,n=1:
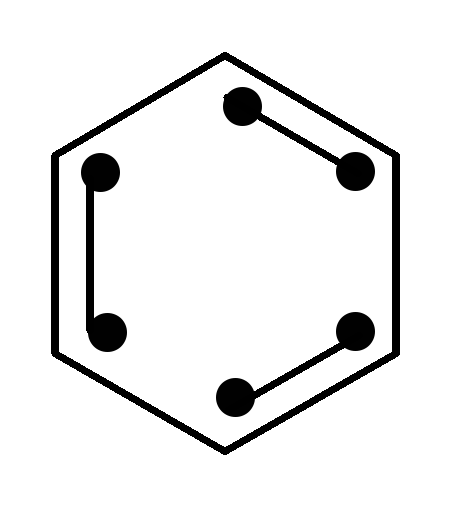
Молекулярная орбиталь ароматических соединений является, не просто энергетической суммой атомных орбиталей, входящих в систему элементов, но обладает гораздо меньшей энергией, чем простая сумма входящих в нее элементов.
Гидрирование молекулы бензола, требует больших затрат энергии, чем восстановление трех изолированных двойных связей. Разница в энергиях: 36,6 ккал/моль – показывает энергию делокализации кратных связей в ароматной системе.
Для окисления бензола используют катализаторы ванадиевой группы (без катализатора не окисляется):
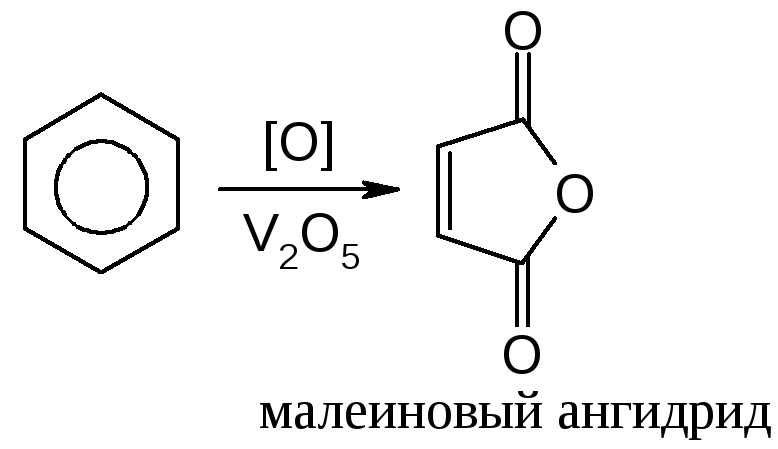
Ароматические соединения могут содержать в своем составе гетероатомы, а количество элементов в цикле, может меняться от 3-х до 20-и и более. В циклопропене один из атомов углерода sp3-гибриден. Для удовлетворения всем условиям ароматичности каждый элемент цикла должен находиться во втором валентном состоянии.
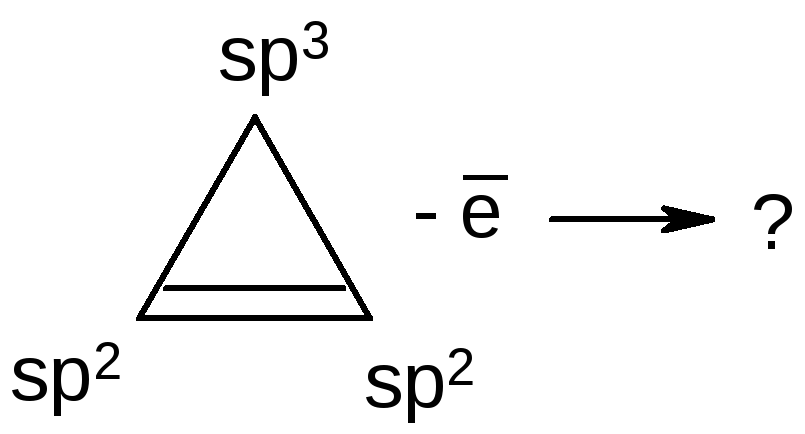
Как известно, карбокатионы sp2-гибридны:
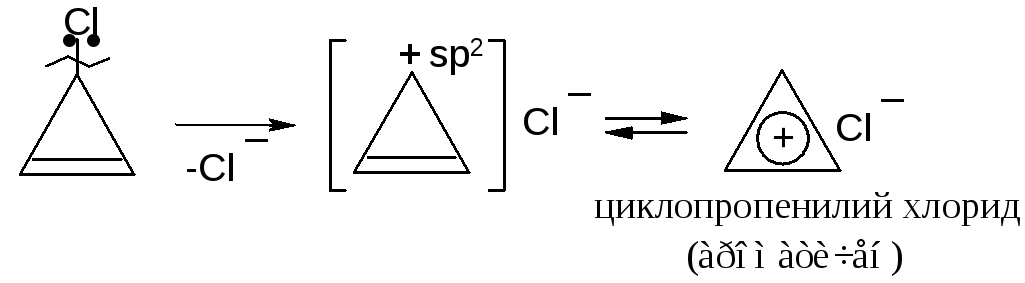
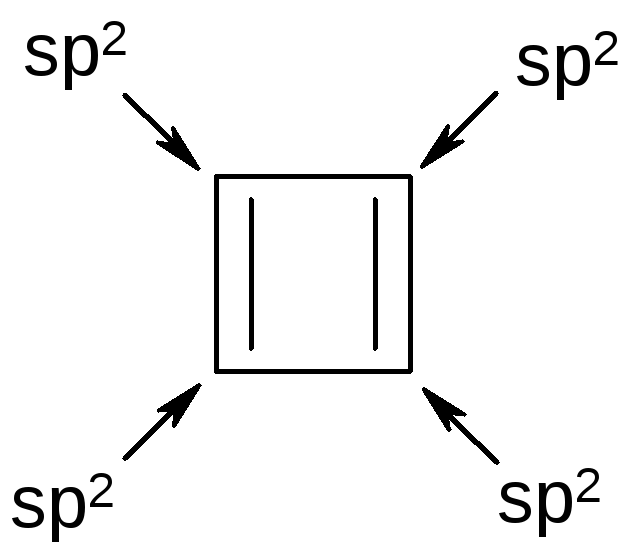
Циклобутадиен неароматичен, так как не соблюдается правило Хюккеля:
Циклопентадиен по этой же причине неароматичен, так как по правилу Хюккеля необходимо еще два π-электрона:
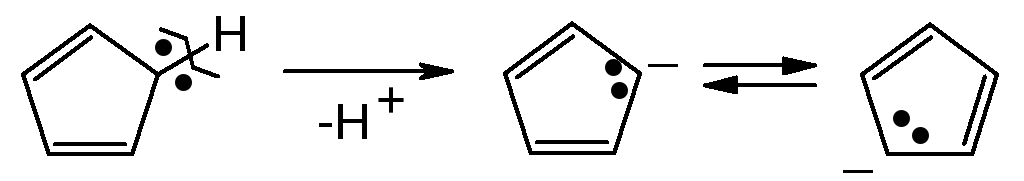
В результате получен:

Подобный анион встречается в природе и может образовывать прочные комплексы с катионами металлов: железом, кобальтом, никелем, которые называются металлоценами:
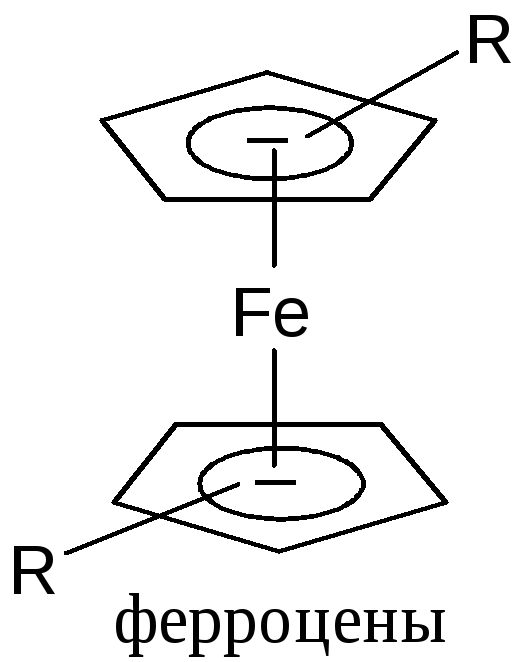
Для ароматических гетероциклов
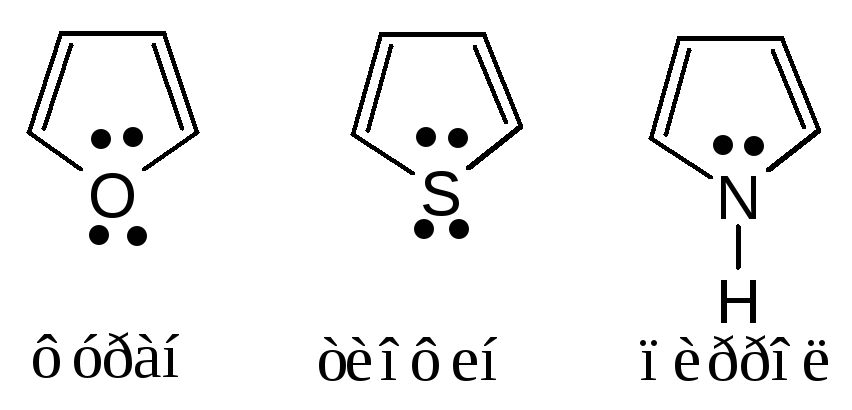
Соединения ароматичны, так как неподеленная пара электронов гетероатомов входит в π-систему.
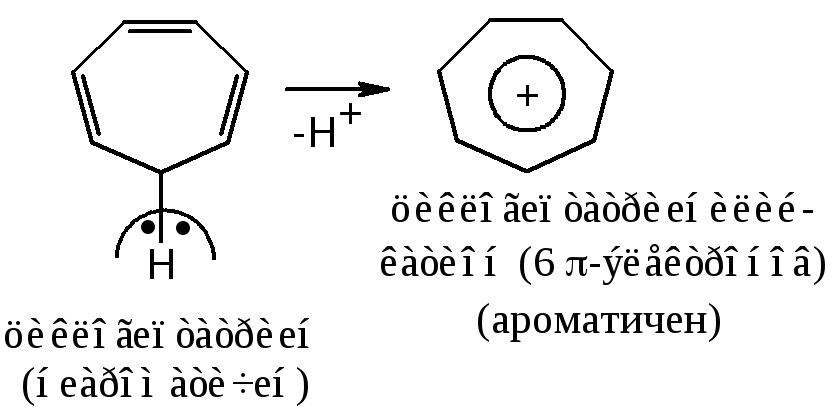
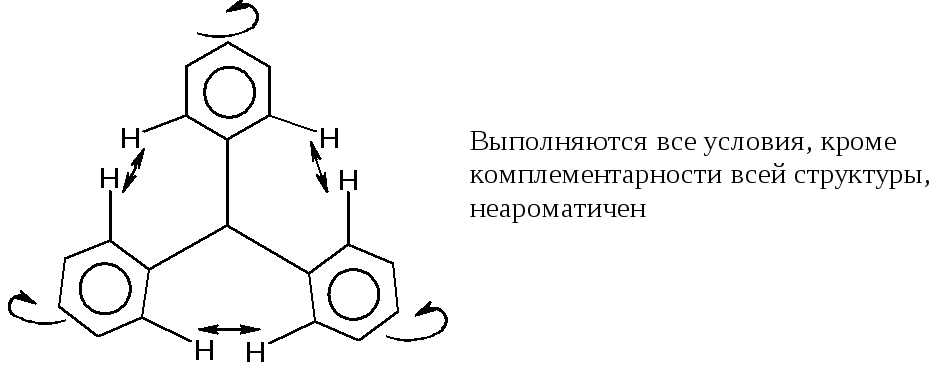
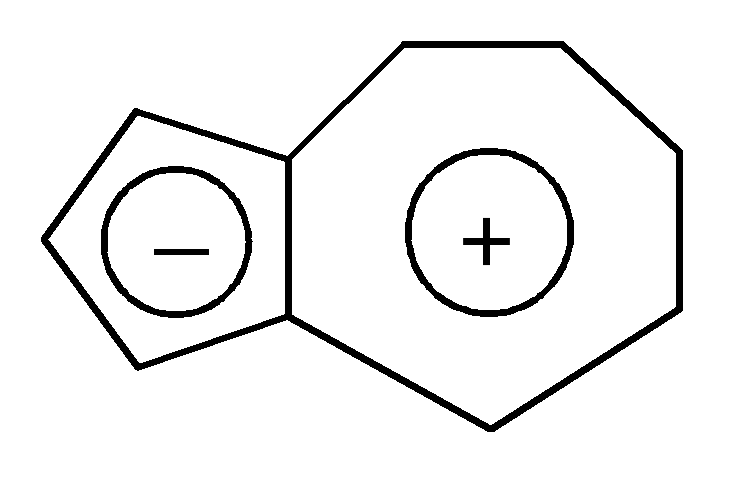
Азулен – природное соединение состоит из двух конденсированных ароматических циклов, циклопентадиенилий-аниона и циклогептатриенилий-катиона:
Направление реакций ароматических соединений
Ароматические соединения трудно окислить, восстановить, для них не характерны реакции присоединения.
Однако радикальное присоединение возможно:
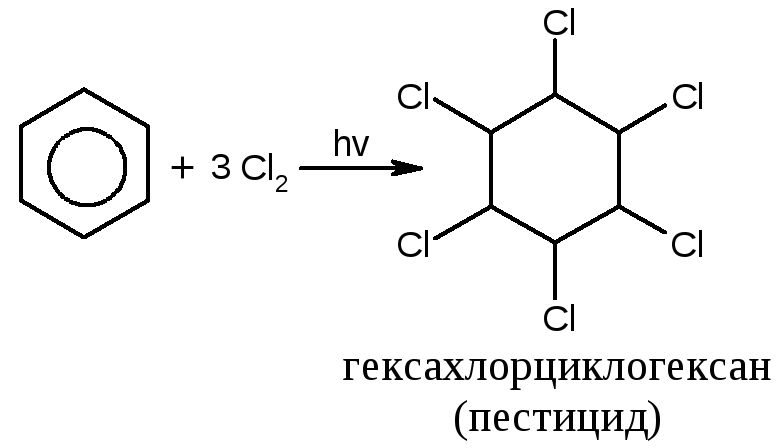
Наиболее характерны для ароматических соединений реакции электрофильного замещения.
Например, бензол легко бромируется в присутствии железных стружек:
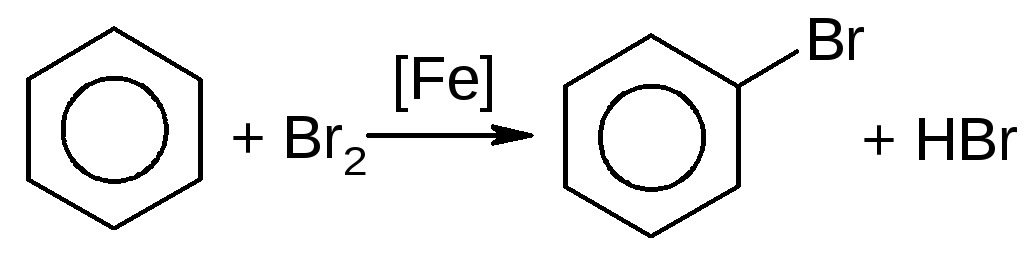
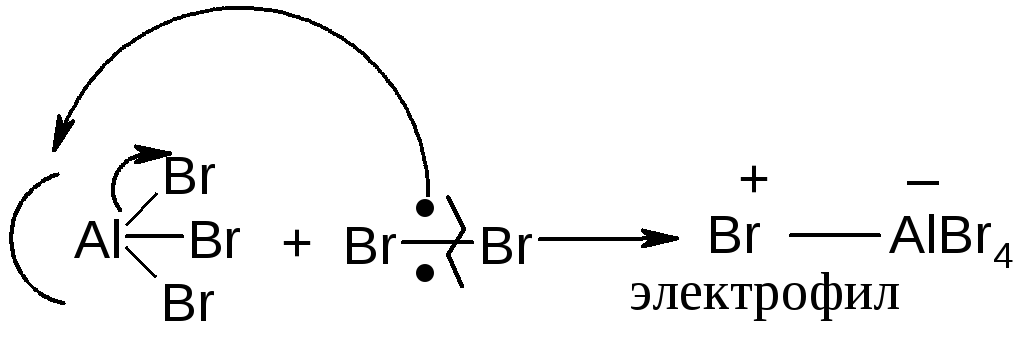
Замещение протекает по механизму [SEAr] –электрофильное замещение в ароматических системах. В качестве катализаторов применяют кислоты Льюиса: ZnCl2, AlCl3, FeCl3, FeBr3и т.д.
Кислоты Льюиса позволяют генерировать (образовывать) электрофильную частицу, с минимальными затратами энергии. Так, в случае бромирования I стадияэлектрофильного замещения (образование электрофилаBr+) выглядит следующим образом:
В некоторых случаях применения кислот Льюиса не требуется; например, при сульфировании или нитровании (электрофильный атом уже имеется):
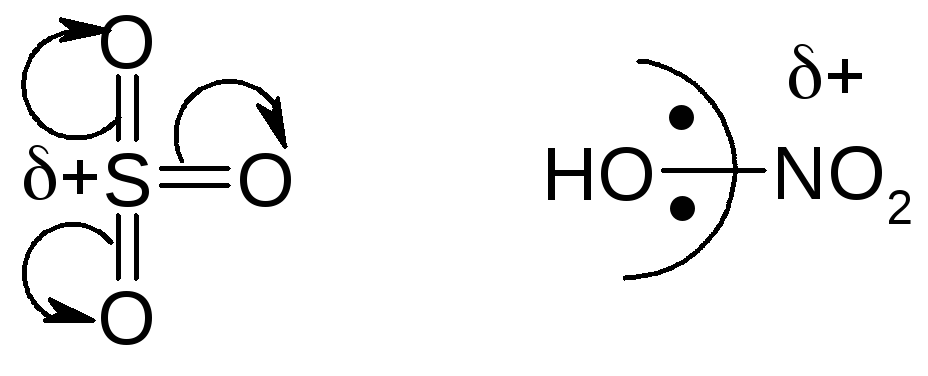
Если использовать нитрующую смесь
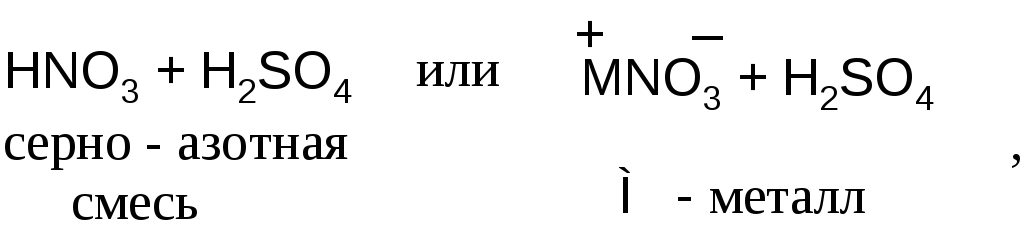
то схему образования электрофильной частицы можно представить уравнением:
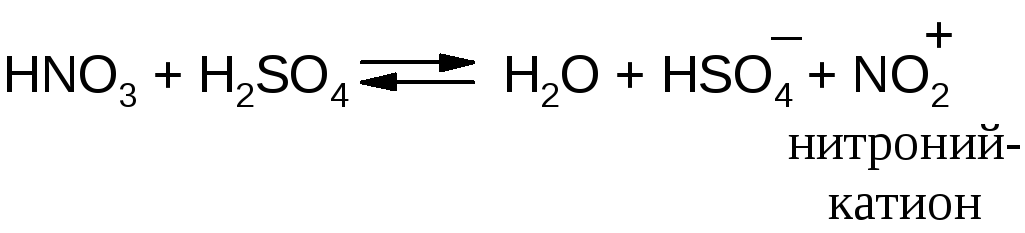
II стадия реакцииSEAr– образование π- и σ-комплексов.
π-Комплексомназывают комплекс ароматического ядра с электрофилом. Причем рассматривают этот комплекс как атаку π-электронов на электрофильную частицу.

Образование π-комплекса обратимый, медленно протекающий процесс. Затем электрофильная частица вступает в ядро в строго определенные положения (в соответствии с ориентирующим влиянием уже имеющихся в ядре заместителей). Образуется σ-комплекс, причем образуется также обратимо и медленно, как и π-комплекс (т.к. нарушается ароматичность системы).
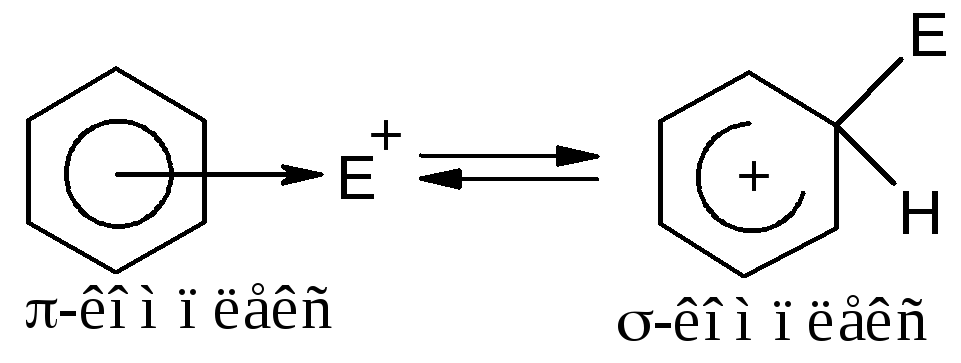
III стадияреакцииSEAr– выброс протона и восстановление ароматической системы.

На этой же стадии происходит регенерация кислоты Льюиса.
Бромирование бензола
I стадиярассмотрена выше
