
- •Рис. 9.2. К расчету теплообмена в реакторе вытеснения
- •Рис. 7.2. К примеру 10.1
- •Рис. 11.4. К примеру 11.1
- •Рис. 11.9. К расчету шпилек
- •Рис. 11.10. К примеру 11.3
- •Рис. 11.11. К примеру 11.5
- •Рис. 13.10. Рамные мешалки
- •Рис. 13.11. Якорные мешалки
- •Предисловие
- •Экологическое и технико-экономическое обоснование проектов химических производств.
- •Этапы проведения экологической экспертизы
- •Принципы экологической экспертизы
- •Рис. 1.1. Общая система организации проектирования
- •Рис. 1.2. Основные этапы и стадии разработки проектов для промышленного строительства
- •1.2. Задание на проектирование
- •Рис. 1.3. Пример построения розы повторяемости и силы ветров
- •Рис.1.4. Схема выпадения дымовых частиц при наличии зеленых защитных насаждений между застройкой и источником задымления и при отсутствии их:
- •Рис. 1.5. Совмещенная схема движения загрязненных нижнего и верхнего потоков
- •1.5. Разработка проектной документации по охране окружающей среды
- •1.5.2. Разработка прогноза загрязнения воздуха
- •1.5.4. Прогноз воздействия объекта при возможных авариях
- •1.6. Технологический процесс как основа промышленного проектирования
- •Рис. 1.6. Схема производства серной кислоты контактным способом:
- •Рис. 1.8. Процессы и аппараты химической технологии
- •Рис. 1.9. Виды оборудования химической технологии
- •Рис. 1.11. Уровни организации химического предприятия
- •1.7. Генеральный план химических предприятий
- •Рис. 1.12. Генеральный план предприятий химической промышленности
- •1.8. Типы промышленных зданий
- •1.8.1. Одноэтажные промышленные здания
- •Рис. 1.13. Одноэтажное здание павильонного типа:
- •Рис. 1.14. Многоэтажное производственное здание:
- •1.8.2. Многоэтажные здания
- •Рис. 1.15. Многоэтажное производственное здание:
- •Рис. 1.16. Поперечные разрезы зданий I и II очередей сернокислотного производства:
- •1.8.3. Вспомогательные здания и помещения химических предприятий
- •1.8.4. Склады промышленных предприятий
- •1.9. Инженерные сооружения
- •инженерных сооружений
- •1.10. Специальные вопросы проектирования химических предприятий
- •2.1. Основные стадии проектирования химических производств и оборудования
- •Рис. 2.1. Основные стадии проектирования
- •2.2. Виды конструкторских документов
- •2.4.1. Курсовое проектирование
- •2.4.2. Дипломное проектирование
- •2.4.3. Пример использования АвтоЛиспа
- •Рис. 2.2. Схема установки для ректификации трехкомпонентной смеси:
- •СИСТЕМЫ АВТОМАТИЗИРОВАННОГО ПРОЕКТИРОВАНИЯ
- •3.1. История развития САПР
- •3.2. Основные принципы создания САПР
- •Рис. 3.1. Модульная структура программного обеспечения
- •Рис. 3.2. Области использования ЭВМ в процессе проектирования
- •3.4. Автоматическое изготовление чертежей
- •3.5. Основные преимущества автоматизации проектирования
- •3.6. Основные требования к САПР
- •Рис. 3.3. Схема взаимодействия пользователя со средствами САПР:
- •3.7. Связь САПР с производством, расширение области применения
- •3.8. Система автоматизированного проектирования цементных заводов
- •3.8.1. Функционирование САПР
- •ВВЕДЕНИЕ В ПРОЕКТИРОВАНИЕ
- •4.1. Проектно-сметная документация
- •4.2.1. Исходные положения
- •4.2.2. Обоснование способа производства химической продукции
- •ВЫБОР И РАЗРАБОТКА ТЕХНОЛОГИЧЕСКОЙ СХЕМЫ ПРОИЗВОДСТВА
- •5.1. Общие положения
- •5.2. Последовательность разработки технологической схемы
- •Рис. 5.1. Примерная схема стадий технологического процесса:
- •Рис. 5.2. Блок-схема физико-химических процессов, протекающих в гетерофазном реакторе с мешалкой
- •5.3. Принципиальная технологическая схема
- •5.4. Размещение технологического оборудования
- •Выбор технологического оборудования химических производств
- •6.1. Основные типы химических реакторов
- •Рис. 6.1. Установка для непрерывного процесса:
- •Рис. 6.5. Изменение концентрации веществ в реакторах:
- •Рис. 6.6. Реакторы смешения:
- •6.2. Химические факторы, влияющие на выбор реактора
- •6.2.1. Реакции расщепления
- •Рис. 6.7. Относительный выход реакции расщепления:
- •Реактор
- •6.2.2. Реакции полимеризации
- •6.2.3. Параллельные реакции
- •Объем реактора
- •РВНД
- •6.3. Эскизная конструктивная разработка основной химической аппаратуры
- •6.3.1. Общие положения
- •6.3.2. Реакторы
- •6.4. Оптимизация процессов химической технологии
- •УРАВНЕНИЯ МАТЕРИАЛЬНОГО БАЛАНСА ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
- •7.1. Стехиометрические расчеты
- •7.2. Термодинамический анализ процессов
- •7.2.1. Равновесие химической реакции
- •Рис. 1.1. Зависимость коэффициента активности газв от приведенных давления и температуры
- •7.2.2. Расчет состава равновесной смеси
- •7.3. Общее уравнение баланса массы
- •7.4. Практический материальный баланс
- •7.5. Физико-химические основы технологического процесса
- •8.1. Общие положения
- •8.2. Расчет объемов реакторов
- •8.2.1. Основные положения химической кинетики
- •8.2.2. Расчет идеальных реакторов
- •8.3. Определение объемов аппарата
- •Тепловой расчет основного оборудования
- •9.1. Общее уравнение баланса энергии
- •Рис. 9.1. К примеру 9.1
- •9.2. Практический тепловой баланс
- •9.3. Теплообмен в реакторах
- •9.4. Расчет энтальпий и теплоемкостей
- •9.6. Расчет реактора периодического действия
- •Рис. 9.3. К тепловому расчету реактора периодического действия
- •9.7. Степень термодинамического совершенства технологических процессов
- •Рис. 9.6. Технологическая схема 1:
- •Рис. 9.7. Технологическая схема 2
- •Рис. 9.8. Схемы использования тепла реакций:
- •Гидравлические расчеты
- •10.1. Расчет диаметра трубопровода
- •Пары, насыщенные при абсолютном давлении (МПа)
- •Рис. 10.1. Зависимость коэффициента трения от критерия Рейнольдса и степени шероховатости трубы
- •10.3. Гидравлическое сопротивление кожухотрубчатых теплообменников
- •10.4. Подбор насосов
- •МЕХАНИЧЕСКИЙ РАСЧЕТ
- •11.1. Расчет сварных химических аппаратов
- •11.1.1. Основные расчетные параметры
- •11.1.2. Расчет на механическую прочность
- •11.1.3. Требования к конструированию
- •11.1.4. Расчет цилиндрических обечаек
- •Рис. 11.1. Номограмма для определения толщины цилиндрических обечаек, работающих под наружным давлением
- •Рис.11.2. Схема пользования номограммой на рис. 11.1:
- •11.1.5. Расчет крышек и днищ
- •Рис. 11.3. Основные конструкции днищ сварных аппаратов:
- •11.1.6. Подбор стандартных элементов
- •11.2. Расчет толстостенных аппаратов
- •Рис. 11.7. Основные конструкции уплотнений затворов высокого давления:
- •Рис. 11.8. К расчету усилий, действующих на затворы высокого давления
- •КОНСТРУКционНЫЕ МАТЕРИАЛЫ В ХИМИЧЕСКОМ МАШИНОСТРОЕНИИ
- •12.1. Виды конструкционных материалов
- •12.2. Коррозия металлов и сплавов
- •12.2.1. Виды коррозии
- •12.2.2. Виды коррозионных разрушений
- •12.2.3. Способы борьбы с коррозией
- •12.3. Влияние материала на конструкцию аппарата и способ его изготовления
- •12.3.1. Конструкционные особенности аппаратов из высоколегированных сталей
- •Рис. 12.1. Сварка встык:
- •Рис. 12.2. Способы подготовки кромок под сварку
- •Рис. 12.4. Способы сварки легированной и углеродистой стали
- •12.3.2. Конструктивные особенности эмалированных аппаратов
- •Рис. 12.5. Элементы конструкции эмалированных аппаратов
- •Рис 12.6. Пайка элементов медных аппаратов
- •12.3.3. Конструктивные особенности аппаратов из цветных металлов
- •Рис. 12.7. Основные типы паяных соединений
- •12.3.4. Конструктивные особенности аппаратов из пластмасс
- •ОФОРМЛЕНИЕ ОТДЕЛЬНЫХ ЭЛЕМЕНТОВ ХИМИЧЕСКОЙ АППАРАТУРЫ
- •13.1. Оформление поверхности теплообмена
- •Рис. 13.5. Реактор со змеевиковой рубашкой
- •Рис. 13.6. Рубашка с вмятинами
- •Рис. 13.8. Вывод змеевика через крышку аппарата:
- •13.2. Перемешивающие устройства
- •Рис. 13.12. Листовая мешалка
- •Рис. 13.13. Пропеллерные мешалки
- •Рис. 13.14. Турбинные мешалки открытого (а) и (б) закрытого типа
- •Рис. 13.15. Крепление мешалок к ступице:
- •13.3. Уплотнения вращающихся деталей
- •Рис. 13.18. Одинарное торцовое уплотнение:
- •ТРУБОПРОВОДЫ И ТРУБОПРОВОДНАЯ АРМАТУРА
- •Рис 14.5. Фасонные части трубопроводов
- •Рис. 14.7. Крепление горизонтальных и вертикальных трубопроводов на подвесках
- •Рис. 14.8. Компенсаторы:
- •ВСПОМОГАТЕЛЬНОЕ ОБОРУДОВАНИЕ ХИМИЧЕСКИХ ЗАВОДОВ
- •15.1. Виды вспомогательного оборудования
- •Рис. 15.1. Схема многостадийного диспергирования твердой фазы с контрольной классификацией продукта
- •15.2. Транспортные средства
- •15.2.1. Классификация транспортных средств для твердых материалов
- •15.2.2. Машины для транспортировки жидкостей и газов
- •ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ И ОБОРУДОВАНИЕ ДЛЯ ГРАНУЛИРОВАНИЯ ДИСПЕРСНЫХ МАТЕРИАЛОВ
- •16.1. Классификация методов гранулирования и особенности уплотнения гранул
- •Рис. 16.1. Тарельчатый гранулятор:
- •Рис. 16.2. Гранулятор барабанного типа конструкции НИИХиммаша
- •16.3. Основные закономерности и аппаратурное оформление метода экструзии
- •16.5. Гранулирование в псевдоожиженном слое
- •16.6. Технологические схемы процессов гранулирования дисперсных материалов
- •Рис. 16.11. Технологическая схема гранулирования шихты методом окатывания
- •Рис. 16.13. Схема уплотнения шихты в роторном грануляторе
- •Рис. 16.14. Схема гранулирования шихты методом экструзии
- •Рис. 16.15. Схема установки для компактирования шихты
- •ЛИТЕРАТУРА
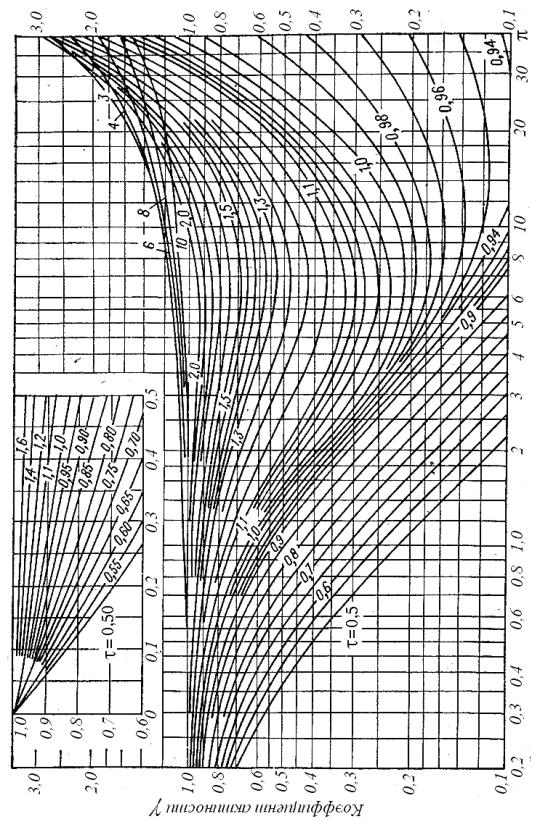
Т и р – действующие температура и давление; Ткр и ркр – критические температура и давление.
Рис. 1.1. Зависимость коэффициента активности газв от приведенных давления и температуры
173
Данные по коэффициенту активности табулированы и имеются в литературе (см. например [18]). Значения критических температур и давлений можно найти в литературе в специальных таблицах или рассчитать. Их расчет описан в [20, 28].
Изменение стандартной энергии Гиббса для жидкофазной реакции будет равно
Gж0 = Gг0 + RT ln (Х piν i ) ,
где рi – парциальное давление пара i-го компонента над жидкостью. Соотношения между константами равновесия в жидкой и газовой фазе
составляет
K |
n |
= K |
й |
Х |
pν i щ− 1 |
, |
|
|
p л |
i ы |
|
где Кn – константа равновесия, выраженная через молярные доли компонентов, при этом Kn = Х niν i (ni – молярная доля компонента).
Рассмотренный метод не пригоден для растворов сильно отклоняющихся от законов Генри и Рауля. К таким растворам относится большинство систем, представляющих практический интерес. В этом случае необходимо использовать константу равновесия, выраженную через коэффициенты активности ([28]).
7.2.2. Расчет состава равновесной смеси
Еще до расчета состава равновесной смеси можно определить направление химической реакции в зависимости от температуры, давления и состава исходной смеси на основании принципа Ле-Шателье. Этот принцип можно сформулировать одним из следующих способов: «если на систему, находящуюся в устойчивом равновесии, воздействовать извне изменением ка- ких-либо условий, то в системе усилится то направление процесса, течение которого ослабляет влиянии произведенного воздействия, и положение равновесия сместится в том же направлении».
При известных константе равновесия и начальном составе реакционной смеси (рi и С0i) можно рассчитать ее равновесный состав Ci* и pi* ; выходы хi
и равновесную степень превращения Х*. Также можно найти их зависимости от условий проведения процесса.
Если при газофазной реакции не меняется объем реакционной смеси, то просто следует заменить парциальные давления на равновесные степени превращения в виде
p*A = pA0 (1− X A ) .
ПРИМЕР 1.5. Для газофазной реакции СН3СООН + С2Н5ОН ↔ СН3СООС2Н5 + Н2О
А |
В |
R |
S |
174

Найти равновесную степень превращения и состав реакционной смеси, если Кр = 15 и реакция протекает при общем давлении 0,12 МПа.
РЕШЕНИЕ. При равновесии имеем
p*A = pA0 (1− X *A ); p*B = pA0 (1− X *A); p*R = pS* = pA0 ЧX *A .
Откуда
|
K p = |
|
p*R Ч pS* |
|
= |
|
|
(X *A )2 |
|
; |
||||
|
|
* |
* |
|
(1− |
* |
2 |
|||||||
|
|
|
pA Ч pB |
|
|
X A) |
|
|
||||||
15Ч[1− 2X *A + (X *A )2 ] = (X *A )2 ; |
|
|
|
|
|
14(X *A)2 − 30X *A + 15 = 0 ; |
||||||||
Полученное квадратное уравнение решается известным способом |
||||||||||||||
|
= 30 ± |
|
|
|
|
|
; |
|
||||||
X *A1,2 |
|
|
900 − 840 |
X *A = 0,795 . |
||||||||||
Откуда |
|
28 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p*A = 0,06(1− 0,795) = |
0,0123МПа; |
|
p*B = 0,06(1 − 0,795) = 0,0123 МПа; |
|||||||||||
p*R = |
p*S = |
0,06 Ч0,795 = 0,0477МПа. |
||||||||||||
При избытке одного из реагентов используют их мольное соотношение |
||||||||||||||
|
|
|
|
β |
= |
|
|
pi0 |
. |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
pA0 |
|
|
|
||||
ПРИМЕР 1.6. Рассчитать состав равновесной смеси реакции предыдущего примера, если реагент В взят с двукратным молярным избытком.
РЕШЕНИЕ. Рассмотрим молярные соотношения реагента В
p*B = pA0 (2 − X *A) .
Тогда
K p = |
p*R Ч p*S |
|
(X *A)2 |
|
|
* |
2 |
* |
|
|
|||
|
= |
|
|
|
|
|
; 14(X A ) |
|
− 45X A |
+ 30 |
= 0 ; |
||
* * |
|
* |
|
|
* |
|
|||||||
|
pA Ч pB |
|
(1− X A)(2 − |
X A) |
|
|
|
|
|
|
|||
|
|
|
45 ± |
|
; X *A = 0,944 . |
|
|
||||||
|
X *A1,2 |
= |
2025 − 1680 |
|
|
||||||||
Отсюда |
|
|
|
28 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p*A = 0,04(1− 0,944) = |
0,00224МПа; |
p*B = 0,04(2 −0,944) = 0,042 2МПа; |
|||||||||||
p*R = p*S = 0,04 Ч0,944 = 0,0378МПа.
Таким образом видно, что для реакций при постоянном объеме при не меняющемся числе молей степень превращения не зависит от начального давления, а при избытке одного из реагентов процесс сдвигается вправо, в соответствии с правилом Ле-Шателье.
Если объем реакционной смеси при газофазных реакциях изменяется, то несколько изменяется и расчет. Его проводят с помощью коэффициента
175

изменения объема ε, выражая через него pA0, p*A, X *A, β (см. стр. 61 и 62).
В термодинамике часто пользуются парциальными молярными балансами, составленными на моль ключевого компонента.
При разбавлении реакционной смеси инертными компонентами в парциальный молярный баланс следует ввести слагаемое
β ин = Nин .
NA0
ПРИМЕР 1.7. Реакция С6Н6 + 3Н2 = С6Н12
АВ R
проводится при общем давлении р и молярном соотношении бензола и водорода в исходной смеси β. Рассчитать равновесную степень превращения бен-
зола X *A , если Кр=13800 МПа–3: β=3 и β=10; р=0,1 и р=2 МПа.
РЕШЕНИЕ. Составить парциальный молярный баланс и определить равновесное парциальное давление реагента А
|
|
|
|
|
|
NA |
= 1− X *A; |
|
|
NB |
= β − 3X *A; |
|
NC |
= X *A; |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
NA0 |
|
|
NA0 |
|
NA0 |
|
||||||||||
|
|
|
|
|
|
|
|
е |
Ni |
= 1+ β − 3X *A . |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
NA0 |
|
|
|
|
|
|
|
||||||
Откуда |
p* |
= |
|
|
1− X *A |
p; p* |
= |
|
β − 3X *A |
p; p* |
= |
|
|
X *A |
p |
. |
||||||
|
|
|
|
|
|
|
||||||||||||||||
A |
|
1 |
|
|
|
B |
|
|
|
|
|
|
C |
|
|
1+ β − X *A |
||||||
|
|
|
+ β − X *A |
|
|
1+ β − X *A |
|
|
|
|||||||||||||
Константа равновесия выразится уравнением
p*
K p = * C* 3 =
pA( pC )
X * (1+ β − X * )3
A A .
(1− X *A)(β − 3X *A)3 p3
Уравнение можно свести к одному уравнению с одним неизвестным
|
|
K p (1− |
X *A)(β − 3X *A)3 p3 |
|||||||
|
1− |
|
|
|
|
|
|
|
= 0. |
|
|
X |
*A(1+ β − X |
*A)3 |
|
||||||
|
|
|
|
|
|
|||||
Это уравнение четвертой степени можно решить приближенными мето- |
||||||||||
дами. Из всех четырех корней условию |
|
0 Ј X *A Ј 1 удовлетворяет только |
||||||||
один. Выведем все действительные решения в таблицу. |
||||||||||
|
|
|
|
|
|
|
|
|
Таблица 1.2 |
|
|
р, МПа |
|
|
β |
|
|
X *A |
|
||
|
0,1 |
|
|
3 |
|
|
0,318 |
|
||
|
|
|
10 |
|
|
0,903 |
|
|||
|
|
|
|
|
|
|
|
|||
|
1,0 |
|
|
3 |
|
|
0,850 |
|
||
|
|
|
10 |
|
|
0,999 |
|
|||
|
|
|
|
|
|
|
|
|||
176
