
Минералогия_2 / Бетехтин / betehtin_2
.pdf
576 |
Описательная часть |
Практическое значение. Массивные породы, сплошь состоящие из родонита, употребляются в качестве поделочного камня для изготовле ния ваз, письменных приборов, облицовки колонн и т. д. В частности, он был использован при отделке станции «Маяковская» московского мет рополитена.
4. Силикаты с разветвленными цепочками кремнекислородных тетраэдров
Группа астрофиллита
Описывается только астрофиллит, в структуре которого имеется раз ветвленная цепочка кремнекислородных тетраэдров (рис. 323г).
АСТРОФИЛЛИТ — (К, Na)3(Fe··, Mn)7Ti2Si8O24[OH, F]7 Соотноше ние между Mn и Fe колеблется в широких пределах. Содержит также ZrO2, BaO, MgO, Al2O3 и Nb2O5.
Сингония триклинная. Структура (см. выше: рис. 323, а также общее описание семейства лампрофиллита—сейдозерита). Похож на лампро филлит. Кристаллы редки и несовершенны. Характерен пластинчатый или игольчатый по оси b облик (рис. 325). Распространен в пластинча тых, иногда в эффектных звездчатых агрегатах.
Рис. 325. Кристаллы астрофиллита
Цвет бронзово бурый, золотисто желтый, оранжевый. Блеск стеклян ный с перламутровым отливом на плоскостях спайности. Ng = 1,733, Nm = 1,703 и Np = 1,678.
Твердость 3—3,5. Хрупок. Спайность совершенная по {100} и несо вершенная по {001}. По спайности легко выбиваются ломкие тонкие пла стинки Уд. вес 3,28—3,30.
П. п. тр. легко сплавляется в черный магнитный (в отличие от ламп рофиллита) шарик. В закрытой трубке выделяет немного воды. В HCl и H2SO4 разлагается.
Происхождение и месторождения. Встречается в щелочных интру зивных изверженных породах (нефелиновых сиенитах и др.) в ассоциа ции с эгирином, черной слюдой, полевыми шпатами, цирконом, сфеном
Раздел V. Кислородные соли (оксисоли) |
577 |
и др. в Хибинском массиве (Кольский полуостров). Известен в кварце вых ядрах пегматитов сиенито гнейсов в Кейвах (Кольский полуостров), в Инаглинском щелочно ультраосновном массиве (Южная Якутия) и в Бурпале (Забайкалье). Впервые установлен на островах в Лангезундфи орде (Норвегия) в цирконовом сиените.
Широко распространен в пегматитах щелочных изверженных пород, иногда в виде крупных пластинчатых выделений или спутанно пластин чатых агрегатов, часто в виде игольчатых индивидов. Наблюдаются так же радиально лучистые скопления — «солнца».
Подкласс Г. Силикаты с непрерывными слоями тетраэдров SiO4 в кристаллических структурах
Здесь мы рассмотрим слюдоподобные силикаты, характеризующиеся слоистыми кристаллическими структурами с гексагональным мотивом,
атакже родственные им минералы с дополнительными радикалами, об ладающие субслоистыми структурами и дающие также кристаллы псев догексагонального облика.
Характерной химической особенностью слюдоподобных минералов является то, что в их составе, так же как и в группе амфиболов, всегда принимает участие гидроксил ОН, нередко вместе с F. Из катионов, кото рые вместе с гидроксильными группами непосредственно связаны со сло ями кремнекислородных тетраэдров, обычно распространены Mg2+ и Al3+,
ав качестве их заместителей — Fe2+, Ni2+, (Mn2+), Li1+ и, соответственно, Fe3+, реже Cr3+, V3+. Кроме того, во многие минералы, в структуре кото
рых тетраэдры SiO4 частично заменены AlО4, входят дополнительные крупные катионы: К1+, Na1+, Са2+, а также молекулы воды (все они, как будет показано ниже, в виде связующих элементов располагаются между слоистыми пакетами, составленными кремнекислородными слоями и ионами, непосредственно с ними связанными).
Физические свойства слюдообразных минералов, естественно, на ходятся в теснейшей зависимости от особенностей кристаллической структуры. Строение плоских сеток прежде всего сказывается на обли ке кристаллов, обладающих симметрией, очень близкой к гексагональ ной, на оптических свойствах, близких к одноосным, на так называемых фигурах удара и давления на спайных пластинках. Слоистое строение кристаллической структуры обусловливает замечательное свойство этих минералов расщепляться на тонкие листочки. Степень упругости этих листочков для разных групп минералов неодинакова, что связано с хи мическим их составом, находящим свое отражение на деталях строе ния кристаллических структур. На этом вопросе необходимо остано виться подробнее. Обратимся к кристаллической структуре талька
Mg3[Si4O10][OH]2.

578 |
Описательная часть |
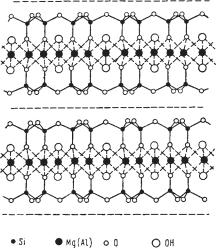
Рис. 326. Гексагональная сетка связанных групп SiO4, образующих непрерывный слой (А). Внизу (Б) показан вид структуры сбоку, состоящий из двух слоев групп SiO4 и заклю ченного между ними одного слоя Mg(OH)2. Характерно, что вершинки тетраэдров SiO4 в обоих слоях обращены навстречу друг другу
Рис. 327. Гексагональное кольцо тетраэдров SiO4 в плане. Вершинки тетраэдров с активны ми кислородными ионами обращены к наблю дателю. Черные шарики — ионы Si4+ (в окру жении четырех ионов кислорода)
Формула слоя кремнекисло родных тетраэдров для всех слюдоподобных минералов, как мы знаем, выражается радика лом [Si2O5]?, причем активные концы всех тетраэдров (рис. 326) обращены в одну и ту же сторону. Два таких гексагональ носетчатых слоя, активными сторонами обращенных друг к другу, сцеплены в один плоский пакет с помощью «бруситового» слоя из Mg[OH]2, располага ющегося между ними (рис. 327) и нейтрализующего общий от рицательный заряд двух слоев [Si2O5]2–. Положительный заряд «бруситового» слоя достигается тем, что при вхождении в струк туры он как бы теряет часть гид роксилов (их места занимаются активными ионами кислорода радикалов [Si2O5]. Образование такого плоского пакета можно изобразить в виде следующего уравнения:
[Si4O10] – 3Mg[OH]2 – 4[OH] = = Mg3[Si4O10][OH]2 (тальк).
Бруситовый слой может быть заменен гиббситовым слоем — Al[ОН]3. Тогда аналогично будем иметь:
[Si4010] + 2Al[OH]3 – 4[OH] = = Al2[Si4O10] [OH]2 (пирофил лит).
Отметим, однако, сравнивая формулы брусита Mg[OH]2 и гиббсита Al[ОН]3, что для со хранения общего числа атомов кислорода, в случае пирофил лита каждый третий октаэдр
Раздел V. Кислородные соли (оксисоли) |
579 |
слоя должен пустовать, тогда как в тальке заполнены все октаэдрические полости бруситового слоя. В связи со степенью заполнения октаэдриче ских пустот по образцу бруситового или гиббситового слоя различаются, соответственно триоктаэдрические и диоктаэдрические структуры сло истых силикатов.
Как в структуре талька, так и в структуре пирофиллита эти пакеты об ладают очень прочной внутренней связью, почти полностью компенсиро ванной. Поэтому такие пакеты связаны между собой остаточными очень слабыми вандерваальсовскими силами (на наружных плоских сторонах пакетов кислородные ионы в каждом тетраэдре SiO4 связаны с двумя иона ми Si и, следовательно, не остается активной валентной связи для прочно го сочленения пакетов между собой). Этим объясняется очень низкая твер дость талька и пирофиллита, их необычайно легкая расщепляемость на эластичные пластинки и, наконец, отсутствие упругости в последних.
В тех минералах, в которых часть ионов Si4+ заменяется ионами Al3+ (в той же четверной координации), наблюдается уже существенное из менение свойств. Замена одного иона Si4+ на ион Al3+, так же как и в ам фиболах, приводит к увеличению отрицательного заряда в анионном ра дикале на единицу. Это означает, что наружные плоские стенки пакета становятся активными. Для нейтрализации этого приобретенного заря да в пространство между пакетами входят одновалентные крупные кати оны К1+, могущие располагаться лишь в больших «пустотах» против цент ров гексагональных, вернее, дитригональных (по Н. В. Белову) колец в кремнекислородных слоях в шестерной, а не в двенадцатеричной коор динации, как это считали ранее. В итоге получаем относительно прочно связанные между собой пакеты. Отсюда, как следствие, твердость таких минералов (типичных слюд) значительно выше, чем талька: отщепляемые тонкие листочки обладают упругостью, т. е. способностью при изгибании возвращаться в прежнее положение.
Если в анионном радикале Si4O10 два иона Si4+ заменены двумя иона ми Al3+, то отрицательный заряд в нем возрастает до 2. В этом случае он может быть компенсирован уже двухвалентными катионами, например Са2+, ионы которого (меньшие по размерам) располагаются в иных мес тах, нежели ионы К. Это обстоятельство, т. е. увеличение прочности связи между пакетами, более существенно изменяет свойства слюдообразных минералов: твердость возрастает, расщепляемость затруднена, отщепля емые пластинки ломки, почему и было дано этой группе минералов на звание хрупких слюд.
Для минералов рассматриваемого подкласса особый интерес представ ляет также вопрос об изоморфных замещениях. Кроме обычных изова лентных замещений ионов Mg2+ ионами Fe2+, Ni2+ и др., а также ионов Al3+ ионами Fe3+, Cr3+ и др., широко распространен способ замещения ионами иной валентности, но в таких количествах, чтобы общий заряд оставался
580 |
Описательная часть |
одним и тем же. Например, 3Mg2+ могут заменяться 2Al3+. Однако по сути дела такая замена должна происходить «скачкообразно» (Mg12—Mg9Al2— Mg6Al4—Mg3Al6—Al8), хотя практически по химическим анализам эти скачкообразные изменения улавливать не удается. Следует заметить, что подобная замена ионов имеет место в брусито гиббситовых слоях паке тов, в которых при замене трех ионов Mg2+ двумя ионами Al3+ одно место остается незанятым. Физические свойства, за исключением оптических и удельного веса, при этом не меняются. Этого рода изменение в хими ческом составе относящихся сюда минералов является одним из важных признаков, на которых основывается классификация их.
В некоторых слюдообразных минералах между слоистыми пакетами, обладающими слабой остаточной связью, как увидим, располагаются бру ситовые или гиббситовые пакеты (в хлоритах), а иногда слои молекул Н2О (в гидрослюдах и им подобных образованиях). Как и во всех других водных минералах, молекулы Н2О по кристаллохимическим соображе ниям должны располагаться в этих слоях строго ориентированно.
1. Группа талька–пирофиллита
Эта группа представлена двумя весьма характерными по физическим свойствам минералами. Как уже было указано во введении к слюдоподоб ным минералам, кристаллические структуры этих минералов чрезвычай но близки одна к другой (рис. 328). Различие заключается лишь в том, что в структуре триоктаэдрического таль ка катионы Mg2+ заполняют все шес тикоординационные места между дву мя гексагональносетчатыми слоями [Si4O10], а в структуре диоктаэдриче ского пирофиллита катионы Al3+ зани мают только две трети этих мест. В ре же встречающихся промежуточных по составу разностях (например, в пи рофиллите примерно с 30 % молекул талька), по видимому, имеет место пе риодическое внедрение магнезиаль ных или глиноземистых пакетов в за висимости от общего состава, т. е.
такие минералы являются смешанно
слойными образованиями.
Рис. 328. Кристаллическая структура талька (или пирофиллита) В противоположность многим дру
гим группам минералов данного под класса, изоморфное замещение Mg2+ на Fe2+ и Ni2+, а также Al3+ на Fe3+ в ряду тальк—пирофиллит устанавливалось пока в узких пределах. Близость многих физических свойств этих минералов настолько велика, что по вне шним признакам часто пирофиллит принимают за тальк и наоборот.
Раздел V. Кислородные соли (оксисоли) |
581 |
ТАЛЬК — Mg3[Si4O10][OH]2, или 3MgO . 4SiO2 . H2O. Старинное араб ское название минерала.
Химический состав. MgO — 31,7 %, SiO2 — 63,5 %, Н2О — 4,8 %. Обыч но часть MgO бывает замещена FeO (до 2–5 %). Кроме того, довольно часто присутствует Al2О3 (до 2 %), изредка в небольших количествах (до десятых долей процента) NiO.
Сингония моноклинная. Пр. гр. C2/c(C62h) или Cc(С4S). а0 = 5,26; b0 = 9,10; с0 = 18,81; β = 100°00′. Очень редко наблюдается в таблитчатых кристаллах гексагонального и ромбического облика, непригодных, одна ко, для измерения. Агрегаты. Весьма характерны листоватые, чешуйча тые, часто плотные массы, называемые жировиком, стеатитом, мыльным или горшочным камнем.
Цвет талька бледно зеленый (для крупнолистовых масс) или белый с желтоватым, буроватым, зеленоватым, иногда интенсивным оттенком. Тонкие листочки прозрачны или просвечивают. Блеск стеклянный с пер ламутровым отливом. Ng = 1,575–1,590 и Np = 1,538–1,545.
Твердость около 1. Жирен на ощупь. Листочки гибки, но не упруги. Спайность весьма совершенная по {001}. Спайные листочки дают шести лучевую фигуру удара и часто обнаруживают направления спайности, параллельные линиям удара. Вследствие этого нередко раскалывается на ромбические или гексагональные кусочки. Уд. вес 2,7–2,8. Прочие свой8 ства. Плохой проводник тепла и электричества. Огнеупорен. Тальковый камень не плавится до температуры 1300–1400 °С.
Диагностические признаки. Легко узнается по низкой твердости, жирному ощущению в руках, светлой окраске и совершенной спайности листоватых разностей. Однако от пирофиллита, особенно в тонкокрис таллических массах, отличим лишь по химическим реакциям.
П. п. тр. белеет, расщепляется и с трудом оплавляется по краям в бе лую эмаль. Будучи сильно прокален, приобретает значительную твердость (около 6). В кислотах нерастворим даже при нагревании. С раствором азотнокислого кобальта после прокаливания становится бледно розовым (отличие от пирофиллита).
Происхождение и месторождения. Тальк чаще всего встречается как продукт гидротермального изменения богатых магнезией ультраосновных пород. В этих случаях он, как правило, ассоциирует с остаточными зер нами хромшпинелидов и с новообразованиями карбонатов магния (брей неритом (Fe магнезитом), магнезитом), иногда кальция. Очень характер ны в качестве новообразований также метакристаллы гематита или магнетита, изредка апатита. Судя по парагенезису минералов, образова ние талька за счет силикатов магния происходит с помощью гидротерм, содержащих углекислоту, по следующей схеме реакции:
4(Mg,Fe)2SiO4 + Н2O + 3СО2 → Mg3[Si4O10][ОН]2 + 3MgCO3 + Fe2O3.
оливин |
тальк |
магнезит гематит |
582 |
Описательная часть |
Присутствие гематита указывает на окислительную обстановку реак ции. В восстановительной среде образуются магнетит и брейнерит и сам тальк содержит некоторое количество FeO.
Примером может являться Шабровское месторождение талькового камня (в 25 км к югу от Екатеринбурга), известное еще с 20 х гг. XIX столетия. Оно образовалось в связи с воздействием на серпентиниты гидротерм, богатых CO2 и генетически связанных с более молодыми гра нитными интрузиями. В результате этого воздействия возникли самые разнообразные по составу породы: талько хлоритовые, нередко с крис таллами турмалина, иногда магнетита, и зернами эпидота, апатита и дру гих минералов; пироксено гранато эпидотовые, образовавшиеся вслед ствие привноса вместе с летучими компонентами кремнезема; талько карбонатные с гематитом и магнетитом; талько хлорито акти нолитовые породы и пр. Крупнопластинчатый тальк встречается в виде прожилков и жил, располагающихся вкрест простирания среди тальк содержащих пород.
Месторождения талька связаны и с контактово метасоматическими процессами. Они образуются в гидротермальную стадию на границе до ломитов с интрузивными породами. В этих случаях тальк встречается в виде линзообразных тел и отличается чистотой и высокосортностью. Образование его происходит, очевидно, по следующей схеме:
3CaMg[CO3]2 + 4SiO2 + H2O → Mg3[Si4O10][ОН]2 + 3СаСО3 + 3СО2. доломит тальк кальцит
Крупные месторождения, связанные с карбонатными породами, из вестны в Канаде в Мэдокском округе. Линзообразные тальковые залежи состоят из листоватого талька снежно белого, светло серого и коричне вого цвета с примесью карбонатов (кальцита и доломита), тремолита и других минералов.
Практическое значение. Тальк широко используется в промышлен ности. Он находит применение главным образом в молотом виде (таль ковый порошок) и отчасти в форме кускового талька.
Тонкоразмолотый тальк широко используется в бумажной, а также
врезиновой промышленности в качестве наполнителя для увеличения объема данного материала без существенного изменения его полезных свойств. Высшие безжелезистые сорта применяются в парфюмерии (при изготовлении пудры, мазей, пасты). В красочной промышленности упот ребляется для изготовления огнезащитных и светоупорных красок и мяг ких карандашей для стекла, материй, металла. В текстильной промыш ленности используются адсорбционные свойства талькового порошка,
всвязи с чем он применяется для беления хлопка, вывода жирных пя
Раздел V. Кислородные соли (оксисоли) |
583 |
тен и для других целей. В керамической промышленности тальковый порошок применяется для изготовления высоковольтных электроизо ляторов, глазурей, кислото и щелочеупорных сосудов, водосточных труб и т. д.
Тальковый камень, обычно содержащий примеси других минералов (главным образом карбонатов и хлоритов), применяется в виде кирпи чей, плит и пр. Особенно отличаются огнеупорными свойствами талько вые камни, богатые примесью магнезита. Применяются они для футеров ки металлургических печей, топок паровозов и др. Наконец, из молотых тальковых камней с помощью флотационного обогащения можно полу чить чистый тальковый продукт.
ПИРОФИЛЛИТ —Al2[Si4O10][ОН]2, или Al2О3 . 4SiO2 . Н2О. От греч. пирос — огонь, филлон — лист. Название дано вследствие способности этого минерала расщепляться на тонкие листочки перед паяльной труб кой. Впервые как минеральный вид был установлен Р. Германом (1829 г.) в Березовском золоторудном месторождении (Урал).
Химический состав. Al2О3 — 28,3 %, SiO2 — 66,7 %, Н2О — 5,0 %. Содер жание отдельных компонентов колеблется в довольно широких пределах.
Ввиде примесей устанавливаются: MgO (до 9 % и, вероятно, выше), FeO
(до 5 %), Fe2O8, в ничтожных количествах CaO, щелочи и окись титана. Сингония моноклинная. Пр. гр. C2/c(C62h) или Cc(C4S). а0 = 5,14;
b0 = 8,90; с0 = 18,55; β = 99°55′. Кристаллы, пригодные для измерения, не встречаются. Обычно распространен в виде пластинчато лучистых агре гатов или скрыточешуйчатой плотной породы, носящей название агаль матолита, или пагодита (от греч. агальма — статуя, пагода — буддийский идол и храм). Из этого камня выделывались фигуры китайских божков.
Цвет пирофиллита белый с желтоватым оттенком или бледно зеле ный; нередко полупрозрачный. Блеск стеклянный с перламутровым от ливом для пластинчатых агрегатов. Ng = 1,600, Nm = 1,588 и Np = 1,552.
Твердость около 1. Жирный на ощупь. Тонкие листочки гибки, уп ругостью не обладают. Спайность совершенная по {001}. Уд. вес 2,66– 2,90.
Диагностические признаки. Характерны очень низкая твердость, свет лая окраска, перламутровый или мерцающий блеск. От талька без хими ческих анализов или реакции с азотнокислым кобальтом неотличим. Весь ма вероятно, что во многих случаях ошибочно принимается за тальк. Известны случаи, когда пирофиллитовые месторождения вначале раз ведывались как тальковые.
П.п. тр не плавится. Расщепляется на тончайшие листочки и обраща ется в снежно белую массу. При прокаливании в закрытой трубке выде ляет воду при высокой температуре и принимает серебристый отлив.
Вкислотах не разлагается. С раствором Co[NO3]2 после прокаливания принимает синий цвет (присутствие Al).
584 |
Описательная часть |
Происхождение и месторождения. Встречается в некоторых гидро термальных жильных месторождениях как низкотемпературный мине рал в ассоциации с кварцем, карбонатами, гематитом и другими минера лами, образовавшимися в результате гидротермального разложения обычно кислых изверженных пород.
Распространен также в некоторых богатых глиноземом метаморфи ческих сланцах, иногда в весьма значительных массах. Известен также в виде псевдоморфоз по андалузиту, кианиту, мусковиту и другим силика там алюминия и алюмосиликатам, образующимся, по видимому, в про цессе наложения гидротермальной деятельности.
Замечательные по бледно зеленой окраске и перламутровому блеску звездчатые и пластинчато лучистые агрегаты пирофиллита встречаются в кварцевых жилах среди пирофиллито карбонатных пород в районе меж ду Березовским и Пышминским месторождениями на Урале (близ Екате ринбурга). Пирофиллит здесь наблюдается в виде оторочек на стенках жил, выполненных в середине кварцем. В мелколистоватых и плотных массах встречен также около г. Миасса (Ю. Урал). Агальматолит извес тен в Сары Хая (Тува).
Крупные месторождения агальматолита известны в Китае. В виде пирофиллитового сланца в значительных массах распространен в шта тах Арканзас, Джорджия и Северная Каролина (США). В Бразилии, близ Оуро Прето (Минас Жерайс), встречен в форме листоватых агрегатов в ассоциации с топазом. Вообще нужно сказать, что пирофиллит пользует ся широким распространением.
Практическое значение. В случаях скоплений в виде сплошных, зна чительных по размерам масс имеет несомненный промышленный инте рес. Свойства пирофиллита таковы, что он может быть широко исполь зован в бумажной, керамической, строительной (в качестве огнеупорного камня), электротехнической (для изоляторов), резиновой (в качестве наполнителя) и других отраслях промышленности. Подробнее о приме нении было сказано выше (см. тальк). В древние времена в Китае плот ные разности его, известные под названием «китайского агальматолита», употреблялись для изготовления различных безделушек, статуэток, гри фельных карандашей и пр.
2. Группа слюд
Слюды принадлежат к числу широко распространенных в природе минералов. Нередко они являются породообразующими минералами. Общее количество их в земной коре достигает примерно 3,8 %, причем в главной массе они встречаются в кислых интрузивных породах и крис таллических слюдяных сланцах.
В структурном отношении слюды подобны тальку и пирофиллиту, однако слюдяные пакеты, образованные бруситовым или гиббситовым

Раздел V. Кислородные соли (оксисоли) |
585 |
слоем с покрывающими его кремнекислородными тетраэдрическими сет ками, не являются электрически нейтральными. Это позволяет прини мать в межслоевое пространство крупные катионы, которые служат уси лению связи между несущими отрицательный заряд пакетами. Так как в основе слюдяных пакетов могут лежать как бруситовые, так и гиббсито вые слои, то по этому признаку слюды делятся соответственно на три и диоктаэдрические.
Химический состав минералов группы слюд необычайно изменчив. Весьма широко распространены явления замены одних катионов дру гими. С химической точки зрения, эти минералы представляют особую группу алюмосиликатов. Типические их составы могут быть выражены
вследующем виде: R+R32+[AlSi3О10][ОН]2 или R+R23+[AlSi3О10][ОН]2, где R+ = К; R3+= Al, часто Fe3+, Mn3+, изредка Cr3+, V3+, в некоторых случаях Ti4+; R·· = Mg, часто Fe2+, Mn2+, а также Li1+ 1 и др. Ион Na1+ в составе слюд редко принимает участие в существенных количествах, а Са2+ и Ва2+ обыч но отсутствуют. Гидроксил может замещаться F (главным образом в маг ниевых и литиевых слюдах).
Таким образом, в слюдах устанавливаются широкие изоморфные сме си, в которых, с одной стороны, как обычно, Mg2+ заменяется Fe2+, Al3+— Fe3+, а с другой, — несомненно, существуют гетеровалентные изоморф ные замещения Mg2+(Fe2+)—Al(Fe3+) и др.
Большинство минеральных видов группы слюд кристаллизуется
вмоноклинной сингонии, причем формы кристаллов близки к гексаго нальным благодаря строению тетраэдрических и октаэдрических сеток структуры. Кристаллические структуры являются типичными слоисты ми, что приводит к существованию многочисленных политипов.
Различия между политипами являются весьма тонкими. Суть поли типии в слюдах сводится к следующим моментам. Между положениями иона гидроксила с нижней и верхней сторон бруситовых или гиббсито вых октаэдрических слоев всегда существует сдвиг (см. рис. 326, внизу),
вто время как такие же гидроксилы на встречных сторонах двух октаэд рических слоев из смежных пакетов, разделенных двумя кремнекисло родными сетками и межслоевым катионом, находятся непосредственно один над другим (рис. 328). Симметрия в результате сдвига понижается настолько, что в плоскости слоя приходится выбирать так называемую ортогексагональную ячейку с прямым углом между горизонтальными ребрами, как это сделано на рис. 326, вверху. При переходе от одного окра эдрического слоя к следующему, из верхней пачки, вся конфигурация ока жется сдвинутой в горизонтальной плоскости на третью часть вектора ячей ки a (см. рис. 326), т. е. кратчайшего расстояния между центрами колец
1 Замещение магния литием идет с одновременным вхождением алюминия по схе
ме: 3Mg2+ → Li 1+1,5 Al 3+1,5.
