
Минералогия_2 / Бетехтин / betehtin_2
.pdf476 |
Описательная часть |
при нагревании, так из многих минеральных видов этой группы образу ются метаформы, которым соответствуют и названия с приставкой «мета». В соответствии с этим меняются и некоторые физические свойства этих минералов, особенно удельный вес и показатели преломления. Структу ра урановых слюдок изменяется с потерей или приобретением молекул воды, поэтому воду здесь нельзя считать цеолитной.
Структурное разнообразие урановых слюдок связано в первую оче редь с различиями в характере контакта межслоевых катионов с кисло родом уранила, а это зависит от типа катиона. Степень гидратации также влияет на структуру, гидратированные формы позволяют слоям, облада ющим сами по себе тетрагональной симметрией, находиться точно друг над другом, что приводит к высокосимметричным формам. Дегидрата ция приводит к сдвигу слоев, что вызывает понижение симметрии и по рождает политипию с учетом разнообразных взаимных сдвигов слоев.
Изоморфные замещения происходят главным образом не путем на полнения межслоевого пространства различными катионами, а путем синтаксии (срастания) пакетов с различным межслоевым наполнением, что ведет к дополнительному структурному разнообразию.
Все относящиеся сюда минеральные виды обладают яркой желтой или зеленой окраской, перламутровым отливом по спайности, сравнительно низкой твердостью, легкой растворимостью в кислотах и сильной радио активностью. Эти соединения легко получаются искусственным путем из холодных растворов соответствующего состава и при соответствующей концентрации. По кристаллической структуре несколько особняком стоят ванадаты, так как здесь налицо, при общем сходстве структурного плана, присутствие сдвоенных тетраэдров с ванадием, однако по облику и свой ствам ванадаты уранила и урановые слюдки достаточно близки, чтобы рассматривать их совместно.
Наконец, почти все они встречаются в одинаковых условиях, являясь продуктами зон окисления урановых месторождений. Существенные скопления этих минералов имеют практическое значение как источник урана, радия, иногда ванадия.
ТОРБЕРНИТ — Cu[UO2]2[РО4]2 . 12Н2О. Назван в честь шведского хи мика Торберна Бергмана (1735–1784), впервые обнаружившего этот минерал.
Химический состав. Согласно имеющемуся анализу: CuO — 7,73 %, UO3 — 57,50 %, P2O5 — 14,50 %, Н2О — 20,30 %. Довольно точно совпадает с теоретическим составом. При 45 °С удаляются четыре частицы воды, образуется метаторбернит.
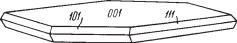
Сингония тетрагональная; дитетрагонально дипирамидальный в. с. L44L25PC. Пр. гр. I4/mmm (D174h). а0 = 7,06; с0 = 20,5. У метаторбернита Cu[UO2]2[РО4]2 . 8Н2О пр. гр. P4/n, параметр с0 снижается до 17, 31. Об8 лик кристаллов. Кристаллы мелкие, хорошо образованы и обладают таб литчатым обликом (рис. 265). Встречается обычно в виде чешуйчатых

Раздел V. Кислородные соли (оксисоли) |
477 |
|
скоплений и порошковатых налетов. Таблитчатые |
|
|
кристаллы по {001} обладают квадратными очерта |
|
|
ниями. Наблюдались случаи закономерного срас |
|
|
тания с отэнитом, цейнеритом и др. урановыми |
Рис. 265. Кристалл |
|
слюдками. |
||
торбернита |
||
Цвет торбернита изумрудно зеленый до желто |
|
вато зеленого. Черта светлее цвета. Блеск стеклянный сильный, на плос костях спайности перламутровый. В тонких листочках просвечивает. Nm = = 1,590–1,592 и Np = l,576–1,582.
Твердость 2–2,5. Спайность по {001} совершенная. Листочки гибки, но не упруги. Уд. вес 2,3–3,6. Сильно радиоактивный.
Диагностические признаки. Характерны совершенная спайность (как у слюд) и ярко зеленый цвет. От других зеленых минералов торбернит можно отличить с помощью измерения оптических констант и химиче ских реакций.
П. п. тр. сплавляется в черный шарик. С содой в восстановительном пла мени получается королек меди. Растворяется в HNO3; при прибавлении ам миака раствор становится синим (медь), причем выпадает желтый осадок.
Происхождение и месторождения. Образуется в зонах окисления пегматитов и гидротермальных урансодержащих, а также осадочных и прочих месторождений. Наблюдается обычно в небольших количествах на стенках трещин и пустот от выщелачивания, часто на лимоните, иног да в ассоциации с отэнитом и другими вторичными урансодержащими минералами. Впервые найден в зоне окисления гидротермального уран полиметаллического месторождения Яхимов (Чехия). Обнаружен также
вруднике Редрут (Корнуолл, Англия) и в Казоло (пров. Шаба, Демокра тическая Республика Конго). В России единичные находки отмечены
вДжиде (Бурятия) и на Шерловой Горе (Восточное Забайкалье).
Торбернит принадлежит к числу сравнительно широко распростра ненных минералов.
ОТЕНИТ — Ca[UO2]2[РО4]2 . 8Н2О. Синонимы: отунит. Назван по местности во Франции.
Химический состав. CaO — 6,1 %, UO3 — 62,7 %, Р2О5 — 15,5 %, Н2О — 15,7 %. Иногда присутствуют примеси: BaO, MgO, Fe2O3 и др. (обычно в очень незначительных количествах). В отените были установлены также актиний и полоний.
Сингония тетрагональная; дитетрагонально дипирамидальный в. с. L4L25PC. Пр. гр. I4/mmm (D174h). а0 = 7,00; с0 = 20,67. Облик кристаллов. Крис таллы тонкотаблитчатые (рис. 266), слюдоподоб
ные, квадратной формы. По углам между гранями Рис. 266. Кристалл
близок к торберниту. Наблюдаются друзы мелких |
отенита |
|
|
кристалликов или чешуйчатые агрегаты. |
|
478 |
Описательная часть |
Цвет отенита зеленый, зеленовато желтый, серно желтый. Блеск на плоскостях спайности перламутровый. Ng = 1,594, Nm = 1,590 и Np = 1,571.
Твердость 2–2,5. Хрупок. Спайность по {001} весьма совершенная, наблюдается также по {100} и {010} менее совершенная. Уд. вес 3,05–3,19. Сильно радиоактивен. Обнаруживает люминесценцию. В ультрафиоле товых лучах светится желто зеленым цветом.
Диагностические признаки. От других похожих по цвету урановых слюдок с уверенностью можно отличить с помощью спектрального и хи мического анализов.
П. п. тр. слегка вспучивается и сплавляется в черный шарик. Пламя окрашивает в оранжево красный цвет (Са). В закрытой трубке выделяет много воды. С бурой дает реакцию на уран. В HNO3 растворяется, раствор окрашивается в зеленый цвет.
Происхождение и месторождения. Как и все урановые слюдки, об разуется в зонах окисления урановых месторождений, содержащих ура новые минералы.
Месторождения, в которых встречается отенит, довольно многочис ленны: Отён, Центральный массив, в департаменте Луара (Франция), Шнееберг в Саксонии (Германия), Яхимов и Циновец (бывш. Цин нвальд) в Чехии, Редрут в Корнуолле (Англия), пегматиты Мадагас кара и др.
ТЮЯМУНИТ — Ca[UO2]2[V2O8] . 8H2O. Установлен К. А. Ненадке вичем в месторождении Тюя Муюн (Фергана, Узбекистан).
Химический состав. CaO — 5,87 %, UO3 — 59,96 %, V2O5 — 19,06 %, Н2О — 15,11 %. В виде примесей в незначительных количествах присут ствуют: Na2O, K2O, MgO, CuO (иногда до 4 %), SiO2 и др.
Сингония ромбическая; ромбо дипирамидальный в. с. 3L23PC. а0 = 10,63; b0 = 8,36; с0 = 20,40. По кристаллической структуре, как и кар нотит, несколько отличается от типичных урановых слюдок, так как име ет в составе слоя не одиночные тетраэдрические группы XO4, а сдвоен ные по ребру полуктаэдры VO5 пятикоординированного ванадия, дающие в итоге комплексный радикал [V2O8]6 . Тем не менее общий слоистый мотив структуры и большинство физических свойств остаются близки
ми к таковым урановых слюдок.
Облик кристаллов тонкопластин чатый (рис. 267). Наблюдались
Рис. 267. Кристалл тюямунита
формы: {100}, {010}, {110}, {120},
{001}, {101} и {111}. Агрегаты. Рас пространен в тонкочешуйчатых землистых массах. Наблюдается также в виде налетов и корочек в полостях.
Цвет тюямунита ярко желтый (канареечный), иногда с зеленоватым или оранжевым оттенком. Блеск сильный, на плоскостях спайности пер ламутровый. Ng = 1,895, Nm = 1,870 и Nр = 1,670.
Раздел V. Кислородные соли (оксисоли) |
479 |
Твердость 1. Хрупок. Спайность по {001} совершенная, по {010} и {100} средняя. Уд. вес 3,68 (колеблется в зависимости от содержания воды). Сильно радиоактивен.
Диагностические признаки. От урановых слюдок другого состава от личим лишь по данным химических реакций и оптическим константам. В тонкодисперсных скоплениях он похож на ярко желтые выцветы не которых сульфатов железа. Отличается от них трудной растворимостью
вводе и радиоактивностью.
П.п. тр. легко плавится. С бурой дает ясную реакцию на уран (в от сутствии меди). В закрытой трубке выделяет много воды. В кислотах лег ко растворяется. Реакция с перекисью водорода на ванадий. В соответ ствующих растворах и концентрациях катион Ca2+ способен замещаться двумя К1– с образованием карнотита.
Происхождение и месторождения. Вместе с другими минералами экзогенного происхождения встречается в зоне окисления месторожде ний урансодержащих минералов. Образуется также в присутствии орга нических веществ, с которыми вообще часто связаны минералы ванадия.
Весьма возможно также, что тюямунит может образоваться за счет карнотита в осадочных породах путем воздействия на него вод, содержа щих бикарбонат кальция. Экспериментальные исследования подтверж дают возможность замещения калия кальцием.
Встречается обычно в виде землистых скоплений в ассоциации с гип сом в трещинках среди осадочных пород, содержащих органические ос татки. Из месторождений зарубежных стран отметим ванадиеносные пес чаники плато Колорадо (США).
КАРНОТИТ — K2[UO2]2 [V2O8] . 3H2O. Назван по фамилии А. Карно. Химический состав. К2О — 10,44 %, UO3 — 63,41 % V2O5 — 20,16 %, Н2О — 5,99 %. В виде примесей устанавливаются: Na2O, MgO, CaO, в очень
незначительных количествах CuO, PbO и др.
Сингония моноклинная; ромбо призматический в. с. L2PC. Пр. гр. P21/a(C 52h). a0 = 10,47; b0 = 8,41; с0 = 6,91; β = 103°40′. Обычно наблюдается
впорошковых массах и в виде налетов.
Цвет карнотита ярко желтый или зеленовато желтый. Блеск сильный, на плоскостях спайности перламутровый. Ng = 1,950, Nm = 1,925, Np = 1,750.
Твердость 2–2,5. Хрупок. Спайность совершенная по {001}. Уд. вес 4,46. Сильно радиоактивен.
Диагностические признаки. Во многом похож на тюямунит. Отли чим по оптическим константам.
П. п. тр. легко сплавляется в черный шарик, окрашивая пламя в бледно фиолетовый цвет (следует наблюдать сквозь синее стекло, поглощающее желтый оттенок света натрия. С бурой дает перл урана. Легко растворяется в кислотах. Реакция на ванадий с перекисью водорода. Порошок, слегка смо ченный HCl, становится кровяно красным (присутствие ванадия).
480 |
Описательная часть |
Происхождение и месторождения. Распространен в зоне выветри вания осадочных пород, главным образом песчаников, обогащенных орга ническими остатками. Впервые был найден в ванадиеносных песчаниках юрского возраста в штатах Юта и Колорадо (США).
Встречен также в известковистых песчаниках в провинции Шаба (Де мократическая Республика Конго), Радиум Хилл (Австралия) и во мно гих других местах.
4. Группа бирюзы
Здесь объединяются пятиводные основные фосфаты Cu, Al и Fe3+, кристаллизующиеся в триклинной сингонии. Мы опишем лишь бирюзу.
БИРЮЗА — CuАl6[РО4]4[OН]8 . 4Н2О. Синоним: каллаит (древнее название бирюзы). Разновидность, богатая железом, названа рашлеитом, а ферридоминантный аналог бирюзы называется халькосидеритом CuFe3+6[РО4]4[OН]8 . 4Н2О.
Химический состав. CuO — 0,57 %, Аl2О3 — 36,84 %, Fe2O3 — 0,5—21 %, Р2О6 — 34,12 %, Н2О — 19, 47 %. Устанавливаются различные примеси.
Сингония триклинная, пинакоидальный в. с. Обычно распростране на в скрытокристаллических массах почковидной формы или в виде ко рок, прожилков и неправильной формы скоплений.
Цвет бирюзы небесно голубой, яблочно зеленый, зеленовато серый. Блеск восковой. Ng = 1,65, Nm = 1,62 и Np = 1,61.
Твердость 5—6. Довольно хрупка. Спайность по {001} совершенная, по (010) средняя. Излом слегка раковистый. Уд. вес 2,60—2,83.
Диагностические признаки. Характерны цвет и восковой блеск. Од нако в ряде случаев для отличия от похожих иногда на нее хризоколлы и других минералов меди приходится прибегать к химическим реакциям.
П. п. тр. растрескивается, буреет. Пламя окрашивает в бледно зеле ный цвет. В закрытой трубке выделяет много воды. С бурой и фосфор ной солью дает реакцию на медь. В кислотах растворяется. Дает реакцию на фосфор.
Происхождение и месторождения. Образуется в условиях выветри вания (часто вместе с лимонитом), при воздействии меденосных поверх ностных растворов на горные породы, содержащие глинозем (в полевых шпатах и др.) и фосфор (в виде апатита и др.). Известны случаи образо вания бирюзы за счет ископаемых костей и зубов животных («костяная бирюза» или одонтолит). Органическое происхождение такой бирюзы отчетливо устанавливается в шлифах под микроскопом.
Лучшая бирюза в течение ряда столетий добывалась в Маданском ме сторождении (около г. Ниишапура в Иране), где она вместе с лимонитом образовалась в виде неправильной формы скоплений и тонких прожил ков среди выветрелой изверженной породы — трахита. Как драгоценный камень бирюза отсюда шла в Европу через Турцию. Из остальных место
Раздел V. Кислородные соли (оксисоли) |
481 |
рождений упомянем: Вади Магара (на Синайском полуострове), Кара Тюбе (к югу от Самарканда, Узбекистан) и др.
Практическое значение. Лучшие по окраске разности бирюзы (не бесно голубого цвета) употребляются на украшения. Худшие разности поддаются искусственной окраске.
КЛАСС 7. БОРАТЫ
Общие замечания. К этому классу принадлежат борнокислые соеди нения с участием разнообразных катионов, большей частью Na+, Ca2+, Mg2+
иFe2+, а также — амфотерных Al3+ и Fe3+. В химическом отношении все такие минералы — нормальные, кислые и основные соли борных кислот,
кчислу которых, кроме ортокислоты Н3ВО3, относятся метаборная кис лота НВО2 и так называемые полиборные кислоты, большинство из ко торых являются гипотетическими и служат лишь для формального описа ния соединений. Реальные формы и состав комплексных борных анионов в минералах описываются несколькими признаками, в числе которых можно указать, во первых, координацию бора относительно кислорода, далее — сте пень конденсации простых (моноядерных) брокислородных анионов и, наконец, замещенность части ионов кислорода гидроксильными группа ми. Этими тремя характеристиками определяется не только наиболее пред почтительный катионный состав тех или иных различных боратов, но и их физические и химические свойства, а также условия образования и ти пичные парагенезисы.
Бор в различных природных кислородных соединениях может харак теризоваться координационными числами 3 или 4, координационные боро кислородные группировки в этих случаях представлены плоскотреугольны ми или тетраэдрическими радикалами соответственно. Бор в структурах некоторых минералов выступает в одной из таких координаций, в других — в обеих сразу. Для борокислородных радикалов обоих координационных типов свойственна поликонденсация с образованием сложных комплекс
ных радикалов. Так, треугольные ортогруппы [BO3]3 могут конденсиро ваться через объединение вершин в диортогруппы [B2O5]4 , кольца [B3O6]3
ицепочки [B2O4]2 и т. д. Соответствующие солям с такими радикалами ги потетические полиборные кислоты выводятся отнятием того или иного
количества частиц Н2О от превосходящего или равного количества частиц нормальной ортокислоты. Если ортобораты — соли ортоборной кислоты
H3[BO3], то для конденсированных полиядерных радикалов с трехкоорди нированным бором имеем следующие реакции:
для диортогруппы — 2Н3ВO3 — Н2О = H4[B2O5];
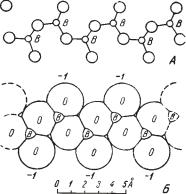
для цепочки (рис. 268а) — 2Н3ВO3 — 2Н2О = H2[B2O4].
Последняя реакция, лишь с заменой множителя с 2 на 3, справедлива
идля кольцевого радикала [B3O6]. Нетрудно видеть, что по соотношению
482 |
Описательная часть |
|
|
бора и кислорода обезвоживание приво |
|
|
дит в конце концов от ортоборной кисло |
|
|
ты к метаборной, отвечающей максималь |
|
|
ной степени конденсации радикалов с |
|
|
трехкоординированным бором. |
|
|
В то же время радикал ортоборной кис |
|
|
лоты [BO ]3 можно рассматривать не как |
|
|
3 |
|
|
изолированный треугольник, а как беско |
|
|
нечную цепочку (или кольцо) вершинно |
|
|
связанных тетраэдров [BO4], т. е. как суще |
|
|
ственно конденсированный полиядерный |
|
|
радикал четырехкоординированного бора. |
|
Рис. 268. Цепочки связанных |
Переход к менее конденсированным кис |
|
комплексов ВО3: а — положение |
лотам с тетраэдрическими радикалами |
|
центров ионов; б — вид цепочки |
можно представить как результат насыще |
|
в кристаллической структуре |
||
ния превосходящего числа частиц ортобор |
||
|
ной кислоты некоторым количеством молекул воды: 2Н3ВO3 + Н2О = = H8[B2O7], — кислота с островной двухтетраэдрической группировкой. Насыщение водой в равном количестве приводит к полной деконденса ции [BO4] тетраэдров и образованию кислоты с радикалом в виде изоли рованного моноядерного комплексного аниона: Н3ВO3 + Н2О = H5[BO4].
Таким образом, мы видим, что ортоборная кислота обладает в своем роде структурным полиморфизмом, образуя как соли с простыми груп пировками бора в треугольниках, так и с высококонденсированными ра дикалами бора в тетраэдрах. Вполне естественно поэтому предположить, что могут существовать радикалы с промежуточной степенью конденса ции и промежуточным средним координационным числом бора, между 4 и 3, т. е. образованные как треугольниками, так и тетраэдрами, с преоб ладанием тех или других.
Так в действительности и происходит, в преобладающем большинстве собственно боратов, т. е. не борато силикатов и подобных им сложных солей, бор присутствует в обеих координациях, образуя конденсирован ные полиядерные радикалы. На предпочтение той или иной координа ции бора влияет давление, а при фиксированном давлении степень водо насыщенности определяется температурой (высокотемпературные парагенезисы более сухие). От температуры, следовательно, зависит и сте пень конденсации.
В зависимости от природы катионов и кислотно щелочных характе ристик среды минералообразования борные и полиборные кислоты мо гут образовывать основные, нормальные или кислые соли. В первом слу чае часть анионных функций берет на себя гидроксил (или ионы галогенов), наряду с анионным радикалом компенсируя положительную валентность катионов. В случае кислых солей протоны присоединяются
Раздел V. Кислородные соли (оксисоли) |
483 |
к кислороду радикалов (точнее, не вытесняясь катионами, остаются на том месте, где находились в кислотах), так что часть кислорода в радика ле становится замещенной гидроксилом и заряд радикала понижается, как если бы кислота была менее основной.
Сохраняя геометрию полученных выше моноядерных и конденсиро ванных радикалов, мы можем получить формулы таких специфических кислот, внося часть водорода в квадратные скобки и присоединяя его к кислороду. При этом следует помнить, что атомы кислорода, общие для конденсированных радикалов (мостиковые), не могут быть замещены гидроксилом, так как на них сходится слишком большое валентное уси лие со стороны бора или других кислотообразующих амфотерных катио нов, таких как например Si4+ в борато силикатах. Так, из кислоты с двухъ ядерной группировкой треугольников H4[B2O5] получим H3[B2O4(OH)], солью такой кислоты можно считать ссайбелиит (см. в описании). Про делав подобную операцию над кислотой H8[B2O7] с двухъядерной тетра эдрической группировкой, получим кислоту H2[B2O(OH)6], солью кото рой может считаться пинноит Mg[B2O(OH)6].
Образование кислых солей возможно как у боратов с четырехкоорди нированным бором, так и с трехкоординированным, а для боратов со сме шанной координацией бора — обязательно. Это означает, что полиядер ные радикалы с бором в двух типах окружения непременно содержат гидроксил; именно все немостиковые кислороды таких радикалов долж ны обязательно присоединять протон. Так, например, образуется четвер ное кольцо [B4O5(OH)4]3 из двух треугольников и двух тетраэдров, сдво енных кроме того по общей вершине, в структуре буры; четыре концевых кислорода замещены гидроксилом.
Рассмотрим особенности катионного состава и свойства различных боратов. Для ортоборатов и боратов с изолированными тетраэдрически ми радикалами типичными катионами являются Mg2+, Fe2+, Al3+ и Fe3+, отчасти Ca2+. Все ортобораты встречаются исключительно в виде безвод ных соединений. Нормальные ортобораты не растворяются не только в воде, но и в кислотах (или разлагаются в них с трудом), плавятся при высокой температуре и обладают высокой или повышенной твердостью.
Для полиборатов в числе катионов, кроме Mg2+, весьма характерны так же более крупные катионы Ca2+ и Na1+, причем они распространены почти исключительно в виде водных солей (кристаллогидратов). Полибораты Na1+ и других сильных катионов легко растворимы в холодной воде, а двойные бораты Na1+ и Са2+ — в горячей воде. Безводные полибораты магния (на пример, борацит) в водной среде постепенно гидратизируются при нор мальной температуре, чего не наблюдается для ортоборатов.
Интересны и некоторые другие особенности поведения бора в при родных процессах. Как установлено, при низких температурах В2О3 способен вытесняться CO2, при высоких же температурах имеет место
484 |
Описательная часть |
обратная картина. При выветривании можно наблюдать явления за мещения боратов карбонатами, как было установлено в Индерском ме сторождении боратов. С другой стороны, в контактово метасоматиче ских месторождениях известны находки боратов, образовавшихся путем замещения ими карбонатов в известняках.
Бор относится к числу довольно подвижных элементов в водных раст ворах, содержащих такие компоненты, как Cl, ОН и особенно F, с кото рым он имеет значительное химическое сродство. Поэтому концентра ция и образование борных соединений происходят в остаточных продуктах тех или иных геологических процессов, отчасти в пегматитах и гидротермальных образованиях (ортобораты, боросиликаты), но глав ным образом в обогащенных бором усыхающих соленосных бассейнах (по либораты, изредка водные борато силикаты).
По ряду кристаллохимических свойств бораты стоят ближе к силика там, чем к другим кислородным солям. Бораты, характеризующиеся на личием в кристаллических структурах простых комплексных анионов [ВО3]3 и [ВО4]5 , мало чем отличаются от типичных кислородных солей, в том числе и ортосиликатов с их группами [SiO4]4 .
Безводные бораты
Безводные бораты представлены главным образом солями ортобор ной кислоты (нормальными, кислыми и основными). Единичные мине ралы относятся к мета и полиборатам.
ССАЙБЕЛИИТ — Mg2[B2O4(OH)](OH) или 2MgO . B2O3 . H2O. Си ноним: ашарит.
Химический состав. MgO — 47,91%, В2О3 — 41,38%, Н2О — 10,71%. Иногда присутствует марганец. Устанавливается незначительное содер жание фтора.
Сингония моноклинная. В структуре существуют изолированные группировки из двух вершинно связанных борокислородных тетраэдров с замещением одного из кислородов гидроксилом. Таким образом, ссай белиит является одновременно кислой и основной солью. Встречается в рыхлых мелоподобных, реже плотных массах параллельно волокнисто го или тонкоигольчатого строения.
Цвет ссайбелиита белый. Блеск стеклянный, рыхлые массы матовые. Ng = 1,650, Nm = 1,646 и Np = 1,575.
Твердость 3—3,5. Рыхлые мелоподобные массы марают пальцы. Уд. вес 2,65.
Диагностические признаки. По внешнему виду можно предположи тельно определить в случае парагенезиса с другими боратами. Точно ус тановить можно лишь с помощью измерения оптических констант и хи мического анализа.
Раздел V. Кислородные соли (оксисоли) |
485 |
П. п. тр. сплавляется в эмаль, сильно окрашивая пламя в зеленый цвет (присутствие бора). В воде нерастворим. В кислотах растворяется с тру дом. Главную массу воды выделяет при температуре выше 800°.
Происхождение и месторождения. Ссайбелиит чаще встречается как вторичный минерал в соленосных осадочных месторождениях боратов. Он образуется в условиях сухого жаркого климата как продукт естествен ной переработки и дегидратации других, по преимуществу водных бор нокислых соединений. Метасоматическим путем он скопляется также в глинах. В пустотах, образовавшихся при выщелачивании, ссайбелиит наблюдался в виде колломорфных почковидных масс радиально лучис того или игольчатого строения.
Известны также случаи нахождения ссайбелиита в контактово мета соматических месторождениях в известняках или доломитах в ассоциа ции с серпентином (гидросиликатом магния), магнетитом и другими ми нералами.
Из иностранных месторождений отметим следующие: близ Ашерсле бена и в Нейстассфурте (Саксония), Рецбанья (Румыния), Гунгари (Не вада, США).
Практическое значение. В тех случаях, когда он встречается в значи тельных массах, он вместе с другими боратами представляет промышлен ный интерес.
Бораты являются минеральным сырьем для получения из них борной кислоты, имеющей разнообразное применение. В химической промышлен ности она является исходным материалом для получения солей бора. Наря ду с бурой она применяется в производстве эмали для железных сосудов и глазурей (коэффициент расширения такой эмали близок к коэффициенту расширения металла), для пропитывания свечных фитилей с целью прида ния им жесткости во время горения, в кожевенном деле, в медицине и т. д.
Бура, кроме того, используется в стекольном производстве при изго товлении ламповых и других стекол, подвергающихся колебаниям тем пературы, а также стекла «пирекс» (с 1 1,8 % В2О3) для лабораторной по суды (для оптических линз, изготовлявшихся фирмой Цейсе, шло стекло с содержанием В2О3 до 56 %). Благодаря способности растворять окислы металлов, бура применяется при паянии как плавень, не позволяющий образоваться окислам на спаиваемой поверхности.
Бура добавляется в бумажную массу с целью получения глянцевитых высших сортов, а также невоспламеняющейся бумаги и изделий из нее. Кроме того, соединения бора имеют очень важное значение для удобрения почв; при правильной дозировке удается установить оптимальный режим питания растений калийными солями и тем самым повысить урожайность.
В последнее время бор приобрел исключительное значение в получе нии высокоэнергетического топлива для реактивных двигателей. Карби ды бора (В6С, В4С, В3С) представляют высокоабразивные материалы.
