
Кишкун А.А
.pdf
602 ■ Глава 9
Рис. 9-12. Эффекты атриального натрийуретического пептида
экскреции натрия дополнительно обусловлено подавлением АНП секреции ренина юкстагломерулярным аппаратом. Ингибирование ренин−ангиотензин−альдостероновой системы способствует усиленной экскреции натрия и периферической вазодилатации. Дополнительно экскреция натрия усиливается путём прямого действия АНП на проксимальные канальцы нефрона и непрямого ингибирования синтеза и секреции альдостерона. Наконец, АНП ингибирует секрецию АДГ из задней доли гипофиза. Все эти механизмы в конечном счёте направлены на то, чтобы вернуть к норме увеличенные количество натрия и объём воды в организме и снизить артериальное давление. Факторы, активирующие АНП, противоположны тем, которые стимулируют образование ангиотензина II.
На плазматической мембране клеток-мишеней присутствует рецептор к АНП. Его связывающий участок находится в экстрацеллюлярном пространстве. Внутриклеточный участок АНП-рецептора сильно фосфорили-

Гормональные исследования ■ 603
рован в неактивной форме. Как только АНП присоединяется к экстрацеллюлярному участку рецептора, происходит активация гуанилатциклазы, которая катализирует образование цГМФ. В гломерулезных клетках надпочечников цГМФ ингибирует синтез альдостерона и его секрецию в кровь. В клетках-мишенях почек и сосудов активация цГМФ ведёт к фосфорилированию внутриклеточных белков, которые опосредуют биологические эффекты АНП в этих тканях.
В плазме крови АНП находится в виде нескольких форм прогормона. Существующие диагностические системы основаны на способности определять концентрацию С-концевого пептида про-АНП с 99−126 аминокислотными остатками (α-АНП) или двух форм с N-концевым пептидом — про-АНП с 31−67 аминокислотными остатками, и про-АНП
с78−98 аминокислотными остатками [Hunter M.E.F. et al., 1998]. Референтные величины концентраций в плазме крови составляют для α-АНП — 8,5±1,1 пмоль/л (период полужизни 3 мин), N-про-АНП с 31−67 аминокислотными остатками — 143,0±16,0 пмоль/л (период полужизни 1−2 ч), N-про-АНП с 78−98 аминокислотными остатками — 587±83 пмоль/л [Hunter M.E.F. et al., 1998]. Считается, что про-АНП с N-концевым пептидом более устойчив в крови, поэтому его исследование предпочтительно для клинических целей. Высокая концентрация АНП может играть роль в уменьшении задержки натрия почками. АНП оказывает влияние на симпатическую и парасимпатическую системы, на почечные канальцы и сосудистую стенку.
Внастоящее время описан целый ряд структурно подобных, но генетически различных гормонов семейства натрийуретических пептидов, которые участвуют в поддержании гомеостаза натрия и воды. Помимо атриального натрийуретического пептида типа А, клиническое значение имеет мозговой натрийуретический пептид типа В (впервые получен из мозга быка) и натрийуретический пептид типа C (состоит из 22 аминокислот). Мозговой натрийуретический пептид типа В синтезируется в миокарде правого желудочка в виде прогормона — промозгового натрийуретического пептида, а тип C в ткани мозга и сосудистом эндотелии. Каждый из этих пептидов является продуктом экспрессии отдельного гена. Регуляция секреции и механизм действия мозгового натрийуретического пептида типа В аналогичен АНП. АНП и натрийуретический пептид типа В оказывают широкий спектр действия многие ткани, а тип С, по-видимому, оказывает только локальный эффект.
Впоследние годы АНП и мозговой натрийуретический пептид типа В рассматривают как потенциальные маркёры оценки функционального состояния сократительной способности сердечной мышцы (маркёр выраженности сердечной недостаточности) и самые важные прогностические показатели исхода заболеваний сердца.
Концентрация АНП в плазме крови повышена у пациентов с застойной сердечной недостаточностью, отёками, ОПН, ХПН, при циррозе печени
сасцитом. У больных в подострой фазе ИМ концентрация натрийуретических пептидов в плазме крови служит лучшим маркёром для диагностики сердечной недостаточности и обладает прогностической значимостью в плане исхода заболевания и смерти. Повышенный уровень АНП в крови в большинстве случаев коррелирует с тяжестью сердечной недостаточнос-

604 ■ Глава 9
ти. Была выявлена независимая от фракции выброса высокая чувствительность и специфичность натрийуретического пептида типа B в отношении диагностики сердечной недостаточности любой этиологии [Nakamura M. et al., 2001].
Наибольшую перспективу в отношении диагностики сердечной недостаточности имеет исследование в крови концентрации мозгового натрийуретического пептида типа В, а также N-концевого про-мозгового натрийуретического пептида. Это связано с тем, что В-тип натрийуретических пептидов секретируется желудочками сердца и непосредственно отражаетнагрузку на миокард, в то время как АНП синтезируется в предсердиях, поэтому является «непрямым» маркёром. При мерцательной аритмии содержание АНП со временем снижается, отражая уменьшение секреторной активности предсердий. Кроме того, АНП менее стабилен в плазме по сравнению с мозговым натрийуретическим пептидом типа В.
Содержание натрийуретического пептида типа B в плазме крови больных с сердечной недостаточностью коррелирует с толерантностью к нагрузкам
иимеет большее значение в определении выживаемости больных. В связи с чем ряд авторов предлагают использовать определение концентрации натрийуретического пептида типа B в качестве «золотого стандарта» диастолической недостаточности миокарда. В рекомендациях по диагностике
илечению хронической сердечной недостаточности Европейского общества кардиологов (2001) концентрации натрийуретических пептидов в сыворотке крови рекомендуется использовать в качестве критерия диагностики заболевания.
Наличие сердечной недостаточности может быть исключено в 98% случаев при концентрации АНП ниже 18,1 пмоль/л (62,6 пг/мл) и мозгового натрийуретического пептида типа В — ниже 22,2 пмоль/л (76,8 пг/мл) [Cowie M. et al., 1997]. В качестве точки разделения в отношении диагностики сердечной недостаточности для N-концевого промозгового натрийуретического пептида используют значения выше 80 пмоль/л [Karl J. et al., 1999].
Динамика концентрации натрийуретических пептидов в крови — хороший показатель для оценки проводимой терапии (по уровню мозгового натрийуретического пептида типа В можно титровать дозу ингибиторов АПФ) и мониторинга течения болезни у пациентов с сердечной недостаточностью.
Функциональное состояние гормональных систем регуляции обмена кальция
Основная масса присутствующего в организме кальция находится в костях. Фракция внекостного кальция составляет всего 1% его общего содержания в организме, вместе с тем она очень важна из-за её воздействия на нервно-мышечную возбудимость и сердечную мышцу. Гомеостаз кальция в организме обеспечивается системой ПТГ — кальцитонин — витамин D. Основная функция всех этих гормонов — регуляция обмена Са2+ и фосфатов в организме и поддержание постоянства концентрации Са2+ в крови.

Гормональные исследования ■ 605
Нарушения метаболизма кальция проявляются гиперкальциемией или гипокальциемией, отрицательным или положительным балансом кальция. Наиболее частая причина гиперкальциемии — гиперпаратиреоз, а гипокальциемии — гипопаратиреоз.
Паратиреоидный гормон в сыворотке крови
Референтная концентрация ПТГ в сыворотке крови у взрослых — 8−24 нг/л (РИА, N-концевой ПТГ); интактной молекулы ПТГ — 10−65 нг/л.
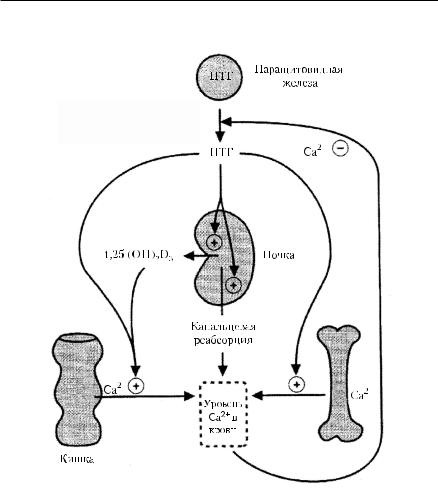
ПТГ — полипептид, состоящий из 84 аминокислотных остатков, образуется и секретируется паращитовидными железами в виде высокомолекулярного прогормона. Прогормон после выхода из клеток подвергается протеолизу с образованием ПТГ. Продукцию, секрецию и гидролитическое расщепление ПТГ регулирует концентрация кальция в крови. Снижение её приводит к стимуляции синтеза и высвобождению гормона, а понижение вызывает обратный эффект. ПТГ повышает концентрацию кальция и фосфатов в крови. ПТГ действует на остеобласты, вызывая повышение деминерализации костной ткани. Активен не только сам гормон, но и его аминоконцевой пептид (1−34 аминокислоты). Он образуется при гидролизе ПТГ в гепатоцитах и почках в тем большем количестве, чем ниже концентрация кальция в крови. В остеокластах активизируются ферменты, разрушающие промежуточное вещество кости, а в клетках проксимальных канальцев почек ингибируется обратная реабсорбция фосфатов. В кишечнике усиливается всасывание кальция (рис. 9-13).
В патогенезе гиперпаратиреоза ведущую роль играют нарушения каль- ций-фосфорного обмена вследствие избыточной продукции ПТГ. Органымишени ПТГ — кости, почки и тонкая кишка. При действии ПТГ на костную ткань усиливается резорбция кости за счёт активации остеобластов. Образование новой кости отстаёт от её рассасывания, что ведёт к генерализованному остеопорозу, вымыванию кальция из костного депо и гиперкальциемии. Остеобласты активизируют синтез коллагена. Разрушение избыточного количества коллагена нейтральными протеазами приводит к появлению высоких концентраций пептидов, содержащих оксипролин
вкрови, и повышает их выведение с мочой. Влияние ПТГ на почки проявляется фосфатурией, обусловленной снижением реабсорбции фосфата
впроксимальных канальцах. ПТГ стимулирует образование кальцитриола, который усиливает всасывание кальция в тонкой кишке. Важную роль
ввозникновении язвенного поражения желудка, двенадцатиперстной кишки и тонкой кишки играет гиперкальциемия, которая совместно с ПТГ оказывает прямое стимулирующее действие на слизистую оболочку ЖКТ, а также вызывает кальцификацию сосудов.
Первичный гиперпаратиреоз может быть 3 типов: спорадический; семейный с множественной эндокринной неоплазией (МЭН) I или МЭН-II; семейный без МЭН (или семейный изолированный). Первичный спорадический гиперпаратиреоз обусловлен либо аденомой (бластомой) паращитовидных желёз (в 85% случаев), либо их первичной гиперплазией. Опухоли паращитовидных желёз почти всегда доброкачественны. Лишь в редких случаях первичный гиперпаратиреоз вызван карциномой паращитовидных желёз. С возрастом частота аденомы паращитовидных желёз увеличивается. Первичный гиперпаратиреоз характеризуется повышением концент-
606 ■ Глава 9
Рис. 9-13. Эффекты ПТГ
рации в крови ПТГ (в 2−20 раз), гиперкальциемией при нормальном или сниженном содержании фосфатов в крови. При поражении почек, обычно вследствие гиперкальциемии, наблюдают тенденцию к нормализации концентрации фосфатов и кальция в крови. На этой стадии заболевания диагностика может быть очень сложной. Содержание кальцитонина в крови повышено.
Семейный первичный гиперпаратиреоз без МЭН наблюдают редко, практически всегда он развивается до 10-летнего возраста.

Гормональные исследования ■ 607
Медикаментозное лечение первичного гиперпаратиреоза неэффективно за исключением случаев его возникновения у женщин после менопаузы (в последнем случае назначение препаратов эстрадиола позволяет снизить концентрацию кальция в крови и способствует сохранению костной массы).
Паратиреоэктомия — единственный эффективный метод лечения первичного гиперпаратиреоза. Показания к оперативному лечению:
■концентрация общего кальция в сыворотке, на 0,25−0,4 ммоль/л превышающая верхнюю границу нормы;
■снижение СКФ более чем на 30% по сравнению с нормой;
■суточная экскреция кальция более 10 ммоль;
■подтверждённая рентгенологически мочекаменная болезнь;
■снижение плотности костной ткани более чем на 2 стандартных отклонения от возрастной нормы;
■возраст моложе 50 лет;
■наличие клинических проявлений гиперкальциемии.
При более низких значениях концентрации кальция в крови необходимо наблюдать больного в течение 6−12 мес, периодически контролируя кальций, ПТГ и маркёры метаболизма костной ткани. В зависимости от динамики лабораторных показателей определяют дальнейшую тактику.
Вторичный гиперпаратиреоз представляет собой компенсаторную гиперфункцию и гиперплазию паращитовидных желёз, развивающуюся при длительной гиперфосфатемии и гипокальциемии, обусловленной ХПН, дефицитом витамина D и кальция, синдромом мальабсорбции и др. При вторичном гиперпаратиреозе происходит стимуляция образования ПТГ
вответ на снижение концентрации ионизированного кальция в крови. Эта секреция ПТГ является адекватной в том смысле, что она необходима для нормализации содержания ионизированного кальция. Если этот эффект достигнут, то стимуляция секреции ПТГ прекращается. В связи с этим, если функции механизма обратной связи регуляции ПТГ не нарушены, то любой фактор, способствующий снижению ионизированного кальция
вкрови, может вызывать вторичный гиперпаратиреоз. При вторичном гиперпаратиреозе концентрация кальция в крови либо низкая (если повышенное продуцирование ПТГ оказывается неадекватным для коррекции гипокальциемии), либо находится в пределах нормы, но никогда не бывает повышенной. Концентрация кальцитонина в крови снижена.
Третичный гиперпаратиреоз возникает в рамках вторичного, когда на фоне длительной вторичной гиперплазии паращитовидных желёз образуется аденома с автономным функционированием и нарушением механизма обратной связи между концентрацией кальция в крови и продукцией ПТГ. Это патологическое состояние идентично первичному гиперпаратиреозу, за исключением предшествовавшей гипокальциемии в анамнезе. Спонтанную смену низкой или нормальной концентрации кальция в крови на гиперкальциемию считают границей перехода вторичного гиперпаратиреоза
втретичный. При третичном гиперпаратиреозе наблюдают выраженную остеомаляцию и высокие концентрации в крови ПТГ (в 10−20 раз выше нормы), щелочной фосфатазы и остеокальцина.
Гиперпаратиреоз при эктопической секреции ПТГ (псевдогиперпаратиреоз) возникает в тех случаях, когда злокачественные опухоли неэндокринных тканей продуцируют чуждые им пептиды, одним из которых может быть

608 ■ Глава 9
ПТГ. Многие злокачественные новообразования сопровождаются эктопической секрецией ПТГ. При эктопической секреции обнаруживается не сам ПТГ, а белок, подобный ПТГ. Этот белок состоит из нескольких пептидов, содержащих 139−173 остатков аминокислот. Восемь первых аминокислот у этих пептидов идентичны таковым у ПТГ. Повышенные значения ПТГ обнаруживаются при гепатоме, почечно-клеточном раке, бронхогенном раке, а также при эпидермоидном раке лёгкого. Наиболее часто эктопическая секреция ПТГ возникает при раке почки и бронхогенном раке. У большинства больных с метастазами в кости выявляют гиперкальциемию, повышенные концентрации ПТГ и активность щелочной фосфатазы в крови.
МЭН наблюдают редко, они характеризуются образованием аденом двух или более эндокринных желёз, которые секретируют неадекватные количества гормонов. Различают несколько групп МЭН. При МЭН-I в патологический процесс могут быть вовлечены (две или более) следующие эндокринные органы: паращитовидные железы (гиперплазия или аденома), клетки островков поджелудочной железы (гастриномы, инсулиномы), передняя доля гипофиза, кора надпочечников, щитовидная железа. МЭН II включает медуллярную карциному щитовидной железы, феохромоцитому, аденому или карциному паращитовидных желёз. Первичный гиперпаратиреоз — наиболее частое проявление МЭН (20−30% случаев при МЭН IIа
инесколько реже при МЭН-IIб). При МЭН-I его наблюдают более чем у 95% больных. При МЭН-I, как правило, выявляют преимущественно диффузную гиперплазию паращитовидных желёз, а при МЭН-IIа — аденомы.
Содержание ПТГ в крови может повышаться при гиповитаминозе D, у больных с энтерогенной тетанией и тетанией беременных. У большинства больных с метастазами в кости развиваются гиперкальциемия и повышенное содержание ПТГ в крови.
Гипопаратиреоз — недостаточность функции паращитовидных желёз, характеризующаяся сниженной продукцией ПТГ, что приводит к нарушению обмена кальция и фосфора. Недостаток ПТГ приводит к повышению концентрации фосфатов в крови (за счёт снижения почечного эффекта ПТГ), а также к гипокальциемии, обусловленной уменьшением всасывания кальция в кишечнике, его мобилизации из костей и недостаточной реабсорбцией в почечных канальцах. Концентрация кальцитонина в крови снижена. Наиболее часто гипотиреоз обусловлен хирургическим повреждением либо непосредственно паращитовидных желёз, либо их кровоснабжения при частичной тиреоидэктомии (во время тотальной тиреоидэктомии
иларингэктомии обычно проводят удаление паращитовидных желёз).
Выявляемое при исследованиях снижение ПТГ в крови может сопровождаться повышением концентрации кальция. Причины гиперкальциемии при сниженной концентрации ПТГ в крови могут быть избыток витамина D, идиопатическая гиперкальциемия у детей, саркоидоз, очень тяжёлый тиреотоксикоз, некоторые случаи миеломы.
Псевдогипопаратиреоз — термин, объединяющий группу синдромов, характеризующихся резистентностью тканей к ПТГ. При всех этих синдромах на фоне повышенной концентрации ПТГ в крови наблюдают гипокальциемию и гиперфосфатемию.
■Псевдогипопаратиреоз Iа типа (синдром Олбрайта, наследственная остеодистрофия) — редкое наследственное заболевание, обусловленное

Гормональные исследования ■ 609
мутациями гена, кодирующего стимулирующую α-субъединицу регуляторного белка Gsα. Этот белок служит посредником между ПТГ-рецеп- торами на поверхности клеток-мишеней и аденилатциклазой, которая катализирует синтез цАМФ, опосредующей эффекты ПТГ в клетке. У больных псевдогипопаратиреозом Iа типа активность Gsα в 2 раза ниже, чем у здоровых людей, поэтому реакция клеток-мишеней на ПТГ ослаблена. Помимо резистентности к ПТГ у таких больных могут быть и другие нарушения: резистентность к ТТГ (гипотиреоз), ГРГ (аменорея), АДГ (нефрогенный несахарный диабет). Лабораторные признаки псевдогипопаратиреоза Iа типа: сниженная активность Gsα в эритроцитах; гипокальциемия и гиперфосфатемия на фоне повышенной концентрации ПТГ; после введения ПТГ концентрация цАМФ в моче не повышается или повышается незначительно, концентрация фосфатов
вмоче не изменяется или снижается.
■Псевдогипопаратиреоз Ib типа — наследственное аутосомно-доминант- ное заболевание, в основе которого лежит дефект рецепторов к ПТГ на клетках-мишенях. Изменение лабораторных показателей аналогич-
ны псевдогипопаратиреозу Iа типа, но активность Gsα в эритроцитах нормальная.
■Псевдогипопаратиреоз II типа — редкая форма резистентности к ПТГ,
воснове которой лежат наследственные нарушения метаболизма витамина D. При проведении пробы с ПТГ отмечают усиление экскреции цАМФ с мочой, но концентрация фосфата в моче не повышается.
У некоторых больных псевдогипопаратиреозом резистентность к ПТГ ограничена почками, тогда как костная ткань реагирует на повышение уровня гормона нормально. Этот вариант заболевания иногда называют псевдогипогиперпаратиреозом. В основе заболевания лежит дефект синтеза кальцитриола [1,25(OH)2D3] в почках, что приводит к усиленной экскреции кальция с мочой. Изменение лабораторных показателей при основных причинах гипокальциемии представлено в табл. 9-41.
Таблица 9-41. Изменение лабораторных показателей при основных причинах гипокальциемии
Причина |
Са |
Р |
ПТГ |
1,25(ОН)2D3 |
Гипопаратиреоз |
↓ |
↑ |
↓ |
↓ |
Псевдогипопаратиреоз |
↓ |
↑ |
↑ |
↓ или норма |
Болезни печени |
↓ |
↓ |
↑ |
↓ или норма |
Болезни почек |
↓ |
↑ |
↑ |
↓ или норма |
Кальцитриол в сыворотке крови
Референтная концентрация кальцитриола в сыворотке крови у взрослых — 16−65 пг/мл (42−169 пмоль/л).
Витамин D3 (холекальциферол) образуется в коже из 7-дегидрохолестеро- ла под влиянием солнечного света или поступает в организм с пищей. Синтезированный и поступивший витамин D3 транспортируется кровью в печень, где в митохондриях превращается в 25-гидроксивитамин [25(ОН)D3]. Этот промежуточный продукт превращается или в 1,25(ОН)2D3, или

610 ■ Глава 9
в24,25(ОН)2D3. Кальцитриол [1,25(ОН)2D3] образуется в митохондриях клеток почек под действием 1-гидроксилазы, это наиболее активная фор-
ма витамина D3. 1,25(ОН)2D3 фактически является гормоном, оказывает прямой антирахитический эффект, механизм его действия аналогичен таковому стероидных гормонов. После синтеза в почках он транспортируется кровью в кишечник, где в клетках слизистой оболочки стимулирует синтез кальцийсвязывающего протеина, который способен связывать кальций, поступающий с пищей (именно в этом и заключается основная функция витамина D). В результате этих процессов концентрация кальция в крови
повышается. На образование и секрецию 1,25(ОН)2D3 в почках влияют содержание кальция и фосфора в пище. Избыток 1,25(ОН)2D3 ингибирует синтез ПТГ. Повышение концентрации кальция в крови, вызванное из-
бытком 1,25(ОН)2D3, также ингибирует высвобождение ПТГ. Пролактин и СТГ — важные регуляторы метаболизма витамина D во время беременности и роста.
Недостаток 1,25(ОН)2D3 приводит к гипокальциемии, остеомаляции и связанным с этим нарушениям. Низкие значения концентрации 1,25(ОН)2D3 в крови выявляют при рахите, остеопорозе после наступления менопаузы, остеомаляции, гипопаратиреозе, у подростков с сахарным диабетом типа 1, метастазах в кости, ХПН.
Повышенные концентрации 1,25(ОН)2D3 в крови выявляют при первичном гиперпаратиреозе, саркоидозе, туберкулёзе, кальцинозе, у нормально растущих детей, беременных и кормящих женщин.
Маркёры образования и резорбции костной ткани
Костная ткань образует динамическое «депо» кальция, фосфора, магния
идругих соединений, необходимых для поддержания гомеостаза в минеральном обмене. Кость состоит из трёх компонентов: клеток, органического матрикса и минеральных веществ. На долю клеток приходится всего 3% объёма костной ткани.
Костную ткань формируют остеобластами. Основная функция остео-
бластов — синтез остеоида (протеинового матрикса), который состоит на 90−95% из коллагена, небольших количеств мукополисахаридов и неколлагеновых белков (остеокальцин, остеопонтин), и впоследствии минерализуется кальцием и фосфатом из внеклеточной жидкости. Остеобласты располагаются на костной поверхности и тесно контактируют с остеоидом. Они содержат щелочную фосфатазу, несут рецепторы ПТГ и кальцитриола
испособны к пролиферации. Остеобласты, окружённые минерализованным органическим матриксом, превращаются в остеоциты (зрелые, непролиферирующие клетки, которые располагаются в полостях между слоями новообразованной кости).
Резорбцию костной ткани осуществляют остеокласты. Выделяя протеолитические ферменты и кислую фосфатазу, остеокласты вызывают деградацию коллагена, разрушение гидроксиапатита и выведение минералов из матрикса. Вновь формирующаяся слабо минерализованная костная ткань (остеоид) резистентна к остеокластической резорбции.
Коллаген I типа — основной белок, составляющий 90% органического матрикса кости. Он синтезируется остеобластами в виде предшественника — проколлагена I типа, который представляет собой большую молеку-

Гормональные исследования ■ 611
лу, содержащую карбокси- и аминотерминальные пропептиды (N- и С- концевые пропептиды коллагена I типа). Эти пропептиды отделяются от основной молекулы с помощью специфических пептидаз после выделения проколлагена из клетки.
На долю неколлагеновых белков приходится приблизительно 10% органического матрикса кости. Они придают костному матриксу уникальную структуру. От правильного соотношения матриксных белков, синтез которых осуществляется клетками остеобластной линии, во многом зависит отложение гидроксиапатита.
Минеральная часть кости состоит из гидроксиапатита [Са10(РО4)6(ОН)2] и аморфного фосфата кальция, которые нековалентно связаны с белками органического матрикса. Ориентация кристаллов гидроксиапатита определяется в первую очередь ориентацией коллагеновых волокон матрикса.
В основе жизнедеятельности костной системы лежат два взаимосвязанных и взаимозамещающих процесса: процесс образования (формации) новой кости и процесс разрушения — резорбции старой кости. В норме образование и резорбция костной ткани (ремоделирование кости) уравновешены.
Остеокласты непрерывно резорбируют старую костную ткань, а остеобласты образуют новую путём синтеза остеоида (протеинового матрикса), который впоследствии минерализуется кальцием и фосфатом из внеклеточной жидкости. Эти комплексы клеток, участвующих в локальном процессе резорбции и формирования кости, называются основными многоклеточными единицами ремоделирования.
Нарушения в местах ремоделирования кости возникают вследствие изменения баланса между процессом формирования и процессом резорбции в сторону преобладания последнего, что приводит к потерям костной массы. Интенсивность и выраженность костных потерь зависят от скорости «костного оборота». Преобладание процессов формирования костной ткани и её усиленная минерализация приводят к увеличению массы и плотности костей — остеосклерозу.
Для обозначения клинических, лабораторных и рентгенологических проявлений потери костной ткани используют собирательное понятие — остеопению. Причины остеопении — остеопороз, остеомаляция, первичный гиперпаратиреоз, миеломная болезнь, мастоцитоз, почечная остеодистрофия.
Увеличение массы костной ткани и её плотности называют остеосклерозом. При остеосклерозе возникают очаги усиленного образования органического матрикса, который впоследствии минерализуется, в результате масса костной ткани и её плотность увеличиваются. Остеосклероз возникает обычно на поздних стадиях ХПН.
К маркёрам метаболизма костной ткани (маркёрам формирования костной ткани) относятся костный изофермент щелочной фосфатазы, остеокальцин, С-концевой пропептид коллагена I типа.
Основные биохимические показатели, используемые в клинической практике в качестве критериев резорбции костной ткани, включают экскрецию кальция с мочой, N-концевой пропептид коллагена I типа, пиридиновые связи коллагена.
