- •П.Ф.Турчин
- •Опис предмета навчальної дисципліни „фізична та колоїдна хімія”
- •Іі. Розподіл балів, що присвоюються студентам
- •2.1. Таблиця розподілу балів, що присвоюються студентам
- •2.2. Шкала оцінювання в кмсонп та еcts
- •Ііі. Програма навчальної дисципліни
- •IV. Програмний матеріал блоків змістових модулів Блок 1. „Фізична хімія”
- •Блок 2. „Колоїдна хімія”
- •V. Методичні рекомендації до вивчення окремих модулів та тем дисципліни
- •Змістовий модуль 1 фізична хімія
- •Тема 1. Основи хімічної термодинаміки та практичне застосування її положень в хіміко-технологічних розрахунках
- •При врахуванні фазових перетворень застосовують рівняння у такому вигляді:
- •Запитання для самоконтролю
- •Тема 2. Розчини. Термодинаміка розчинів
- •Параметри системи при змішуванні розчинів
- •Запитання для самоконтролю
- •Тема 3. Хімічна кінетика
- •Кут нахилу її дорівнює:
- •Запитання для самоконтролю
- •Тема 4. Фазові рівноваги
- •Запитання для самоконтролю
- •Змістовий модуль 2 колоїдна хімія
- •Тема 5. Фізико-хімія поверхневих явищ. Адсорбція
- •Запитання для самоконтролю
- •Тема 6. Фізико-хімія дисперсних систем та розчинів високомолекулярних сполук
- •Запитання для самоконтролю
- •VI. Теми лабораторних робіт
- •Vіі. Контрольна тестова програма Тести поточного контролю Блок 1. „Фізична хімія”
- •1. Що є термодинамічною системою:
- •2. Який зв’язок встановлює перший закон термодинаміки?
- •3. Яка з наведених діаграм ілюструє зв’язок між основними термодинамічними функціями?
- •4. Який розчин є насичений?
- •5. В чому полягає сольовий ефект?
- •6. За якими рівняннями розраховують йонну силу розчину електроліту, що містить катіони і аніони?
- •7. За якими рівняннями на практиці визначають порядок реакції, користуючись методом Вант-Гоффа?
- •8. На які стадії поділяється кінетична дія ферментів?
- •9. Яке з наведених рівнянь відповідає рівнянню швидкості ферментативного процеса Міхаєліса і Ментена?
- •10. Який з наведених графіків використовують для визначення конкретного типу гальмування ферментативної реакції?
- •11. Яка складова частина системи називається незалежним компонентом?
- •12. Якій з наведених схем відповідає монотропне перетворення?
- •13. Як змінюється відносний вміст водяної пари у приземному шарі повітря в різних місцевостях і в різний час у холодному сухому повітрі і у теплому вологому повітрі?
- •14. У якому випадку формулювання відповідає першому закону Коновалова?
- •15. Що стверджує другий закон Коновалова?
- •Блок 2. „Колоїдна хімія”
- •Тести підсумкового контролю
- •VIII. Контрольні вправи і завдання
- •5. Розрахуйте товщину дифузного йонного шару на поверхні твердої пластинки, яка занурена у водний розчин 1 . 10-5 м kCl. Відносна діелектрична проникність розчину при 250 с дорівнює 78,5.
- •7. Розрахуйте об’ємну частку дисперсної фази розчину латексу з концентрацією 0,5 г/л і густиною 0,965 г/см3.
- •Іх. Тематика самостійної та індивідуальної роботи
- •Х. Термінологічний словник
- •Хі. Рекомендована література
- •Хіі. Методичне забезпечення
- •Турчин Петро Феофанович
- •Фізична та колоїдна хімія
- •Інтерактивний комплекс
- •Навчально-методичного забезпечення
- •Друкується в авторській редакції
Тема 4. Фазові рівноваги
Основні поняття й значення. Система – тіло або група тіл, які знаходяться у взаємодії і фізично відокремлені від навколишнього середовища, яке, в свою чергу, є також системою.
Властивості систем за характером їх залежності від кількості речовини поділяються на два типи: екстенсивні та інтенсивні.
Екстенсивні властивості – це властивості, які сумуються при сполученні тіл. Такими властивостями є: маса, об’єм, внутрішня енергія, ентальпія, ентропія, теплоємність тощо. Екстенсивні властивості пропорційні масі системи.
Інтенсивні властивості – це властивості, які не залежать від маси системи. Це – температура, тиск, густина, концентрація тощо.
Існують системи гомогенні і гетерогенні.
Гомогенна система – це система, в якої відсутня поверхня поділу між окремими її частинами, що відрізняються за своїми властивостями. Наприклад, лід, рідка вода, водяна пара, рідкий або твердий розчин, розплав, суміш газів, кристал будь-якої речовини та ін.
Гетерогенними називають такі системи, окремі частини яких неоднакові за своїм складом і властивостями (наприклад, рідина і пара, насичений розчин у рівновазі з кристалами і парою та ін.).
Між окремими однорідними ділянками гетерогенних систем (фазами) існують межі поділу.
Під фазами розуміють гомогенні частини системи, які мають в однорідному полі однакові фізичні і хімічні властивості і відокремлені одна від одної поверхнею поділу.
Хімічно однорідна складова частина системи, яка може бути виділена з неї і здатна існувати в ізольованому вигляді тривалий час, називається незалежним компонентом або просто компонентом.
В гетерогенних системах можливі, з одного боку, переходи речовини з однієї фази в іншу (агрегатні перетворення, розчинення твердих речовин, перерозподіл розчиненої речовини між двома розчинниками та ін.), а з другого боку – хімічні реакції.
Системи, складові частини яких не вступають в хімічну реакцію, називаються фізичними системами. В таких системах число компонентів дорівнює числу складових частин. У випадку, коли між компонентами відбувається хімічна взаємодія, деякі з компонентів системи перестають бути незалежними. При цьому кількість компонентів зменшується на кількість хімічних реакцій, що відбуваються в системі.
Так, система, яка складається з розплаву чотирьох речовин (K2SO4, CaSO4, K2SiO3, CaSiO3), є трикомпонентною внаслідок того, що один з компонентів системи утворюється в результаті обмінної реакції:
![]()
Такі системи називаються хімічними системами.
Якщо можливі декілька хімічних реакцій, які відбуваються, наприклад, в системі оксиду кальцію і діоксиду силіцію:
![]()
![]()
![]()
![]()
число компонентів 6 (CaO, SiO2, CaSiO3, Ca2SiO4, Ca3SiO5, Ca3Si2O7) зменшується на число реакцій 4, тобто кількість компонентів складає:
![]()
У цьому випадку незалежними компонентами будуть СаО і SiO2. отже, властивості системи визначаються числом її компонентів. Слід відмітити, що йони електролітів не є компонентами, бо довго в ізольованому стані існувати не можуть.
Залежно від кількості компонентів системи поділяються на однокомпонентні, дво-, три- і багатокомпонентні.
Для водної сольової системи число незалежних компонентів, включаючи воду, дорівнює числу різних йонів, що входять у систему. Наприклад, у водної взаємній системі солей:
NaCl + KNO3 L KCl + NaNO3
число речовин дорівнює п’яти (чотири солі і вода) і можлива одна реакція, тому система є чотирьохкомпонентною.
Водні сольові системи позначають різними способами, наприклад:
|
|
|
|
або |
|
а взаємну систему:
|
NaCl + KNO3 L KCl + NaNO3 |
в Н2О |
|
|
|
|
або |
|
Умова рівноваги багатофазної замкненої системи визначається законом рівноваги фаз, який називається правилом фаз Гіббса. За цим законом кількість ступенів вільності замкненої системи в стані рівноваги зростає із збільшенням кількості компонентів у системі і зменшується із збільшенням кількості фаз. Один ступінь вільності відповідає одному незалежному компоненту або одній фазі:
![]() (4.1)
(4.1)
де С – кількість ступенів вільності системи; К – кількість незалежних компонентів у системі; Ф – кількість фаз у системі, що перебувають у стані рівноваги; 2 – незалежні параметри системи (температура і тиск).
Під ступенем вільності розуміють незалежну інтенсивну властивість замкненої системи, яка може набувати значень без зміни кількості фаз у системі.
Кількістю ступенів вільності системи називають найменше число параметрів, які характеризують стан системи.
Відповідно до кількості ступенів вільності рівноважних фізико-хімічних систем, вони поділяються на: безваріантні, одноваріантні, двоваріантні тощо.
Безваріантними (інваріантними, нонваріантними) називають системи, у яких відсутні ступені вільності, тобто С = 0. Це означає, що система з такою кількістю фаз (число фаз в системі на два більше числа компонентів) може існувати за конкретно заданих умов (температура, тиск, концентрація) і зміна навіть одного параметра викличе зникнення, щонайменше, однієї фази.
Якщо кількість фаз в системі на одиницю більша числа компонентів, число ступенів вільності буде дорівнювати одиниці (одноваріантна або моноваріантна система). В даному випадку тільки один параметр може бути обраний довільно без зміни числа фаз в системі, величини ж інших параметрів набувають цілком певних значень залежно від обраного значення першого параметра.
Якщо кількість фаз у системі дорівнює кількості компонентів, число ступенів вільності дорівнює двом: два параметри можуть бути обрані довільно без зміни числа фаз системи – система буде двоваріантною (диваріантною).
Якщо число фаз системи на одиницю менша числа компонентів, система буде мати три ступені вільності тобто вона триваріантна і т.д.
Для систем, які плавляться при високих температурах (конденсовані системи), один з параметрів стану системи – тиск – зберігає постійне значення. В такому випадку кількість незалежних параметрів зменшується на одиницю, і газ як фазу не враховують. Тоді рівняння правила фаз набуває вигляду:
![]() (4.2)
(4.2)
Однокомпонентні системи. В однокомпонентних системах окремі фази є однією і тією ж речовиною, яка знаходиться в різних агрегатних станах (твердий, рідкий і газоподібний).
Щоб знайти залежність між значеннями змінних, які визначають стан системи, вимірюють температуру, тиск і концентрацію або об’єм компонентів рівноважних систем. Отримані дані використовують для побудови діаграм стану, які є графічним виразом досліджуваних закономірностей.
У випадку однокомпонентної системи в рівняння стану входять три змінні, наприклад, температура Т, тиск Р і концентрація С, або Т, Р і мольний об’єм V. Будь-які з них розглядаються як незалежні змінні, а третя як їх функція. В більшості випадків у якості незалежних змінних обирають температуру і тиск. Відкладаючи значення цих двох змінних по двох осях прямокутної системи координат, отримують двомірну (площинну) діаграму.
На рисунку 4.1. приведені приклади (схематичні) стану однокомпонентних систем І - ІV в координатах температура Т – тиск Р.
Кожна точка на площині діаграми відображає умови, за яких знаходиться система. Це дозволяє розбити всю площину діаграму на декілька областей, кожна з яких охоплює всі можливі сполучення Т і Р, що відповідають рівноважному існуванню певної фази. Так, область (г) відповідає умовам рівноважного існування газової фази, область (р) – рідкої фази і область (т) – твердої фази. Точки, які відображають стан і умови існування системи, називаються фігуративними точками.
|
|
|
Рис.4.1. Схеми діаграм стану однокомпонентних систем: І – „типу води”; ІІ – „типу сірки”; ІІІ - ІV – з різним положенням потрійних точок (пунктири-температура і тиск в системі); фазові рівноваги: 1 – рідина-газ; 2 – тверде тіло-газ; 3 – тверде тіло-рідина (т – тверде тіло; р – рідина; г – газ) |
Крива випаровування (лінія 1) відповідає рівновазі двох фаз – рідина-газ, крива возгонки (сублімації) (лінія 2) – рівновазі тверде тіло-газ, крива плавлення (лінія 3) – рівновазі тверде тіло-рідина.
Лінії ОВ, ОС, ОА належать обом областям, які дотикаються, і кожна точка на цих лініях відповідає як спільному існуванню обох фаз, так і наявності однієї з фаз.
Згідно з правилом фаз Гіббса в областях існування тільки однієї фази система двоваріантна:
![]()
В такій системі можна до певної величини змінювати температуру і тиск без утворення нової фази.
У точках, які містяться на кривих випаровування, возгонки і плавлення, система одноваріантна:
![]()
тому в системі довільно можна змінювати тільки один з параметрів стану (температуру або тиск).
В потрійній точці 0 система безваріантна:
![]()
У ній будь-яка зміна температури або тиску виводить фігуративну точку цієї системи з положення 0 і вона потрапляє в області, де можливе рівноважне існування лише двох фаз або де система однофазна. Необхідно відмітити, що ближче до потрійної точки крива возгонки завжди має більш крутий підйом, ніж крива кипіння тому, що теплота возгонки більша за теплоту кипіння.
Діаграми стану системи І і ІІ відрізняються положенням лінії АО. На діаграмі І з підвищенням тиску температура плавлення зменшується (пунктирна вертикаль – ізотерма, яка відповідає температурі в потрійній точці). Це пов’язано з тим, що питомий об’єм твердої речовини більше, ніж рідини. На діаграмі ІІ з підвищенням тиску температура плавлення збільшується. В цьому випадку питомий об’єм твердої фази менше, ніж рідкої, що випливає з принципу Ле Шательє.
Діаграма системи І характерна для води і речовин „типу води”. Для води координати потрійної точки відповідають: тиску – 610,5 Па (4,58 мм рт.ст.), температурі – 273,16 К.
Діаграми систем ІІІ і IV відрізняються положенням потрійних точок.
Якщо тиск в системі більше тиску потрійній точці, то при нагріванні твердої фази вона плавиться (ІІІ), якщо менше – сублімує (IV). Так, сублімація кристалічного йоду відбувається тому, що потрійна точка на діаграмі стану йоду лежить при тиску, більшому (13,33 кПа), ніж тиск насиченої пари над кристалами йоду в інтервалі температур від 273 К (0,04 кПа) до температури плавлення ТПЛ = 386,5 К (12,07 кПа).
Якщо речовина утворює дві або кілька кристалічних фаз, які розрізняються за фізичними властивостями, то таке явище називається поліморфізмом.
За наявності поліморфних перетворень діаграма стану ускладнюється. На діаграмах поліморфних речовин число потрійних точок дорівнює кількості модифікацій твердої фази. Наприклад, Сульфур може утворювати чотири поліморфних модифікації. Умови існування двох кристалічних (ромбічної та монокристалічної), рідкої та пароподібної фаз відображає схематична діаграма (рис.4.2).
|
|
|
Рис.4.2. Схема діаграми стану сірки |
На діаграмі є чотири потрійних точки, які відповідають безваріантній рівновазі трьох фаз:
О (368,5 К) – ромбічний Сульфур L моноклінний Сульфур L пара;
А (424 К) – ромбічний Сульфур L моноклінний Сульфур L рідкий Сульфур;
В (393 К) – моноклінний Сульфур L рідкий Сульфур L пара;
К (387 К) – перегрітий ромбічний Сульфур L переохолоджений Сульфур L пара.
Поле ромбічного Сульфуру (SРОМБ) на діаграмі знаходиться лівіше COAF, поле моноклінного Сульфуру (SМОН) – лівіше ОВА, поле рідкого Сульфуру (SР) – правіше EBAF, а поле пароподібного Сульфуру (Sn) – нижче ОВЕ. ОА – лінія взаємних перетворень твердих модифікацій:
SРОМБ L SМОН .
Рівновазі двох фаз на діаграмі відповідають також криві: ОС – залежність тиску насиченої пари ромбічного Сульфуру від температури; ОВ та ВЕ – аналогічні залежності для моноклінного та рідкого Сульфуру. Лінії АF та АВ відповідають залежності температури плавлення SРОМБ і SМОН від тиску відповідно. Криві КО, КА і КВ належать до нестабільних систем:
- перегрітий ромбічний Сульфур (крива КА);
- переохолоджений рідкий Сульфур (крива КВ);
- пара Сульфуру (крива КО), тобто в точці К три нестійкі фази утворюють метастабільну, малостійку систему (метастабільна рівновага). Пунктирна лінія OF (продовження ВО) – тиск пари переохолодженого моноклінного Сульфуру.
Для чотирифазної системи правило фаз дає:
![]()
тобто рівновага чотирьох фаз системи:
SРОМБ L SМОН L SР L Sn
не може бути здійснена ні за яких умов.
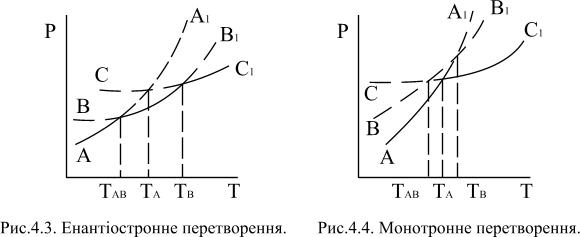
Потрійна точка поліморфного перетворення у кристалічних речовин може бути нижча або вище температур їх плавлення. Це енантіотропні і монотропні перетворення.
Якщо кожна з модифікацій речовини має свою область стабільності (за певних умов), такі модифікації є енантіотропними. Енантіотропні перетворення можна зобразити схемою:
М1 L М2 L Розплав,
де М1 і М2 – кристалічні модифікації речовини.
Якщо одна з двох наявних модифікацій більш стійка за іншу у всіх областях існування, такі модифікації називаються монотропними. При монотропному перетворенні зворотний перехід неможливий. Схема такого перетворення має вигляд:

 М1
Розплав
М1
Розплав



М2
Відмінність енантіотропних перетворень від монотропних полягає в тому, що при енантіотропних перетвореннях модифікацію А можна отримати шляхом охолодження розплаву тому, що температури енантіотропних перетворень однієї модифікації в іншу є нижчими від температур плавлення кожної з фаз (рис.4.3).
|
|
|
Рис.4.3. Енантіотропне перетворення |
|
Зворотного переходу модифікації А в В виконати не вдається. Щоб отримати знову кристали модифікації В необхідно систему нагріти до переходу її повністю в розплав, а потім поступово його охолоджувати і після внесення зародків кристалів В, викликати кристалізацію модифікації В. Під час монотропних перетворень (рис.4.4) при охолодженні розплаву викристалізовується тільки одна модифікація А, тому що температури монотропних перетворень однієї модифікації в іншу перевищують температуру плавлення кожної з них.
|
|
Рис.4.4. Монотропне перетворення |
З рисунку 4.4 видно, що температура ТАВ перетворення модифікації А в модифікацію В значно нижче ніж температура плавлення.
Якщо крива АА1 представляє собою залежність між тиском насиченої пари над модифікацією А і температурою, крива ВВ1 – зміну тиску насиченої пари для модифікації В і крива СС1 – для рідкого розплаву, то точки перетину кожної пари кривих відповідають стану рівноваги цих фаз. Наприклад, точка ТАВ відповідає рівновазі модифікації А і В. Точка В, яка лежить ще при більшій температурі, відповідає рівновазі кристалів В з рідиною і є точкою плавлення цієї модифікації.
Умови рівноваги можна відобразити як:
А L В L Рідка фаза.
При монотропному перетворенні, як бачимо з рисунку, точки перетину кривої тиску пари рідини СС1 з кривими АА1 і ВВ1 розташовані в області більш низьких температур, ніж точка перетину кривих АА1 і ВВ1, тобто точка переходу модифікації А в модифікацію В.
Рівноваги рідин з газовою фазою. Рухомі рівноваги у атмосферному повітрі. За характером зміни різних параметрів атмосферу розділяють на 5 шарів: тропосферу, стратосферу, мезосферу, термосферу, екзосферу. Тропосфера – найближчий до поверхні Землі шар повітря і тому вивчений найкраще. З віддаленням від поверхні Землі температура повітря весь час знижується і у верхніх шарах тропосфери вона досягає – 550 С.
З основних компонентів атмосфери найбільше змінюється вміст у повітрі водяної пари. У приземному шарі повітря в різних місцевостях і в різний час вміст водяної пари може змінюватись у дуже широких межах. Так, відновний вміст водяної пари може змінюватися в межах від 0,1 % - у холодному сухому повітрі до 4 % - у теплому вологому повітрі (рис.4.5). Проте проведені розрахунки показали, що водяна пара від земної поверхні не піднімається в атмосфері вище рівня тропопаузи, тобто вище 20 км.
|
|
|
Рис.4.5. Вміст водяної пари в повітрі (w) в залежності від температури (Р = 101,325 кПа) |
Найбільш потужним джерелом притоку водяної пари в атмосферу – випаровування води. За рік з поверхні води й суходолу випаровується 5 . 1014 т води. Проте майже уся водяна пара в атмосфері повертається на земну поверхню у вигляді опадів.
З висотою в атмосфері змінюється не лише температура і вміст водяної пари, але також атмосферний тиск, густина повітря, його склад й деякі інші характеристики.
За законом розподілу Лапласа розділенню газів в атмосфері відповідає рівняння:
![]() (4.3)
(4.3)
де ρ0 - густина газу на висоті h = 0, яку можна задавати довільно; ρ - густина газу на висоті h; К = 1,38 . 10-23 Дж/К – константа Больцмана; Т – абсолютна температура повітря; m – 1,66 . 10-24 г – одиниця атомної маси; q – прискорення вільного падіння, 9,81 м/с2.
Приймаючи, що
![]()
де Н – атмосферна шкала висот; μ- середня молекулярна маса повітря, маємо рівняння, які відповідають експоненціальному зменшенню атмосферного тику Р і густини повітря ρ зі збільшенням висоти h:
![]() (4.4)
(4.4)
![]() (4.5)
(4.5)
де Р0 – атмосферний тиск на висоті h0.
Атмосферний тиск біля поверхні Землі становить близько 760, на висоті 10 км – 200, а на висоті 20 км – 54 мм рт.ст. (див.рис.).
За приведеними рівняннями легко вирахувати, що при Н = 8 км (середнє значення атмосферної шкали висот поблизу земної поверхні) у шарі атмосфери нижче 5,5 км зосереджена половина усієї маси атмосфери. 90 % її розташовується нижче 16 км, а 99 % - нижче 30 км.
Висока відносна концентрація водяної пари в атмосфері приводить до її конденсації з утворенням хмар, туманів опадів. Значну частину водяної пари в тропосфері – до висот 1 - 2 км конденсують пилинки, які піднімаються вітром з поверхні грунту, а також дуже дрібні кришталики солі, що виникають у повітрі під час підняття з поверхні морів і океанів в атмосферу величезної кількості дрібних краплин солоної води.

Присутні в атмосфері тверді або рідкі частинки, що плавають у повітрі, утворюють аерозолі. Наявність кількох таких світлорозсіюючих аерозольних шарів в тропопаузі, в стратопаузі виявлено оптичним зондуванням атмосфери.
Діаграми рівноваг рідина-пара в бінарних системах. Для ідеальних розчинів вплив їх складу на тиск пари і температуру кипіння визначається законом Рауля. Згідно з законом Рауля, відновне зниження тиску насиченої пари розчинника над розчином дорівнює молярній частці розчиненої речовини в розчині.
Математично цей закон можна записати так:
![]() (4.6)
(4.6)
де Р0
і Р – тиск пари розчинника відповідно
над чистим розчинником і розчином при
певних Р і Т; N
– число молів розчинника; n
– число молів розчиненої речовини;
![]() Р
= Р0 – Р – зниження
(депресія) тиску пари;
Р
= Р0 – Р – зниження
(депресія) тиску пари;
![]() Р/Р0
– відновне зниження тиску пари над
розчином;
Р/Р0
– відновне зниження тиску пари над
розчином;
![]() - мольна частка розчиненої речовини.
Враховуючи це можна записати:
- мольна частка розчиненої речовини.
Враховуючи це можна записати:
![]() (4.7)
(4.7)
Для розбавлених розчинів , коли N>>n, рівняння спрощується:
![]() (4.8)
(4.8)
Враховуючи коефіцієнт активності і активність розчинника це рівняння можна записати так:
![]()
де
![]() - активність розчинника;
- активність розчинника;
![]() - коефіцієнт активності.
- коефіцієнт активності.
Закон Рауля не виконується для реальних розчинів, Про це свідчить відхилення коефіцієнта активності від одиниці, що пов’язано з наявністю фізичних і хімічних процесів. Парціальні тиски цих розчинів більше або менше тиску пари ідеальних розчинів. Відхилення від закону Рауля у першому випадку називаються позитивними, а в другому випадку – негативними.
Прикладами розчинів з позитивними відхиленнями від законів Рауля можуть служити розчини:
|
Бензин |
- |
ацетон, |
|
Вода |
- |
метанол, |
|
Етанол |
- |
етиловий спирт. |
|
|
|
а) б) в) |
|
Рис.4.6. Тиск пари систем: а – бензин-ацетон; б – етиловий естер-хлорметан; в – піридин-вода |
На рисунку 4.6, а зображена діаграма – склад для одного з цих розчинів (бензин – ацетон). При малих концентраціях бензину (в правій частині діаграми) тиск насиченої пари ацетону (розчинник) підкоряється закону Рауля, а тиск розчиненої речовини – бензину підкоряється закону Генрі. В лівій частині діаграми, тобто при малих концентраціях ацетону ярко вираженої області гранично розбавлених розчинів не спостерігається.
До розчинів з негативними відхиленнями від законів Рауля відносяться, наприклад, розчини:
|
Вода |
- |
нітратна(V) кислота, |
|
Хлороформ |
- |
ацетон, |
|
Хлороформ |
- |
етиловий естер. |
Діаграма тиску пари системи хлороформ–етиловий естер показана на рисунку 4.6, б.
Область гранично розбавлених розчинів помітна в інтервалі малих концентрацій хлороформу і в інтервалі малих концентрацій етилового естеру. Тиск пари розчиненої речовини в цих інтервалах менше тиску ідеальних розчинів.
Проте слід відмітити, що фактори, які викликають позитивні і негативні відхилення, можуть діяти одночасно. Зміна знаку відхилення від закону Рауля-Генрі спостерігається, наприклад, в розчині піридин-вода (рис.4.6, в). В інтервалі концентрацій піридину 0 – 50 % спостерігаються позитивні, а при більших концентраціях – негативні відхилення від закону Рауля.
|
|
|
Рис.4.7. Схематичні діаграми склад-тиск (а) і температура – склад (б) бінарної системи |
Схематична діаграма – ізотерма рівноваги бінарний розчин-пара зображена на рисунку 4.7, а. Верхня крива відображає залежність тиску насиченої пари від складу рідини, а нижня крива – залежність тиску насиченої пари від складу пари. Цими кривими площа діаграми розділяється на три поля. Верне поле охоплює значення х і Р, при яких існує тільки одна рідка фаза – розчин змінного складу. Нижнє поле відповідає газовій суміші змінного складу. Поле, що знаходиться між двома кривими, відповідає двофазній системі – розчину і насиченій парі. Верхня крива називається віткою рідини, нижня крива – віткою пари. Фігуративна точка К, яка лежить між двома вітками, характеризується двома рівноважними фазами, склад яких визначається точками а і b, що лежать на перетину ізобари. Точка а характеризує склад насиченої пари, а точка b – склад розчину, тобто відповідно х1 і х2.
Кількісний склад рідкої і пароподібної фаз може бути визначений графічно. Так, для фігуративної точки К згідно з правилом важеля відношення мас двох фаз дорівнює:
![]()
де
![]() і
і
![]() - число молей пари і рідини відповідно;
- число молей пари і рідини відповідно;
![]() і
і
![]() - довжина відрізків, на які пряма ab
ділиться фігуративною точкою К.
- довжина відрізків, на які пряма ab
ділиться фігуративною точкою К.
При ізотермічному стискуванні ненасиченої пари складу х1 фігуративна точка системи рухається вгору вертикально, конденсація пари починається в точці а при тиску Р2. Перші краплини рідини мають склад х2; рідина, що утворюється містить менше компоненту А, ніж пара, яка конденсується.
При ізотермічному зменшенні тиску рідина складу х3 (фігуративна точка С) починає випаровуватись в точці d, утворюючи пару складу х4 (точка е); пара, що утворюється містить більше компоненту А, ніж рідина, яка випаровується. Тобто, в парі завжди перевищує порівняно з рівноважною з нею рідиною компонент А, добавлення якого до системи збільшує повний тиск пари (перший закон Коновалова).
Явище випаровування і конденсації можна розглядати за допомогою ізобарної діаграми температура кипіння – склад розчину (рис.4.7, б). Компонент з більш високими тисками пари РА (рис.4.7, а) має при даному тиску більш низьку температуру кипіння ТА, тому діаграма Т - х має якісно-дзеркально-подібний вигляд по відношенню до діаграми Р - х.
Верхнє поле на діаграмі Т - х відповідає парі, а нижнє – рідині. Верхня крива – вітка пари, а нижня крива – вітка рідини.
Якщо вихідну суміш складу х1 нагрівати при постійному зовнішньому тиску до кипіння (точка а1) перші порції пари, яким відповідає точка у1 мають склад х2. При подальшому випаровуванні змінюється склад рідини (точка а2) і пари (точка у2) і т.д. Конденсація цієї пари дає рідку фракцію складу х2.
Повторюючи ці операції можна отримати подальші фракції майже до чистого компонента В.
Зв'язок між складом пари у1 і складом рідини х1 будь-якого розчину визначається рівнянням Гіббса-Дюгема-Маргулеса:
![]()
![]()
Оскільки
![]()
дістанемо:
![]()
Виходячи з того, що в рівнянні:
![]()
при
![]()
загальний тиск Р збільшуватиметься, якщо вводити в систему другий компонент, тобто
![]() (4.9)
(4.9)
З нерівності очевидно, що
![]()
тобто рівноважна пара збагачена другим компонентом, ніж розчин. Якщо
|
|
то |
|
а при |
|
|
|
|
|
При значних відхиленнях тиску пари від лінійної залежності у випадку негативного відхилення на ізотермах з’являється мінімум (рис.4.8, а), а при позитивному відхиленні – максимум (рис.4.9, а).
|
|
|
Рис.4.8. Діаграма склад – Р(а) і склад – Т(б). Негативне відхилення від лінійної залежності з мінімумом тиску пари |
В точці мінімуму рідина і пара мають однаковий склад. При перегонці він відганяється, як чиста рідина, при постійній температурі. Розчин такого складу називається азеотропним. Прикладом азеотропних розчинів є хлоридна кислота, водні розчини нітратної(V) кислоти, етанолу тощо.
|
|
|
Рис.4.9. Діаграми склад Р(а) і склад Т(б). Позитивне відхилення від лінійної залежності з максимумом тиску пари |
Екстремуми на кривих повного тиску пари (або температур кипіння) відповідають такій рівновазі розчину і насиченої пари, при якій склади обох фаз однакові (другий закон Коновалова).
Закони Коновалова підтверджені експериментально і математично подані як наслідок рівняння (4.9):
|
1)
якщо
|
|
2)
якщо
|
Положення цих законів застосовують при перегонці і розділенню компонентів розчинів з метою їх збагачення. Мірою збагачення є коефіцієнт розділення а:
![]()
На діаграмі рис. 4.10 показана схема фракційної перегонки розчину, що не утворює азеотропної суміші.
|
|
|
Рис.4.10. Зображення процесу розділення бінарної суміші на діаграмі Т-х-у |
При фракційній перегонці розчину, що утворює азеотропну суміш враховується другий закон Коновалова.
Якщо проводити такі самі процеси, як і
в попередньому випадку (рис.4.10), для
вихідного розчину (а) пара, що відганяється,
проходить через точки
![]() ,
тобто до азеотропної суміші з температурою
ТАЗ (рис.4.11). Розчин при
цьому проходить точки
,
тобто до азеотропної суміші з температурою
ТАЗ (рис.4.11). Розчин при
цьому проходить точки
![]() -
до чистого першого компонента.
-
до чистого першого компонента.

Рис.4.11. Зображення процесу перегонки розчину,
що утворює азеотропну суміш, на діаграмі Т-х-у
Двокомпонентні системи. Завданням фізико-хімічного аналізу є вивчення графіків, які описують залежність будь-якої фізичної властивості системи від її складу.
|
|
|
Рис.4.12. Криві охолодження і діаграм плавлення (кристалізації) двокомпонентної системи |
При побудові діаграм стану двокомпонентних систем найчастіше використовують криві охолодження розплавів (розчинів) різного складу (рис.4.12).
Розглянемо діаграму плавлення згідно з правилом фаз Гіббса і прослідкуємо за змінами, які відбуваються з розплавами різного складу (точки 1 - 5) при їх охолодженні. Системи, які містять вище АЕ і ВЕ – двоваріантні, бо в цьому випадку є два тверді компоненти і одна рідка фаза:
![]()
Криві АЕ і ВЕ називаються лініями ліквідусу (від латинської – рідкий). На лініях АЕ і ВЕ системи будуть одно варіантними:
![]()
Пряма CD називається лінією солідусу (від латинської – твердий). В евтектичній точці Е і вздовж усієї лінії CD система буде інваріантною, тобто тут є три фази: дві тверді і одна рідка:
![]()
Точка 1. Система вище точки А одноваріантна. Поява в точці А твердої фази робить систему інваріантною. Це відповідає температурній зупинці, потім знову відбувається охолодження. Так само поводить себе і точка 5.
Точка 2. Система вище точки Г двоваріантна. В точці Г починається кристалізація речовини А. В міру збільшення кількості твердої речовини А розплав збагачується речовиною В, внаслідок чого температура кристалізації безперервно знижується (по кривій ГЕ). В цьому випадку система одноваріантна. При досягненні температури евтектики (точка Е) розплав буде насичений обома речовинами; з’являється нова фаза – тверда речовина В і система стає інваріантною. При температурі евтектики речовини А і В кристалізуються в співвідношенні, яке відповідає складу розплаву, що залишився. Тому розплав кристалізується без зміни складу, тобто як чиста речовина. В момент зникнення останньої краплини розплаву склад твердої фази співпадає із складом вихідного розплаву. Після цього температура почне знижуватися тому, що із зниженням температури розплаву система стає одноваріантною. Для точки 2 на рисунку показано процес охолодження; по лінії ліквідусу показана зміна складу рідкої фази, а по лінії солідусу – зміна складу твердої фази. Для суміші 4 показано процес нагрівання.
Точка 3. Обидві речовини кристалізуються одночасно і довжина евтектичної зупинки, а також величина горизонтального майданчика на кривій охолодження буде максимальною.
В основі теорії сучасного фізико-хімічного аналізу лежить принцип відповідності, за допомогою якого проводять геометричний аналіз одержаних хімічних діаграм. На рис.4.13 наведена діаграма, що ілюструє принцип відповідності (кожному комплексу фаз, що знаходиться в даній системі у рівновазі, відповідає на діаграмі певний геометричний образ).
|
|
|
Рис.4.13. Діаграма, яка ілюструє принцип відповідності |
Склад двокомпонентних систем можна зображати у вигляді відрізка прямої, довжина якої приймається за одиницю при вираженні складу в мольних, вагових частках або за 100 % при вираженні в мольних і масових відсотках. Тоді один кінець горизонтальної осі відповідає 100 % одного компоненту, а другий – 100 % другого компоненту. Проміжні точки на горизонтальній осі відображають співвідношення цих двох компонентів. На вертикальній осі відкладають відповідні температури плавлення для чистих компонентів і проміжних точок.
Для визначення складу рівноважних сумішей і твердого компонента через фігуративну точку проводять горизонтальну пряму від вертикалі твердої фази компонента, що кристалізується, до лінії ліквідуса, яку називають конодою або нодою. Для фігуративної точки М складу m це буде лінія B’N. Ця суміш складається з розплаву N і твердої фази В. Склад розплаву позначається точкою n, температура – відрізком nN = mM.
Відносні кількості розплаву твердої фази В у точці M розраховують за правилом важеля:
![]()
Для фігуративної точки М’ правило важеля має вигляд:
![]()
Отже, якщо одна фаза розкладається на дві, кількість речовини утворених фаз обернено пропорційна відрізкам прямої від точки складу вихідної фази до точок складу утворених фаз.
У хімічній технології більшість солей, мінеральних добрив виробляють з розчинів. Для цього застосовують процеси розчинення і кристалізації. Ці процеси відбуваються в ізотермічних або політермічних (ізогідричних) умовах.
|
|
|
Рис.4.14. Схема процесу ізотермічної кристалізації у двокомпонентній системі з інконгруентним кристалогідратом |
Розглянемо ізотермічний процес на прикладі діаграми двокомпонентної системи з прихованим максимумом, що утворюється інконгруентним кристалогідратом (рис.4.14).
На діаграмі f1,
f2 і
f3 -
склад розчинів, що випарюються і Т1,
Т2 і Т3 –
ізотерми. В процесі випарювання розчину
f1 кількість
розчинника в ньому зменшуватиметься,
отже фігуративна точка розчину
пересуватиметься по ізотермі Т1
вправо до перетину з лінією насичення
безводної речовини В у точці
![]() .
Далі випарювання розчину, наприклад до
стану
.
Далі випарювання розчину, наприклад до
стану
![]() приведе до виділення в тверду фазу
безводної речовини В. У стані
приведе до виділення в тверду фазу
безводної речовини В. У стані
 утворюється пересичений комплекс, який
розпадається на тверду фазу В і насичений
при температурі Т1 розчин
складу
утворюється пересичений комплекс, який
розпадається на тверду фазу В і насичений
при температурі Т1 розчин
складу
![]() .
Складання матеріального балансу в стані
.
Складання матеріального балансу в стані
 виконується за правилом важеля, коли
відома маса вихідного розчину
виконується за правилом важеля, коли
відома маса вихідного розчину
![]() .
Кількість випареної води визначається
за виразом:
.
Кількість випареної води визначається
за виразом:
![]()
Довжини відрізків вимірюють безпосередньо на діаграмі стану.
Кількість комплексу
 дорівнює різниці:
дорівнює різниці:

Кількість насиченого розчину
![]() визначають за виразом:
визначають за виразом:

тоді кількість безводної твердої фази речовини В знаходять за різницею:

Ізотерма температури випарювання Т2
вихідного розчину складу f2
проходить через точку перитектики П.
При перетину з кривою насичення в точці
![]() почне виділятися кристалогідрат К
і триватиме до стану
почне виділятися кристалогідрат К
і триватиме до стану
 ,
коли весь розчин викристалізується.
Перебування кристалогідрату К в
стані
,
коли весь розчин викристалізується.
Перебування кристалогідрату К в
стані
 при температурі Т2 призведе
до поступового зневоднення його і появи
кристалів безводної речовини В. У
точці В2 настане повне
перетворення кристалогідрату в безводну
речовину В.
при температурі Т2 призведе
до поступового зневоднення його і появи
кристалів безводної речовини В. У
точці В2 настане повне
перетворення кристалогідрату в безводну
речовину В.
Процес випарювання вихідної суміші f3
при температурі Т3
відбувається аналогічно вище розглянутого
процесу. Співвідношення між безводною
речовиною і кристалогідратом у проміжних
станах (наприклад,
![]() і
і
 )
визначають за правилом важеля.
)
визначають за правилом важеля.
Процес політермічної кристалізації розглянемо на прикладі діаграми двокомпонентної системи зі стійким кристалогідратом (рис.4.15). Для цього випадку характерні чотири варіанти (точки f1, f2, f3 і f4).
|
|
|
Рис.4.15. Схема процесу політермічної кристалізації у двокомпонентної системи з стійким кристалогідратом |
Точка f1. Склад вихідного розчину f1 лежить між точками речовини А і евтетикою Е1. Температура розчину вище кривої насичення речовини А і евтетики Е1.
Процес політермічної кристалізації
супроводжується зменшенням температури
вихідних розчинів при незмінному вмісті
речовин А і В в розчині, тому
охолодження розчину складу f1
відбувається за вертикаллю
![]() .
При досягненні вертикалю лінії ліквідусу
в точці
.
При досягненні вертикалю лінії ліквідусу
в точці
![]() починає кристалізуватися речовина А.
При охолодженні до евтектичної температури
(фігуративна точка
починає кристалізуватися речовина А.
При охолодженні до евтектичної температури
(фігуративна точка
 )
розчин повністю твердіє. Тверда фаза
складається з кристалів речовини А
і кристалогідрату К.
)
розчин повністю твердіє. Тверда фаза
складається з кристалів речовини А
і кристалогідрату К.
Точка f2
.Точка f2
лежить між евтектикою Е1
і максимумом стійкого кристалогідрату
К. Охолодження розчину складу f2
до лінії насичення кристалогідрату К
призводить до початку кристалізації в
точці
![]() кристалогідрату К. При подальшому
охолодженні розчин збагачується на
тверду фазу кристалогідрату К.
Кількість твердої фази в точці
кристалогідрату К. При подальшому
охолодженні розчин збагачується на
тверду фазу кристалогідрату К.
Кількість твердої фази в точці
 пропорційна довжині відрізку коноди
пропорційна довжині відрізку коноди
 ,
а рідкої фази – довжині відрізку коноди
,
а рідкої фази – довжині відрізку коноди
 .
Якщо маса вихідного розчину
.
Якщо маса вихідного розчину
![]() відома то кількість твердої фази К
у стані
відома то кількість твердої фази К
у стані
![]() і насиченого розчину а дорівнює:
і насиченого розчину а дорівнює:![]()

Точка f3.
Точка f3 на
діаграмі розташована між максимумом
кристалогідрату К і евтектичною
точкою Е2. При охолодженні
розчину цього складу в точці перетину
![]() з лінією насичення кристалогідрату К
починає кристалізуватися кристалогідрат
К. Далі охолодження розчину, наприклад
до стану
з лінією насичення кристалогідрату К
починає кристалізуватися кристалогідрат
К. Далі охолодження розчину, наприклад
до стану
![]() ,
приведе до виділення в тверду фазу
кристалогідрату К, його кількість
визначають за правилом важеля:
,
приведе до виділення в тверду фазу
кристалогідрату К, його кількість
визначають за правилом важеля:

Трикомпонентні системи. На відміну від діаграм стану двокомпонентних систем, склади яких зображені точками на прямий, для зображення складу трикомпонентних систем використовують так званий концентраційний трикутник, вершинам якого відповідають чисті компоненти, а трикомпонентні суміші представлені точками на площині трикутника. Для того, щоб знайти на концентраційному трикутнику АВС фігуративну точку, наприклад, складу А – 30 %, В – 60 % і С – 10 % на стороні АВ від точки А відкладають відрізок АК, який відповідає 60 % В, від точки В – відрізок ВК’, який відповідає 30 % А. З отриманих точок К і К’ проводять прямі, паралельні двом іншим сторонам трикутника, тобто АС і ВС. Точка перетину і буде фігуративною точкою f, яка відповідає заданому складу (рис.4.16).
На перпендикулярах до площини трикутника, які проведені до фігуративних точок, відкладають величини досліджуваних властивостей, наприклад температури плавлення сумішей, потім з’єднують кінці цих перпендикулярів поверхнею і отримують просторову діаграму склад-властивість трикомпонентної системи. Далі через цю поверхню проводять ряд січних площин, що паралельні площині складу трикутника і отримують в точках перетину лінії (ізолінії, ізотерми), кожна з яких відповідає певному значенню властивості. Потім ці лінії проектують ортогонально на площину трикутника і одержують плоску діаграму склад-властивість трикомпонентної системи.
|
|
|
Рис.4.16. Метод зображення визначення вмісту компонентів на діаграмі стану трикомпонентної системи |
При визначенні шляхів кристалізації у трикомпонентних системах користуються правилами:
1. При первинній кристалізації фази або будь-якого компонента із суміші, яка знаходиться в полі виділення цього компонента, склад рідкої фази змінюється по прямій, що проходить крізь вершину цього компонента і фігуративну точку суміші, віддаляючись від неї.
2. У випадку однієї подвійної сполуки S, що плавиться конгруентно, точка її складу знаходиться в межах контуру ЕCSEBCSEAS поля первинної кристалізації, а у випадку сполуки, що плавиться інконгруентно – поза контуром EASEACS і поля його первинної кристалізації.
3. Якщо пряма, яка з’єднує точки складів двох твердих фаз або продовження цієї прямої, перетинає граничну криву (або її продовження), що розділяє поля первинної кристалізації цих же двох фаз, на граничній кривій в міру віддалення від вказаної точки перетину температури завжди знижуються.
4. Ознакою потрійної евтектичної точки ЕАВС є розташування стрілок на трьох граничних кривих. Евтектична точка завжди міститься в елементарному фазовому трикутнику, у вершинах якого розташовані ці ж фази, поля перинної кристалізації яких знаходяться в евтектичній точці. Тому при відніманні тепла у евтетики ЕАВС одночасно кристалізуються вказані три рівноважні фази, що можна зобразити рівнянням реакції:
![]()
5. Ознакою нонварінтної точки подвійного підйому є таке розташування стрілок на граничних кривих:

Точка подвійного підйому 1 міститься поза елементарним фазовим трикутником і протилежить вершині фази А. Подальший шлях кристалізації від точки 1 по граничній кривій відходить від поля первинної кристалізації А. Тому при відніманні тепла фази В і С кристалізуються, а фаза А розчиняється.
6. Ознакою нонваріантної точки подвійного опускання є таке розташування стрілок на граничних кривих:

Точка подвійного опускання 2 розташована в зовнішньому куті фазового трикутника у вершині фази С і протилежна стороні з фазами А і В. При охолодженні шлях кристалізації може проходити по граничній кривій, де рідина рівноважна з твердими фазами А і С, або по кривій з рівноважними твердими фазами В і С та рідиною, тобто при відніманні тепла фази А і В розчиняються.
7. При графічному визначенні співвідношення кількості фаз або їх вмісту застосовують правило важеля.
8. При аналітичному способі розрахунку кількості фаз по діаграмах стану враховують наступні випадки:
а) в системі є компонент, який залишається в рідкій фазі, тоді, коли інші частково кристалізуються і частково залишаються в рідині;
б) в твердій фазі кристалізуються всі компоненти.
Якщо є компонент, що не викристалізувався, кількість розплаву Р (%), дорівнює:
![]()
а якщо компонент, що кристалізується, відсутній:
![]()
де Х, х, х’ – вміст компонента відповідно у вихідній суміші, в розплаві і твердій фазі, %.
Розглянемо найпростішу діаграму розчинності трикомпонентної системи. На діаграмі фігуративна точка f відповідає складу вихідного розчину, що підлягає випарюванню; ЕАВЕ, ЕАСЕ, fкЕ – лінії сумісної кристалізації речовин, що розмежовують поля кристалізації прилеглих речовин; Т1 – ізотерма розчинності, при температурі якої відбувається процес випарювання.
|
|
|
Рис. 4.17. Діаграма розчинності трикомпонентної системи |
Промінь випаровування Аf1 на діаграмі визначають шляхом проведення з’єднувальної прямої, яка проходить через вершину трикутника А і фігуративну точку f. Промінь випаровування на своєму шляху перетинає лінію сумісної кристалізації ЕАВЕ і ізотерму розчинності Т1. Перетин з лінією ЕАВЕ у точці а1 вказує, що кристалізується речовина В. Температура кристалізації в цій точці нижча за температуру Т1, при якій відбувається процес випарювання, тому стану насичення в неї не досягається. При досягненні точки а2 розчин стає насиченим за речовиною В. У точці а3 розчин стає пересиченим і розпадається на тверду речовину В і насичений розчин з температурою Т1.
Для визначення складу розчину в точці а3 через вершину трикутника В і точку а3 проводять з’єднувальну пряму Вb до перетину її з ізотермою Т1 в точці b, яка відповідає цьому складу.
Внаслідок подальшого випарювання насичений розчин збіднюватиметься на речовину В, а фігуративна точка насиченого розчину переміщуватиметься у напрямку до евтектики Е1.
Евтектика Е1 – моноваріантний стан при температурі Т1, і її склад зберігатиметься доти, поки в системі буде рідка фаза.
Для визначення максимальної кількості чистої речовини В, яка кристалізується при випарюванні розчину f, проводять з’єднувальну пряму вершин трикутника В з точкою евтектики Е1. Стан точки перетину а4, яка лежить на прямій ВЕ1, визначає кількість твердої фази В. Точка розчину при цьому переміститься в евтектичну точку Е1, і розчин стане насиченим також і речовиною С. Склад розчину буде залишатися незмінним, евтонічним, і його точка Е1 буде нерухома до повного висушування розчину. Тверда фаза буде збагачуватися речовиною С, і тому точка її складу буде переміщуватися із С по стороні трикутника СВ. При повному висушуванні системи точка системи і точка твердої фази співпадуть в точці f’, а розчин зникне.
Згідно правила важеля для системи, яка, наприклад, знаходиться в точці а5:
![]()
![]()
![]()
Співвідношення речовин В і С у твердій фазі точки f’ є таким самим, як і в розчині f, що підлягає випарюванню.