- •П.Ф.Турчин
- •Опис предмета навчальної дисципліни „фізична та колоїдна хімія”
- •Іі. Розподіл балів, що присвоюються студентам
- •2.1. Таблиця розподілу балів, що присвоюються студентам
- •2.2. Шкала оцінювання в кмсонп та еcts
- •Ііі. Програма навчальної дисципліни
- •IV. Програмний матеріал блоків змістових модулів Блок 1. „Фізична хімія”
- •Блок 2. „Колоїдна хімія”
- •V. Методичні рекомендації до вивчення окремих модулів та тем дисципліни
- •Змістовий модуль 1 фізична хімія
- •Тема 1. Основи хімічної термодинаміки та практичне застосування її положень в хіміко-технологічних розрахунках
- •При врахуванні фазових перетворень застосовують рівняння у такому вигляді:
- •Запитання для самоконтролю
- •Тема 2. Розчини. Термодинаміка розчинів
- •Параметри системи при змішуванні розчинів
- •Запитання для самоконтролю
- •Тема 3. Хімічна кінетика
- •Кут нахилу її дорівнює:
- •Запитання для самоконтролю
- •Тема 4. Фазові рівноваги
- •Запитання для самоконтролю
- •Змістовий модуль 2 колоїдна хімія
- •Тема 5. Фізико-хімія поверхневих явищ. Адсорбція
- •Запитання для самоконтролю
- •Тема 6. Фізико-хімія дисперсних систем та розчинів високомолекулярних сполук
- •Запитання для самоконтролю
- •VI. Теми лабораторних робіт
- •Vіі. Контрольна тестова програма Тести поточного контролю Блок 1. „Фізична хімія”
- •1. Що є термодинамічною системою:
- •2. Який зв’язок встановлює перший закон термодинаміки?
- •3. Яка з наведених діаграм ілюструє зв’язок між основними термодинамічними функціями?
- •4. Який розчин є насичений?
- •5. В чому полягає сольовий ефект?
- •6. За якими рівняннями розраховують йонну силу розчину електроліту, що містить катіони і аніони?
- •7. За якими рівняннями на практиці визначають порядок реакції, користуючись методом Вант-Гоффа?
- •8. На які стадії поділяється кінетична дія ферментів?
- •9. Яке з наведених рівнянь відповідає рівнянню швидкості ферментативного процеса Міхаєліса і Ментена?
- •10. Який з наведених графіків використовують для визначення конкретного типу гальмування ферментативної реакції?
- •11. Яка складова частина системи називається незалежним компонентом?
- •12. Якій з наведених схем відповідає монотропне перетворення?
- •13. Як змінюється відносний вміст водяної пари у приземному шарі повітря в різних місцевостях і в різний час у холодному сухому повітрі і у теплому вологому повітрі?
- •14. У якому випадку формулювання відповідає першому закону Коновалова?
- •15. Що стверджує другий закон Коновалова?
- •Блок 2. „Колоїдна хімія”
- •Тести підсумкового контролю
- •VIII. Контрольні вправи і завдання
- •5. Розрахуйте товщину дифузного йонного шару на поверхні твердої пластинки, яка занурена у водний розчин 1 . 10-5 м kCl. Відносна діелектрична проникність розчину при 250 с дорівнює 78,5.
- •7. Розрахуйте об’ємну частку дисперсної фази розчину латексу з концентрацією 0,5 г/л і густиною 0,965 г/см3.
- •Іх. Тематика самостійної та індивідуальної роботи
- •Х. Термінологічний словник
- •Хі. Рекомендована література
- •Хіі. Методичне забезпечення
- •Турчин Петро Феофанович
- •Фізична та колоїдна хімія
- •Інтерактивний комплекс
- •Навчально-методичного забезпечення
- •Друкується в авторській редакції
Кут нахилу її дорівнює:
![]()
Перетворюючи рівняння (3.52) дістанемо нове лінійне рівняння:
![]()
яке
використовують для графічного визначення
![]() (рис.3.14,
б). На осі абсцис пряма відсікає відрізок,
який відповідає значенню -
(рис.3.14,
б). На осі абсцис пряма відсікає відрізок,
який відповідає значенню -![]() ,
а на осі ординат -
,
а на осі ординат -
![]() .
Кут нахилу прямої дорівнює:
.
Кут нахилу прямої дорівнює:
![]()
Якщо
помножити обидві частини згаданого
рівняння на Vmax
це дає ще один вид рівняння, графік якого
являє собою пряму лінію (рис.3.14, в). За
кутом нахилу прямої можна визначити
значення константи Міхаеліса
![]() .
.
Для
визначення
![]() і Vmax
використовують також лінійний графік,
для побудови якого не потрібні розрахунки,
тому що кожна пряма відповідає одному
спостереженню (рис.3.15):
і Vmax
використовують також лінійний графік,
для побудови якого не потрібні розрахунки,
тому що кожна пряма відповідає одному
спостереженню (рис.3.15):
![]()
|
|
|
Рис.3.15. Залежність Vmax від km |
У кінетиці ферментативних реакцій значну цікавість представляють механізми їх гальмування речовинами, які перешкоджають утворенню фермент – субстратного комплексу. Такі речовини називають інгібіторами.
За механізмом реакцій з ферментами інгібітори поділяються на дві великі групи: інгібітори (І), які вступають з ферментом у необоротну реакцію:
![]()
і інгібітори, які реагують з ферментом необоротно:
![]()
де
FI
- фермент –
інгібіторний комплекс, який не
перетворюється у продукт;
![]() - константа гальмування, яка показує
спорідненість інгібітору до ферменту:
- константа гальмування, яка показує
спорідненість інгібітору до ферменту:
![]()
Для
необоротного гальмування
![]() дорівнює нулю.
дорівнює нулю.
Розрізняють три типи оборотного гальмування ферментів: конкурентне, неконкурентне і безконкурентне.
Конкурентними інгібіторами називають інгібітори, які взаємодіють з тими же функціональними групами активних центрів ферментів, з якими в ході реакції взаємодіють субстрати.
Неконкурентний інгібітор зв’язується з ферментом поза активним центром. Приєднання такого інгібітору знижує активність ферменту, а не його спорідненість до субстрату.
Безконкурентний інгібітор оборотно взаємодіє з ферментом тільки після утворення фермент-субстратного комплексу:
FS + I L FSI.
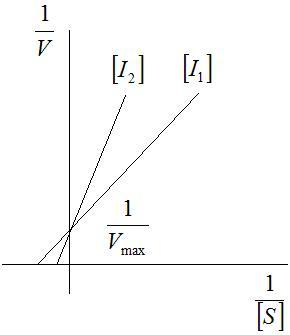
У практиці зустрічаються випадки змішаного гальмування, коли один і той же інгібітор може реагувати з вільним субстратом в різних точках, а також з фермент-субстратним комплексом у різних стадіях його перетворення. Тип гальмування може бути виявлений шляхом побудови графіків Лайнуівера – Берка (рис.3.16).
|
а) |
б) |
|
Рис.3.16. Графіки Лайнуівера – Берка для конкурентного (а) і неконкурентного (б) гальмування |
|
Як
випливає з графіків присутність
конкурентного інгібітора не змінює
значення
![]() ,
,
![]() при цьому збільшується. Для неконкурентного
гальмування константа
при цьому збільшується. Для неконкурентного
гальмування константа
![]() не залежить від концентрації субстрату,
а для
не залежить від концентрації субстрату,
а для
![]() спостерігається його зниження.
спостерігається його зниження.
На швидкість ферментативних реакцій впливає як температура, так і pH середовища. Температурний оптимум для більшості ферментів знаходиться в межах 40 – 600 С. При температурі 80 – 1000 С ферменти, що мають білкову природу, необоротно денатурують. Проте, слід відмітити, що відомі термофільні організми, які існують при температурі 100 – 2000 С.
Ферментативні реакції чутливі до зміни рН середовища. Це пов’язано з наявністю у ферментів великої кількості йоногенних груп.
Значення рН, при якому швидкість реакції максимальна, називається оптимумом рН.
Графічна залежність швидкості більшості ферментативних реакцій від температури і рН має дзвіновидну форму (рис.3.17).
|
|
|
Рис.3.17. Залежність швидкості V ферментативних реакцій від температури і рН середовища |
Ферменти та їх препарати широко використовують у багатьох галузях народного господарства. За їх допомогою виготовляють продукти молочнокислого бродіння, сири, фруктові соки, різноманітні напої, пиво, медичні препарати, ліки.
Комплекс ферментів прискорює визрівання тіста і значно зменшує витрати цукру на виготовлення хлібо-булочних виробів, підвищує якість м’ясних виробів, ковбас, консервів, напівфабрикатів тощо.
Значний ефект дає згодовування препаратів телятам, поросятам і ягнятам. Ефективним є застосування ферментів для силосування різних кормів, внаслідок чого значно поліпшується біологічна цінність силосованих кормів.
В медицині вивчення ферментативної активності використовують у діагностиці хвороб серця, печінки, жовчних шляхів. У багатьох випадках визначення активності ферменту дає можливість на ранніх стадіях діагностувати інфаркт міокарда.