- •Міністерство аграрної політики україни
- •Методичні рекомендації
- •Передмова
- •Перелік тем, винесених на самостійне опрацювання Модуль 1. Біологічні основи рибництва
- •Модуль 2. Технологія ставового рибництва
- •Модуль 3. Спеціальні методи вирощування товарної риби та нерибних об′єктів прісноводної аквакультури
- •Модуль 1. Біологічні основи рибництва
- •Біологічна характеристика перспективних об′єктів рибництва (буфало, канальний сом, веслоніса, тіляпія)
- •1. Веслоніс (Polydon spathula)
- •1.1.3. Канальний сом (Ictalurus punctatus)
- •1.1.4. Буфало (риби-буйволи)
- •Запитання для самоперевірки
- •Література
- •1.2. Додаткові риби ( щука, судак) та їх використання в практиці рибництва
- •1.2.1. Щука (Esox lucius)
- •1.2.2. Судак (Stizostedion luciopezca)
- •Запитання для самоперевірки
- •Література
- •Модуль 2. Технологія ставового рибництва
- •2.1. Гідротехнічні споруди ставків
- •Запитання для самоперевірки
- •Література
- •2.2. Характеристика окремих категорій ставків
- •1. Характеристика виробничих ставів
- •Запитання для самоперевірки
- •Література
- •2.3. Основні види кормів, які застосовуються у рибництві, та їх характеристика
- •Запитання для самоперевірки
- •Література
- •2.4. Комбіновані форми ведення рибницького господарства
- •2.4.1. Коропо - качині господарства
- •2.4.2. Рисо-рибні господарства
- •2.5. Рибництво на торф'яних кар'єрах
- •Запитання для самоперевірки
- •Література
- •2.6. Рибоводно-біологічні норми транспортування живої риби
- •2.6.1. Перевезення статевих продуктів і личинок
- •2.6.2. Перевезення живої риби
- •2. Орієнтовна потреба у воді (у літрах на 1 кг риби)
- •3. Нормативи по перевезенню риби
- •Запитання для самоперевірки
- •Література
- •2.7. Ветеринарно-санітарні вимоги при вирощуванні і перевезенні риби
- •2.7.1. Санітарно-профілактичні вимого при проектуванні та будівництві рибоводних господарств
- •2.7.2. Профілактична робота на рибоводному підприємстві
- •4. Дезинфектанти, що використовуються в аквакультурі
- •Запитання для самоперевірки
- •Література
- •Модуль 3. Спеціальні методи вирощування товарної риби та нерибних об′єктів прісноводної аквакультури
- •3.1. Культивування водоростей
- •3.2. Культивування кормових безхребетних
- •3.2.1.Культивування гіллястовусих ракоподібних
- •3.2.2. Культивування зяброногих ракоподібних
- •3.2.3. Культивування олігохет
- •2 Рис. 4. Стадії розвитку Chironomus dorsalis: / — імаго; 2 — личинка; 3 — кладка яєць .4.Культивування хірономід
- •Запитання для самоперевірки
- •Література
3.1. Культивування водоростей
В останні роки отримано низку перспективних штамів планктонних водоростей (рис. 1), які добре розвиваються на мінеральних середовищах з добавкою витяжки гною і комунально-побутових стічних вод, що забезпечують високий приріст біомаси. Технологічні штами виділено у протококових водоростей — хлорели (СhІогеІІа vulgaris, СhІ. ругеnoidosa) і сценедесмуса (Scenedesmus оbliguus). Ці штами досить стійкі до несприятливих умов середовища, можуть бути використані у різних кліматичних зонах, але найкращі результати отримано в південних районах, де тривалість їх вирощування досягає 7—9 міс.
Культивують протококові водорості в установках відкритого і закритого типів, для мінерального та органічного насичення яких використовують відходи харчової промисловості, тваринницьких і птахівницьких ферм, побутові і промислові стічні води, що дає змогу знизити собівартість водорослевої продукції на 60-80 %. Продуктивність установок відкритого типу коливається від 13 до 28 г/м3 сухої маси водоростей за добу. За 5—6 діб товщина шару суспензії водоростей досягає 10— 15 см, щільність — 40—60 млн клітин в 1 мл. У разі використання природних джерел із сірководневою, субтермальною, сульфатно-натрієво-кальцієвою водою на 6—8 добу щільність культури досягає 90 млн клітин в 1 мл.
Рис.
1.
Головні
об'єкти масового
культивування
мікроводоростей:
/
— хлорела; 2
— 4 —
сценедесмус;
5,6
—
спіруліна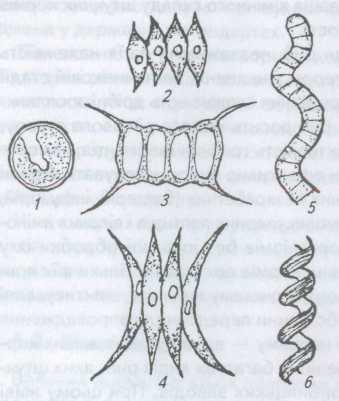
У культиваторах закритого типу місткістю 1,5 м3 з добавлянням до середовища стічних вод тваринницьких комплексів отримують культуру хлорели і спіруліни щільністю до 100 млн клітин в 1 мл, а з додаванням курячого посліду продуктивність їх зростає на 15—18 %. Виявлено досить тривалу стійкість спіруліни до азотного голодування (до 54 діб), після чого в разі вміщення її у насичене ним середовище процеси синтезу органічних сполук повністю відновлюються.
3.2. Культивування кормових безхребетних
3.2.1.Культивування гіллястовусих ракоподібних
Представники ряду гилястовусих (Cladocera) посідають одне з провідних місць за масштабами їх використання як живого корму для риб. З багатьох видів гилястовусих ракоподібних як об'єкти культивування на практиці використовують лише дафній (переважно Daphnia magna) і моїн ( Moina macrocopa, M.rectirostris), які характеризуються високою плодючістю, швидким ростом і витривалістю до несприятливих умов середовища. В останні роки позитивні результати отримано при культивуванні церіодафнії (Ceriodaphnia recticulata) і хідоруса (Chydorus sphaericus).
Для культивування гіллястовусих ракоподібних рекомендують використовувати бетонні басейни або невеликі стави завглибшки до 1м, які заливають водою з будь-якої прісної водойми. Оптимальна температура води для утримання рачків становить 15-25 0С, водневий показник рН – 6,8 -7,8, вміст кисню – не менше 3-6 мг/л, окислюваність води – 15-26 мг О2/л. Для стимулювання розвитку фіто - і бактеріопланктону, які споживаються рачками, вносять сухий кінський чи коров'ячий гній з розрахунку 0,5 -1 кг/м3 води, періодично невеликі дози суперфосфату та аміачної селітри.
Вихідну культуру рачків отримують кількома шляхами:
- відловлюють навесні у природних водоймах;
- з ефіпіальних яєць, які збирають пізно восени у природних водоймах, висушують і зберігають у сухому приміщенні за температури 1-50 С, а далі отримують з них вихідний матеріал;
- утримання маточного поголів'я рачків у водоймах завглибшки не менше 1,5 м із запобіганням їх замерзанню.
Початкова щільність маточної культури рачків має становити близько 10 г/м3. Зняття продукції культури розпочинають за біомаси від 300 г/м3, яка створюється залежно від умов на 10-25-ту добу вирощування. Розрідження слід проводити систематично, оскільки часткове видалення рачків підтримує постійний інтенсивний ріст культури.
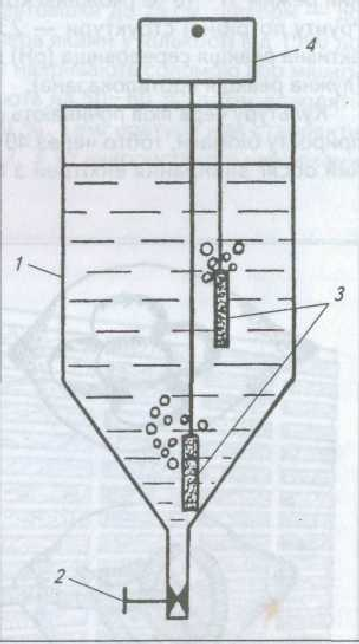
Рис.
2. Пристосований
інкубаційний
апарат для масового розведення
артемії:
/
— інкубаційна посудина; 2
—
зливний кран;
3
— дифузори;
4
—
компресор