
- •1. Естествознание. История естествознания.
- •2. Основные теории (концепции) естествознания.
- •1. Физика
- •5.Биология
- •3. Физика. Классическая механика.
- •4. Специальная теория относительности.
- •5. Общая теория относительности.
- •6. Квантовая физика. Гипотеза Планка. Уравнение Шредингера.
- •2. (Правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается один фотон.
- •7. Квантовая теория поля. Виртуальный механизм взаимодействия элементарных частиц. Спин.
- •8. Изотопический спин. Типы взаимодействий. Объединение типов взаимодействий.
- •9. Классификация элементарных частиц.
- •10. Калибровочная инвариантность. Спонтанное нарушение симметрии.
- •11. Иерархия познания и группа симметрий. Симметрия и законы сохранения.
- •12. Классическая космология.
- •13. Теория «инфляционной вселенной».
- •14. Химия. Стехиометрические законы. Строение атома. Заполнение электронных оболочек.
- •15. Взаимодействие между атомами и молекулами. Молекулярные связи.
- •16. Геология. Геологическое время и его измерение.
- •17. Строение Земли.
- •18. Эволюция Земли.
- •19. История развития геологических теорий.
- •20. Биология. Происхождение и эволюция жизни. Вещественная основа жизни.
- •21. Земля в период возникновения жизни.
- •22. Начало жизни на земле
- •23. Свойства живой системы.
- •24. Структура нуклеиновых кислот.
- •25. Структура и функции белков.
- •26. Строение и разновидности клеток.
- •27. Модели динамики популяций.
- •28.Эволюция. Теории эволюции.
- •Случайна ли эволюция?
- •29. Геобиологические циклы. Составляющие биосферы.
- •30. Адаптация популяций в биоценозах.
- •31. Ресурсы и численность населения Земли.
- •32. Основные понятия моделирования и математического моделирования.
- •33. Модель Франка сердечно-сосудистой системы.
- •34. Математическое моделирование фармакокинетических процессов. Основные понятия.
- •35. Фармакокинетические модели при различных способах введения лекарственных веществ.
- •1 Способ. Однократное введение лв (инъекция)
- •2 Способ. Непрерывное введение препарата с постоянной скоростью (инфузия).
- •3 Способ. Сочетание непрерывного введения лв(2 способ) с введением нагрузочной дозы (1 способ).
- •36. Траектория всплытия подводной лодки.
- •37. Колебания колец Сатурна.
- •38. Движение шарика, присоединенного к пружине.
- •39. Иерархия моделей. Различные варианты действия заданной внешней силы.
- •40. Движение точки крепления. Две пружины.
- •41. Учет сил трения.
- •42. Два типа нелинейных моделей системы «шарик-пружина».
- •43. Общая схема принципа Гамильтона.
- •44. Получение модели «шарик-пружина» с помощью принципа Гамильтона.
- •45. Колебание маятника в поле сил тяжести.
- •46. Использование принципа Гамильтона для построения моделей механических систем (добавление постоянной внешней силы в систему «шарик-пружина»).
- •47. Жидкость в u-образном сосуде.
- •48. Электрический колебательный контур.
- •49. Малые колебания при взаимодействии двух популяций.
- •50. Динамика скопления амеб.
14. Химия. Стехиометрические законы. Строение атома. Заполнение электронных оболочек.
Химия – наука о веществах, их свойствах, строении и превращениях, происходящих в результате химических реакций, а также фундаментальных законах, которым эти превращения подчиняются.
Химия:
-
классическая 1860 – 1930
-
современная (квантовая) химия 1930 - …
В период становления классической химии были открыты важные законы:
1) Закон сохранения масс вещества (Ломоносов) 1748 -1756
Масса веществ, вступивших в реакцию, равна массе, получившихся в результате реакции.
-
Закон постоянства состава (Пруст) 1801
Каждое чистое соединение независимо от его способа получения всегда имеет один и тот же состав.
-
Закон кратных отношений (Дальтон) 1803
Если 2 элемента могут образовывать между собой несколько соединений, то массовые доли любых из элементов из этих соединений относятся друг к другу как небольшие целые числа.
-
Закон Авогадро 1811
В равных объёмах газа при одинаковых условиях содержится одинаковое число молекул.
Число частиц равных числу Авогадро получило название моль – это единица количества вещества.
Квантовая химия Строение атома.
Атом - наименьшая частица химического элемента, обладающая всеми его свойствами. Атом состоит из + заряженного ядра. Ядро состоит из положительно заряженных протонов и нейтральных нейтронов. Вокруг ядра на значительном расстоянии находятся электроны, образующие электронное облако. Взаимодействуя, атомы могут образовывать молекулы.
Атомы неделимы химическим путём.
Состояние электрона в атоме определяется набором 4-х квантовых чисел:
1) главного n (=1,2,3,…)
2) Орбитального l (= 0,1,2,…n-1)
3) магнитное m (-l, -l+1, …, -1, 0, 1, …l)
4) магнитно - спиновое ns (1/2,-1/2)
Спиновое связано с вращением вокруг собственной оси.
Квантовые числа n, l характеризуют размер и форму электронного облака. Квантовое число n ориентацию электронного облака в пространстве.
Орбитальное квантовое число определяет величину момента импульса электрона в вакууме. Магнитное квантовое число определяет величину момента импульса в заданном направлении, то есть длина вектора будет определяться магнитным квантовым числом.
Квантовые числа – определяют форму окружности.
1) l=0,m=0 => s-электрон
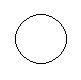
2)
m=+-1,
l=1
=> р – электрон
![]()
m=0,
l=1
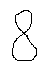
3) l=2 => d - электрон 4) l=3 => f – электрон 5) l=4 => g – электрон
Заполнение электронных оболочек:
1) Принцип запрета Паули (в одном и том же атоме не может быть более одного электрона с одинаковым набором 4-х квантовых чисел),
2) Принцип минимальной энергии (электроны заполняют обитали в порядке возрастания их энергии),
3)
Правило
Кличковского
(Заполнение электронами орбиталей в
атоме происходит в порядке возрастания
суммы главного и орбитального квантовых
чисел
![]() .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
![]() ),
),
4) Правило Гунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Совокупность электронов в многоэлектронном атоме, имеющих одно квантовое число n, называется электронной оболочкой. В каждой из оболочек электроны распределяются, как под оболочкой, соответствующему орбитальному числу. Номер оболочки соответствует количеству подоболочек в ней.
Электронные оболочки реальных атомов заполняются в соответствии с правилом Кличковского : по мере увеличения суммарного числа электронов в атомах (при возрастаний зарядов их ядер, или порядковых номеров химических элементов) атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра. Поэтому энергетическая последовательность орбиталей в водородоподобном атоме выглядит просто: 1s<2s=2p<3s=3p=3d<4s=4p=4d=4f<5s...
