
- •Тема1. Кинематические характеристики движения.
- •Тема2. Кинематические ур-я движ-я.Равнопеременное движение.
- •Тема3. Кинематика вращательного движения точки.
- •Тема4. Кинематика абсолютно твердого тела.
- •Тема5. Законы Ньютона
- •Тема6. Закон сохранения импульса.
- •Тема 7. Работа. Мощность. Энергия.
- •Тема 8. Динамика абсолютно твердого тела.
- •Тема 9. Закон сохранения момента импульса.
- •Тема 10. Силовые поля.
- •Тема 11. Принципы относительности в механике.
- •2)Относительность одновременности событий
- •3)Замедление хода движущихся часов
- •Тема 12. Молекулярно-кинетические представления о строении вещества.
- •Тема 13. Классическая статика.
- •Тема 14. Явление переноса в газах.
- •Тема 15. Основные понятия термодинамики. Первое начало термодинамики.
- •Тема 16. Второе начало термодинамики.
- •Тема 17. Реальные газы.
- •Тема 18. Конденсированное состояние вещества.
Тема 16. Второе начало термодинамики.
1. Дайте определение энтропии системы.
Энтропия S – одна из важнейших термодинамических функций, характеризующая состояние или возможные изменения состояния вещества.
Энтропия – это функция состояния.
Энтропия определяется следующим образом.
|
«Бесконечно малое изменение энтропии равно элементарному количеству теплоты, получаемому системой, отнесенному к температуре, при которой это тепло передается» |
|
|
конечное изменение энтропии. Величину Q/T называют приведенной теплотой, поэтому можно дать такое определение: изменение энтропии равно сумме приведенных теплот. |
|
|
2,3,4. Вычисление изменения энтропии в идеальных газах.
p=const изобарический |
|
V=const изохорический |
|
T=const изотермический |
|
адиабатический |
dQ=0 dS=0 S=const |
5. Энтропия мера рассеяния энергии. Энтропия мера беспорядочности. Термодинамическая вероятность, и ее связь с энтропией.
Энтропия мера рассеяния энергии.
|
запишем I начало термодинамики для обратимого изотермического процесса, учитывая, что Q=TdS и выразим работуА |
термодинамическая
функция
величина
|
|
Из формул можно сделать вывод, что в работу можно перевести не весь запас внутренней энергии системы U. Часть энергии TS нельзя перевести в работу, она рассеивается в окружающей среде. И эта «связанная» энергия тем больше, чем больше энтропия системы. Следовательно, энтропию можно назвать мерой рассеяния энергии. |
|
Энтропия – мера беспорядка системы
Термодинамическая вероятность показывает, сколькими микрораспределениями можно получить данное макрораспределение. Она вычисляется по формуле:
|
6. Второе начало термодинамики.
1)При любых
процессах, происходящих в теплоизолированной
системе, энтропия системы не может
убывать:
![]()
2) «Теплота не может сама собой переходить от менее нагретого к более нагретому телу»
3) «Невозможно построить вечный двигатель второго рода, т.е. такую периодически действующую машину, действие которой состояло бы только в поднятии груза и охлаждении теплового резервуара»
Обязательно должно быть еще тело, которому «придется» отдать часть теплоты. Просто отнимать тепло от некоторого тела и превращать его в работу невозможно потому, что такой процесс сопровождается уменьшением энтропии нагревателя. Следовательно, нужно еще одно тело – холодильник.
7. Круговые процессы (циклы). Цикл Карно. Вычисление КПД цикла Карно с использованием понятия энтропии. Реальные циклы, их КПД.
Круговым процессом или циклом называется такой процесс, при котором система, пройдя ряд состояний, возвращается в исходное состояние. Если процесс осуществляется по часовой стрелке, он называется прямым, против часовой стрелки – обратным.
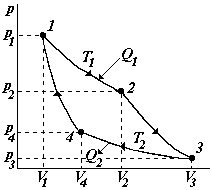 Устройство, в
котором затрачивается теплота, а
получается работа, называется тепловой
машиной. Все
тепловые машины работают по прямому
циклу, состоящему из различных процессов.
Устройство, работающее по обратному
циклу, называется холодильной
машиной.
Устройство, в
котором затрачивается теплота, а
получается работа, называется тепловой
машиной. Все
тепловые машины работают по прямому
циклу, состоящему из различных процессов.
Устройство, работающее по обратному
циклу, называется холодильной
машиной.
Рассмотрим цикл Карно для идеальной тепловой машины. Предполагается, что рабочее тело – идеальный газ, трение отсутствует. Этот цикл, состоящий из двух изотерм и двух адиабат.
1-2 изотермическое расширение |
|
сообщаемое тепло идет на работу газа |
|
2-3 адиабатическое расширение
|
|
газ совершает работу за счет внутренней энергии |
|
3-4 изотермическое сжатие |
|
внешние силы сжимают газ, передавая теплоту окружающей среде |
|
4-1 адиабатическое сжатие
|
|
над газом совершается работа, его внутренняя энергия увеличивается |
|
( |
полная работа за цикл; на графике полная А равна площади, охватываемой кривой 1-2-3-4-1 |
||
Таким образом, за цикл газу было сообщено Q1 теплоты, холодильнику передано Q2 теплоты и получена работа А.
|
работа, полученная за один цикл |
Т1 – температура нагревателя Т2 – температура холодильника |
КПД цикла Карно – это максимально возможный КПД тепловых машин. |
