
- •Содержание
- •I.Введение
- •II. Цели и задачи
- •III. Объекты исследования
- •Информационный блок
- •Недоброкачественные лекарственные средства
- •Данные о результатах мониторинга качества лекарственных средств в 2011 году
- •Продукции за 2011 год
- •Лекарственных средств по объему забракованной продукции за 2011 год
- •Продукции за 2011 год
- •Фальсифицированные лекарственные средства
- •Факторы, способствующие фальсификации лекарственных средств
- •Основные виды фальсификации:
- •2.3. Наиболее часто подделываемые категории препаратов
- •2.5. Данные о фальсифицированных и контрафактных лекарственных срествах, выявленных в обращении на территории российской федерации в 2011 году
- •Лекарственных препаратов, выявленных за 2011 год, по странам выпуска оригинальных препаратов
- •Контрафактные лекарственные средства
- •Спектроскопические методы
- •Электромагнитное излучение
- •Классификация методов спектроскопии Атомная спектроскопия
- •2. Молекулярно - спектроскопические методы
- •Молекулярная абсорбционная спектроскопия
- •Варианты спектрофотометрии
- •Идентификация лекарственных веществ и определение посторонних примесей
- •Количественный анализ лекарственных веществ
- •1) По отношению относительных оптических плотностей анализируемого (δАх) и стандартных образцов (δАст):
- •Спектрометрия в инфракрасной области
- •Подготовка проб
- •Интерпретация спектров
- •Хроматограмма и хроматографичеcкие параметры
- •Основные приборы и материалы:
- •Хроматографические пластинки
- •Хроматографические камеры
- •Подвижные фазы (пф)
- •Нанесение проб
- •Способы элюирования
- •Восходящая хроматография
- •Способы обнаружения
- •Техника эксперимента в тсх
- •Приготовление подвижной фазы
- •Насыщение хроматографической камеры
- •Самостоятельная работа студента
- •Требования к оформлению реферата
- •Рекомендуемая структура реферата
- •Статьи из трудов, материалов конференций, съездов, совещаний, газет
- •Интернет-ресурс:
- •Рекомендуемая литература
- •Темы рефератов
- •Отличительные признаки фальсифицированного лекарственного препарата "Бисептол, таблетки 480 мг (блистеры) № 20" серии 120906:
Государственное бюджетное образовательное учреждение
высшего профессионального образования
«Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития
Российской Федерации
КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
для студентов 3 курса (6 семестр) по дисциплине С3.Б.9 – «Фармацевтическая химия» (очная форма обучения)
«Использование физико-химических методов
анализа для выявления фальсифицированных
и недоброкачественных лекарственных средств »
Пятигорск 2012
УДК 615.2/.3.07 : 543.05/.08(076.5)
ББК 52 87 я 73 – 24.4
М-54
Рецензент: доцент, к.ф.н. каф. фарм. химии О.М. Маркова
Е.Н. Вергейчик, А.Б. Саморядова, Е.И.Хартюнова
М-54 Методические указания предназначены для подготовке студентов к лабораторным занятиям для студентов 3 курса (6 семестр) по дисциплине С3.Б.9 – «Фармацевтическая химия» (очная форма обучения) / Вергейчик Е.Н, Саморядова А.Б., Хартюнова Е.И.– Пятигорск: Пятигорская ГФА, 2012. - 34 с.
УДК 615.2/.3.07 : 543.05/.08(076.5)
ББК 52 87 я 73 – 24.4
Допущено к внутривузовскому изданию.
Председатель ЭМС В.В.Гацан
Протокол №
© Пятигорская государственная фармацевтическая академия, 2012.
Содержание
Введение …………………………………………..…….4
II. Цели и задачи ………………………………………..…....9
III. Объекты исследования…………………………….…....10
IV. Информационная часть…………………………………11
VСамостоятельная работа студентов на занятиях.............. 60
I.Введение
Одной из приоритетных задач в области здравоохранения страны является обеспечение качества лекарственных средств, находящихся в обращении, т.к. качество и безопасность лекарственных средств во многом определяет эффективность оказываемой населению медицинской помощи.
Стратегией национальной безопасности Российской Федерации до 2020 года, утвержденной Указом Президента Российской Федерации в мае 2009 года, в сфере здравоохранения обозначены следующие цели:
- совершенствование стандартов медицинской помощи;
- контроль качества, эффективности и безопасности лекарственных средств.
В соответствии с полномочиями, возложенными Постановлением Правительства Российской Федерации от 30 июня 2004 г. №323, контроль за качеством лекарственных средств осуществляется Федеральной службой по надзору в сфере здравоохранения и социального развития, включающей центральный аппарат Росздравнадзора (161 человек) и 79 его территориальных управлений (1 528 человек).
Созданная Росздравнадзором в 2004 г. система государственного контроля качества лекарственных средств позволяет своевременно выявлять и изымать из обращения лекарственные средства, качество которых не отвечает установленным требованиям.
Данная система включает:
экспертизу качества лекарственных средств, находящихся в обращении, на соответствие требованиям, установленным в стандарте качества при регистрации (проводится выборочно);
мониторинг безопасности лекарственных препаратов, находящихся в обращении (фармаконадзор);
контроль за выявлением и изъятием контрафактных лекарственных средств.
инспекционный контроль в отношении субъектов обращения лекарственных средств (производителей, дистрибьюторов, организаций розничной торговли, медицинских организаций, учреждений социальной защиты, образовательных и дошкольных учреждений).
Система контроля качества лекарственных средств помимо Центрального аппарата Росздравнадзора включает:
территориальные Управления Росздравнадзора;
испытательные лаборатории;
единая информационная система Росздравнадзора и его территориальных органов.
система качества в организациях-производителях лекарственных средств, розничных и оптовых фармацевтических организациях.
Единая информационная система Росздравнадзора (АИС Росздравнадзора) включает сведения:
о недоброкачественных лекарственных средствах;
о фальсифицированных и контрафактных лекарственных средствах;
о нежелательных реакциях на лекарственные препараты, зарегистрированные в Российской Федерации, а также на лекарственные препараты, изучаемые в ходе клинических исследований;
о результатах выборочного контроля качества лекарственных средств.
Информация о выявлении недоброкачественных, фальсифицированных и контрафактных лекарственных средствах, подлежащих изъятию из гражданского оборота, публикуется Росздравнадзором на официальном сайте и является доступной для всех субъектов обращения лекарственных средств и населения.
Увеличение объема фармацевтического рынка, ассортимента лекарственных средств, количества вновь регистрируемых препаратов, количества участников обращения лекарственных средств, сформировали необходимость повышения потенциала надзорного органа в сфере обращения медицинской продукции и реформирования системы государственного контроля за качеством, эффективностью и безопасностью лекарственных средств.
С целью повышения эффективности государственного контроля качества лекарственных средств в Российской Федерации Федеральной службой по надзору в сфере здравоохранения и социального развития осуществляется реформирование системы государственного контроля лекарственных средств.
Основные элементы реформирования:
- создание современных лабораторных комплексов в каждом федеральном округе;
- внедрение неразрушающих экспресс-методов контроля качества лекарственных средств;
- организация передвижных экспресс-лабораторий на базе лабораторных комплексов.
В целях проведения скрининга качества лекарственных средств на базе ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздравнадзора в 2011 году продолжена работа по формированию библиотеки спектров на лекарственные средства, зарегистрированные на территории Российской Федерации. В настоящее время библиотека спектров лекарственных средств включает 39892 спектра на 262 наименования лекарственных средств, из них - 33195 спектров 225 наименований лекарственных средств для неразрушающего контроля качества.
В 2011 году в рамках выборочного контроля качества отбор образцов лекарственных средств осуществлялся не только у организаций-производителей и импортеров лекарственных средств, но и в аптечных, оптовых фармацевтических, медицинских организациях, а также в организациях социальной защиты (рис. 1.).
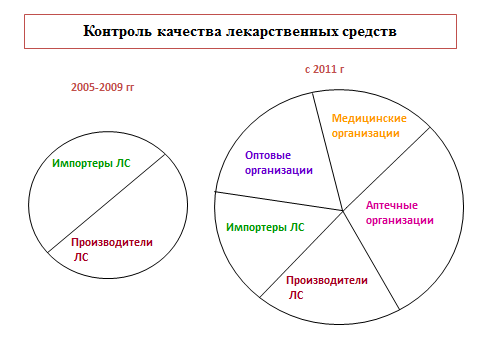
Рисунок 1.
Перечисленные преобразования системы государственного контроля качества лекарственных средств позволили в пределах выделенного бюджетного финансирования увеличить объем выборочного контроля качества лекарственных средств до 6,6% от общего количества серий, поступивших в обращение, что в три раза превышает показатель 2010 года.
В результате экспертизы качества в рамках выборочного контроля качества в 2011 году выявлено и изъято из обращения в 4,5 раза больше недоброкачественных лекарственных средств по сравнению с 2010 годом (по количеству серий).
В то же время, в 2011 году наблюдается тенденция к уменьшению уровня недоброкачественных лекарственных средств, выявляемых на территории Российской Федерации от общего количества серий, поступающих в обращение: от 0,6% (2010 г.) до 0,4%.
