
- •Предисловие
- •1. Физиологические основы мышечной деятельности
- •1.1. Ультраструктура скелетного мышечного волокна
- •Контрольные вопросы
- •1.2 Двигательные единицы
- •Контрольные вопросы
- •1.3. Типы мышечных волокон
- •1) Характеру сокращения:
- •2) Скорости сокращения:
- •3) Типу окислительного обмена:
- •Контрольные вопросы
- •1.4. Нервно-мышечная передача
- •Контрольные вопросы
- •1.5. Механизм мышечного сокращения
- •Контрольные вопросы
- •1.6. Химические и тепловые процессы при сокращении мышц
- •1. Анаэробные пути ресинтеза атф:
- •Теплообразование при мышечном сокращении
- •Контрольные вопросы
- •1.7. Режимы и виды мышечного сокращения
- •Виды мышечных сокращений
- •Контрольные вопросы
- •1.8. Показатели деятельности мышц
- •1) Внутримышечные факторы
- •2) Особенности нервной регуляции
- •3) Психофизиологические механизмы
- •Контрольные вопросы
- •1.9. Утомление мышц
- •Контрольные вопросы
- •1.10. Рабочая гипертрофия мышц
- •1) Саркоплазматический
- •2) Миофибриллярный
- •Контрольные вопросы
- •1.11. Оценка функционального состояния мышечной системы у человека
- •Контрольные вопросы
- •1.12. Влияние гипокинезии и гиподинамии на структуру и функцию мышц
- •Контрольные вопросы
- •1.13. Тестовые задания
- •1.14. Ситуационные задачи
- •2. Биохимические основы мышечной деятельности
- •2.1. Особенности химического состава поперечно-полосатых мышц
- •Контрольные вопросы
- •2.2. Этапы катаболизма пищевых веществ
- •Контрольные вопросы
- •2.3. Значение пирувата в катаболизме пищевых веществ
- •Количественное определение пировиноградной кислоты в моче колориметрическим методом по Умбрайту
- •Определение пирувата в крови
- •Контрольные вопросы
- •2.4. Биохимические основы функционирования фосфагенного пути ресинтеза аденозинтрифосфата
- •Определение креатинина в моче
- •Образование аммиака в мышцах
- •Контрольные вопросы
- •2.5. Биохимические основы функционирования лактацидного пути ресинтеза аденозинтрифосфата
- •Количественное определение молочной кислоты в сыворотке крови по реакции Уффельмана
- •Контрольные вопросы
- •2.6. Биохимические основы функционирования аэробных путей ресинтеза аденозинтрифосфата
- •2 Пируват
- •2 Ацетил-КоА
- •Особенности окисления ненасыщенных жирных кислот
- •Методика расчета количества атф, образующейся при окислении жирных кислот на примере пальмитиновой кислоты (с16)
- •Методика расчета количества атф при окислении таг (на примере трипальмитата)
- •Определение уровня общих липидов в плазме (сыворотке) крови по цветной реакции с сульфофосфованилиновым реактивом
- •Контрольные вопросы
- •2.7. Роль липидного обмена в адаптации к мышечной деятельности
- •Контрольные вопросы
- •2.8. Роль гормонов в обеспечении мышечной деятельности
- •Контрольные вопросы
- •2.9. Тестовые задания
- •2.10. Ситуационные задачи
- •3. Эталоны ответов к тестовым заданиям и ситуационным задачам
- •6. Рекомендуемая литература
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНАЛЬНОГО ОБРАЗОВАНИЯ
«КИРОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КАФЕДРА НОРМАЛЬНОЙ ФИЗИОЛОГИИ
КАФЕДРА ХИМИИ
ФИЗИОЛОГО-БИОХИМИЧЕСКИЕ ОСНОВЫ
МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
Киров, 2012
УДК 612.73/.74:577.1 (075.8)
БКК 28.073я73+28.072я73
Ф 50
Печатается по решению центрального методического совета Кировской государственной медицинской академии (протокол № 5) от 16 февраля 2012 года.
Физиолого-биохимические основы мышечной деятельности: учебное пособие для студентов медицинских вузов / составители: А.В. Еликов, И.А. Частоедова, Н.Ф. Камакин, П.И. Цапок – Киров: Кировская государственная медицинская академия, 2012. – 103 с.
Настоящее пособие представляет собой руководство для организации самостоятельной аудиторной и внеаудиторной работы студентов медицинских вузов по одному из разделов, изучаемых в медицинском вузе – основ мышечной деятельности и тренированности организма. Для активного овладения изучаемым материалом студентам предлагаются обучающие тесты и ситуационные задачи. Пособие предназначено для студентов медицинских вузов по специальностям: «Лечебное дело», «Педиатрия» и «Стоматология».
Рецензенты:
Директор института медико-биологических проблем,
зав.кафедрой физиологии Тернопольского государственного медицинского университета д.м.н., профессор С.Н. Вадзюк
Зав.кафедрой биохимиии ГБОУ ВПО «Пермская государственная медицинская академия» Минздравсоцразвития РФ д.м.н., профессор Н.А. Терехина
© Еликов А.В., Частоедова И.А., Камакин Н.Ф., Цапок П.И. - Киров, 2012
© ГБОУ ВПО Кировская ГМА Минздравсоцразвития России, 2012
СОДЕРЖАНИЕ
Предисловие………………………………………………………………………….4
1.Физиологические основы мышечной деятельности…………………………….5
1.1. Ультраструктура скелетного мышечного волокна…...……………….......5
1.2.Двигательные единицы……………………………………………………..11
1.3.Типы мышечных волокон…………………………………………………..13
1.4.Нервно-мышечная передача………………………………………………..16
1.5.Механизм мышечного сокращения………………………………………..20
1.6.Химические и тепловые процессы при сокращении мышц………….......24
1.7.Режимы и виды мышечного сокращения………………………………….31
1.8.Показатели деятельности мышц……………………………………….......35
1.9.Утомление мышц……………………………………………………………41
1.10.Рабочая гипертрофия мышц………………………………………………43
1.11.Оценка функционального состояния мышечной системы
у человека ……………………………………………………………………….46
1.12.Влияние гипокинезии и гиподинамии на структуру
и функцию мышц…………………………………………….………………….48
1.13. Тестовые задания ………………………….…………….………………..50
1.14. Ситуационные задачи…………………………………………………….52
2. Биохимические основы мышечной деятельности……………………………..53
2.1.Особенности химического состава поперечно-полосатых мышц……….53
2.2.Этапы катаболизма пищевых веществ…………………………………….55
2.3.Значение пирувата в катаболизме пищевых веществ…………….………57
2.4.Биохимические основы функционирования фосфагенного
пути ресинтеза аденозинтрифосфата.…………………………………………62
2.5.Биохимические основы функционирования лактацидного
пути ресинтеза аденозинтрифосфата ……...…….…………………………….68
2.6.Биохимические основы функционирования аэробных
путей ресинтеза аденозинтрифосфата………………………………………....74
2.7.Роль липидного обмена в адаптации к мышечной деятельности………..82
2.8.Роль гормонов в обеспечении мышечной деятельности…………………84
2.9.Тестовые задания………………………………………………………........86
2.10.Ситуационные задачи……..……………….………...…………………….89
3.Эталоны ответов к тестовым заданиям и ситуационным задачам………........90
4.Рекомендуемая литература……………….……………………………….…......93
5.Приложения……………………………………..………….………………..........94
Предисловие
Значительнейшее место в жизнедеятельности человека занимают движения. В соответствии с Государственным образовательным стандартом высшего профессионального образования (Москва, 2010) преподавание нормальной физиологии и биологической химии ориентировано на конечные цели обучения: создать прочную теоретическую базу, необходимую для усвоения медико-биологических и клинических дисциплин. В соответствии с учебной программой по нормальной физиологии и биологической химии на основе современных научных представлений формируется понимание механизмов участия мышечной системы в поддержании гомеостаза организма и формируется представление о путях адаптации к мышечной деятельности. При составлении данного пособия учтен большой опыт преподавания нормальной физиологии и биологической химии студентам высших образовательных медицинских учреждений России и зарубежья. Представлены критерии собственного функционального состояния и степени тренированности. Мы будем благодарны за любые замечания и пожелания, направленные на улучшение данного пособия.
1. Физиологические основы мышечной деятельности
Взаимодействие человека с внешней средой не возможно представить без его мышечной системы. Производимые движения скелетной мускулатурой необходимы как для выполнения простейших перемещений тела в пространстве, сложных манипуляций хирурга, стоматолога, выражения самых тонких чувств и мыслей с помощью речи, мимики, жестов. У человека более 600 скелетных мышц. Масса мышц больше чем других органов и составляет: у мужчин – 42% веса тела, у женщин – 35%, в пожилом возрасте – 30%, у спортсменов – 45-52%. Более 50% веса всех мышц расположено на нижних конечностях. Скелетные мышцы обеспечивают осознанные и осознаваемые произвольные движения тела и его частей. При этом мышцы выполняют следующие функции:
1) обеспечивают определенную позу тела человека;
2) перемещают тело в пространстве;
3) перемещают отдельные части тела относительно друг друга;
4) являются источником тепла, выполняя терморегуляционную функцию.
1.1. Ультраструктура скелетного мышечного волокна
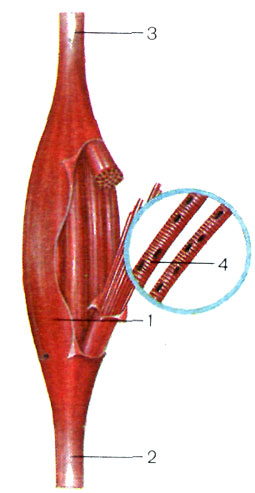
Термин «мышца» относится к группе мышечных волокон, связанных соединительной тканью (рис. 1).
Каждое волокно - это клетка цилиндрической формы диаметром 10-100 мкм и длиной от 5 до 400 мкм. В некоторых мышцах одиночные волокна имеют такую же протяженность, как и вся мышца, но в большинстве случаев они короче и часто располагаются под углом к продольной оси мышцы. Мышечное волокно имеет клеточную мембрану - сарколемму. В саркоплазме (цитоплазме) мышечного волокна имеются многочисленные ядра, митохондрии, растворимые белки (миоглобин), капельки жира, гранулы гликогена, фосфатсодержащие вещества, другие малые молекулы, а также ионы.

Рис. 1. Строение скелетной мышцы
Волокно скелетной мышцы так велико, что потенциал действия, распространяющийся по поверхностной мембране почти не вызывает тока в глубине волокна. Однако для максимального мышечного сокращения ток должен проникать глубоко в мышечное волокно, подходя как можно ближе к отдельным миофибриллам. Это обеспечивается проведением ПД по поперечным Т- трубочкам, которые пересекают мышечное волокно и связывают сарколемму с внутриклеточным пространством и саркоплазматическим ретикулумом. Саркоплазматический ретикулум имеет своеобразное строение. Он состоит из двух основных частей: 1) длинных продольных трубочек, со всех сторон окружающих сократительные миофибриллы и 2) больших камер, называемых терминальными цистернами, которые прилежат к Т-трубочкам. Поперечные Т-трубочки - это впячивания саркоплазмы внутрь клетки. К ним примыкают продольные трубочки с цистернами. Благодаря этому, потенциал действия может распространяться от сарколеммы на систему саркоплазматического ретикулума. В латеральных цистернах ретикулума депонируется Са2+.
В мышечном волокне содержится более 1000 миофибрилл, расположенных вдоль него. Каждая миофибрилла состоит из протофибрилл или миофиламентов. Это нити сократительных белков актина и миозина. Миозиновые протофибриллы толстые, актиновые тонкие. Каждая миофибрилла содержит около 1500 толстых и 3000 тонких нитей. У скелетного мышечного волокна при световой микроскопии видна поперечная исчерченность, т.е. чередование светлых и темных полос (рис. 2). Она определяется регулярным чередованием в миофибриллах различно преломляющих поляризованный свет участков (дисков) — изотропных и анизотропных: светлые (Isotropic, I–диски) и тёмные (Anisotropic, А–диски) диски.
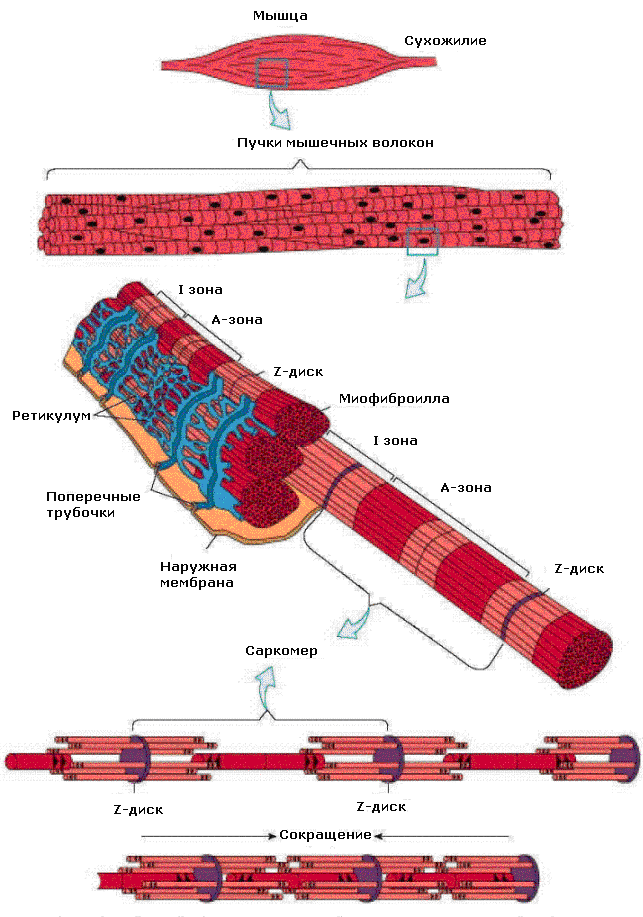
Рис. 2. Ультраструктура скелетного мышечного волокна
В А-дисках сосредоточены нити миозина, I-диски образованы нитями актина. В центре I-дисков видна тонкая Z-линия. Участок миофибрилы между соседними Z-линиями называется саркомером. Это структурный элемент миофибрилл. Длина саркомера обычно лежит в пределах 2—3 мкм. В покое толстые миозиновые нити лишь на небольшое расстояние входят в промежутки между актиновыми. Поэтому в средней части А-диска имеется более светлая Н-зона, где нет актиновых нитей. При электронной микроскопии в центре Н-полоски обнаружена М-линия — структура, которая удерживает нити миозина.
Кроме того, от Z- пластинки к М-линии идут филаменты белка титина, связанные одновременно с белками М-линии и толстыми филаментами. При световой микроскопии было замечено, что в момент сокращения ширина А-диска не уменьшается, а I-диски и Н-зоны саркомеров суживаются. Это послужило основанием для создания теории, объясняющей сокращение мышцы механизмом скольжения (теория скольжения) тонких актиновых нитей вдоль толстых миозиновых.
Миозин представляет собой крупный белок, состоящий из шести полипептидных цепей, уложенных попарно. Молекула миозина представляет собой тело из тяжелого меромиозина и головку - из легкого меромиозина (рис. 3).
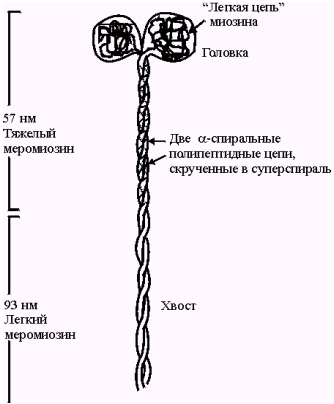
Рис 3. Схема строения молекулы миозина в виде двойной глобулярной головки и длинного тонкого хвоста.
Миозин имеет два шарнирных участка, позволяющих молекуле изменять конформацию. Один шарнирный участок находится в области соединения тяжёлого и лёгкого меромиозинов, другой — в области шейки молекулы миозина (рис. 4). Хвост каждой молекулы миозина располагается вдоль оси толстого филамента, а две глобулярные головки выступают по бокам в виде поперечных мостиков. На каждой из них находятся по два участка связывания – один для актина, другой для АТФ. Участки связыавния АТФ обладают также свойствами фермента АТФазы, гидролизирующей молекулу АТФ. Половина молекул миозина обращена головками к одному концу нити, а вторая половина — к другому. Лёгкий меромиозин лежит в толще толстой нити, тогда как тяжёлый меромиозин (благодаря шарнирным участкам) выступает над её поверхностью. Взаимодействие толстых и тонких нитей осуществляется благодаря выступам молекул миозина (поперечным мостикам).
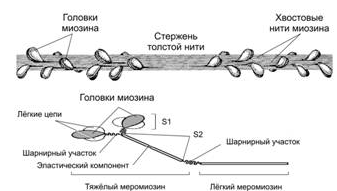
Рис. 4. Строение миозина
Актиновые филаменты представлены тяжами фибриллярного актина (F- актина), на котором нанизаны отдельные глобулы мономера актина (G- актина), как бусы. На каждой молекуле актина есть участок связывания миозина. В продольных бороздках актиновой спирали располагаются нитевидные молекулы белка тропомиозина. С шагом, равным 40 нм, к молекуле тропомиозина прикреплена молекула другого белка — тропонина (рис. 5)

Рис. 5. Строение актина
Молекулы тропомиозина частично прикрывают участки связывания каждой молекулы актина, мешая контакту с ними поперечных мостиков. Тропонин представляет собой глобулярный белок, состоящий из трех субъединиц: 1- тропонин С, связывающий ионы Са2+, 2-тропонин I, связанный с тропонином Т и актином и тропонин Т, который прикрепляется к С-концу тропомиозина и связывает тропонин I и тропонин С с тропомиозином (рис. 6).
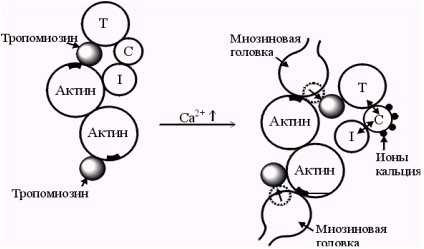
Рис. 6. Механизм действия регуляторных белков мышцы
Тропонин и тропомиозин играют важную роль в механизмах взаимодействия актина и миозина.
