
- •Модуль 2. Молекулярная физика Лекция 1
- •2.1. Статистический и термодинамический методы описания свойств
- •Макроскопических систем
- •2.2. Функции распределения
- •2.2.1. Общий подход
- •2.2.2. Функция распределения молекул идеального газа по модулю скорости молекул
- •2.2.3. График функции распределения молекул идеального газа по модулю скорости для двух температур
- •2.2.4. Функция распределения молекул идеального газа по кинетическим энергиям поступательного движения молекул
- •2.2.5. Средние характеристики молекул
- •Лекция 2
- •2.3. Основное уравнение мкт идеального газа для давления
- •2.4. Молекулярно-кинетический смысл температуры
- •2.5. Распределение Больцмана
- •2.5.1. Функция распределения Больцмана
- •2.5.2. Барометрическая формула
- •*2.7. Экспериментальная проверка распределения молекул по модулю скорости. Опыт Ламмерта
- •*2.8. Опыты Перрена по определению постоянной Авогадро
- •2.9. Основные понятия равновесной термодинамики
- •Лекция 3
- •2.10. Внутренняя энергия системы, работа, теплообмен
- •2.10.1. Внутренняя энергия системы
- •2.10.2. Работа
- •2.10.3. Теплообмен, теплоемкость системы
- •2.11. Первый закон (начало) термодинамики
- •2.12. Второе начало (закон) термодинамики. Термодинамические формулировки
- •2.13. Энтропия в термодинамике
- •Лекция 4
- •2.14. Качественный пример изменения энтропии при неравновесном процессе
- •2.15. Коэффициент полезного действия (кпд) идеального теплового двигателя
- •2.16. Число степеней свободы молекулы. Закон о равномерном распределении энергии по степеням свободы. Теплоемкость идеального газа
- •2. Молекула, состоящая из двух атомов
- •2.17. Применение первого и второго закона термодинамики к изопроцессам в идеальном газе
- •Лекция 5 *2.18. Примеры расчета изменения энтропии для неравновесных процессов.
- •2.19. Термодинамическая вероятность. Статистический смысл понятия энтропии.
- •2.20. Оценка термодинамической вероятности неравновесного и равновесного состояний.
- •Лекция 6
- •2.23. Основы физической кинетики
- •2.23.1. Уравнения для явлений переноса. Линейная неравновесная термодинамика
- •2.23.2. Формулы для коэффициентов переноса в случае идеального газа
- •2. Формулы для коэффициентов переноса
- •2.23.3. Зависимость коэффициентов переноса от параметров состояния идеального газа при протекании различных изопроцессов в идеальном газе
- •Лекция 7
- •2.24. Реальные газы. Уравнение Ван – дер - Ваальса
- •2.25. Экспериментальные и теоретические изотермы для реальных газов. Критическая точка
- •2.26. Внутренняя энергия реального газа
- •2.27. Жидкое состояние. Строение жидкости
Лекция 4
2.14. Качественный пример изменения энтропии при неравновесном процессе
Пусть
газ под поршнем расширяется из состояния
1 (объем газа
![]() )
в состояние 2 (объем газа
)
в состояние 2 (объем газа![]() )
с помощью равновесного (обратимого)
процесса (сплошная линия на диаграмме
рис. 2,10,б) и неравновесного (необратимого)
процесса (пунктирная линия на рис.
2.10,б).
)
с помощью равновесного (обратимого)
процесса (сплошная линия на диаграмме
рис. 2,10,б) и неравновесного (необратимого)
процесса (пунктирная линия на рис.
2.10,б).
Отметим, что для неравновесного расширения газа в формуле для
работы (2.40) необходимо брать внешнюю силу, которая действует на поршень с внешней стороны, а не силу давления газа, как при равновесном процессе расширения. Неравновесный процесс расширения происходит с конечной скоростью, поэтому внешняя сила будет меньше силы давления газа на поршень и работа неравновесного расширения будет меньше работы при равновесном его расширении
![]() .
(2.48)
.
(2.48)
В крайнем случае, случае расширения газа в пустоту, она будет равна нулю.
Давление газа как параметр его состояния при неравновесном процессе не будет иметь определенного значения для всего газа - непосредственно под поршнем он будем принимать наименьшие значения. В связи с этим неравновесный процесс нельзя изображать на диаграммах состояния, его можно обозначить, например, пунктирной линией (рис. 2.10,б).
При
достижении поршнем конечного объема
![]() неравновесный процесс заканчивается.
Затем протекает процесс, переводящий
газ из неравновесного состояния в
равновесное состояние, при этом процессе
изменение энтропии будет положительным
(
неравновесный процесс заканчивается.
Затем протекает процесс, переводящий
газ из неравновесного состояния в
равновесное состояние, при этом процессе
изменение энтропии будет положительным
(![]() ).
Действительно, запишем первый закон
термодинамики для равновесного
(обратимого) и неравновесного (необратимого)
процессов перехода газа из состояния
1 в состояние 2
).
Действительно, запишем первый закон
термодинамики для равновесного
(обратимого) и неравновесного (необратимого)
процессов перехода газа из состояния
1 в состояние 2
![]() .
.
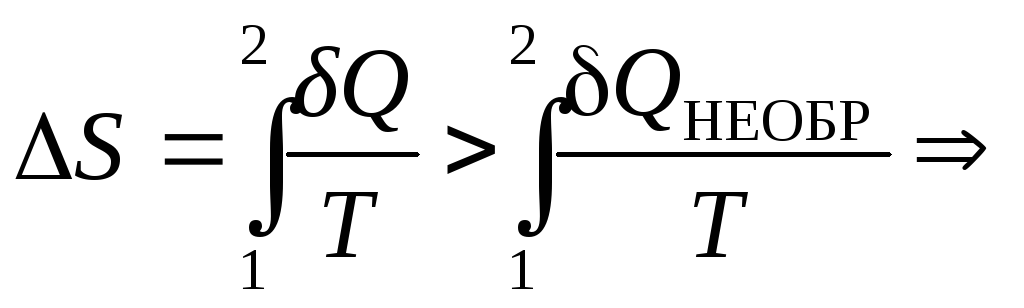
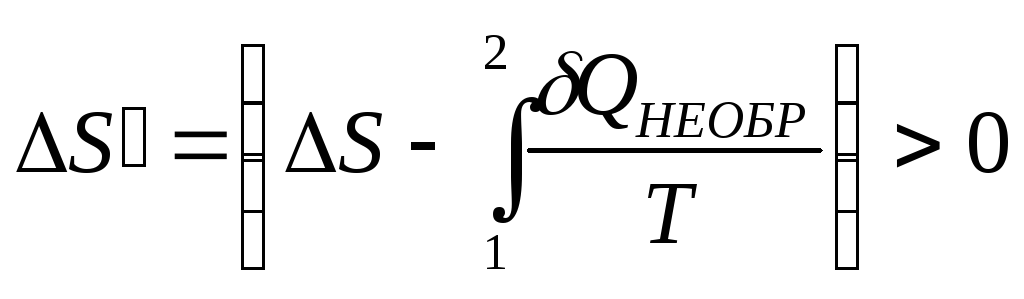 ,
,
![]() .
(2.49).
.
(2.49).
В итоге изменение энтропии будет одинаковым для двух процессов перехода (энтропия является функцией состояния системы), а интегралы от приведенной теплоты будут различаться.
Для
замкнутой системы, в которой в начальный
момент времени было неравновесное
состояние, изменение энтропии будет
больше нуля (из формулы (2.49) следует
![]() ).
).
Рассмотренный пример подтверждает формулу (2.46), но не является доказательством второго начала термодинамики, этот закон не доказывается, он является следствием опытных данных.
2.15. Коэффициент полезного действия (кпд) идеального теплового двигателя
1.
Максимальный КПД. Оказывается,
что энтропия позволяет получить формулу
для максимального КПД идеального
теплового двигателя. Если взять круговые
процессы, для которых разность между
максимальной и минимальной температурой
будет одинаковой, то среди них максимальный
КПД будет у теплового двигателя,
работающего по циклу Карно. Такой
двигатель назвали идеальным. Цикл Карно
состоит из двух изотерм и двух адиабат,
его графики в координатах (![]() )
и (
)
и (![]() )
приведены на рис. 2.11,а, б.
)
приведены на рис. 2.11,а, б.
Рассчитаем КПД идеального теплового двигателя. Для этого выделим отдельные вклады в изменении энтропии рабочего тела (газ) и учтем, что изменение энтропии рабочего тела (газа) на замкнутом цикле будет равно нулю
![]()
![]() .
(2.50)
.
(2.50)
Из полученной формулы (2.50) следует, что КПД обратимого цикла Карно не зависит от природы рабочего тела.
