
- •Модуль 2. Молекулярная физика Лекция 1
- •2.1. Статистический и термодинамический методы описания свойств
- •Макроскопических систем
- •2.2. Функции распределения
- •2.2.1. Общий подход
- •2.2.2. Функция распределения молекул идеального газа по модулю скорости молекул
- •2.2.3. График функции распределения молекул идеального газа по модулю скорости для двух температур
- •2.2.4. Функция распределения молекул идеального газа по кинетическим энергиям поступательного движения молекул
- •2.2.5. Средние характеристики молекул
- •Лекция 2
- •2.3. Основное уравнение мкт идеального газа для давления
- •2.4. Молекулярно-кинетический смысл температуры
- •2.5. Распределение Больцмана
- •2.5.1. Функция распределения Больцмана
- •2.5.2. Барометрическая формула
- •*2.7. Экспериментальная проверка распределения молекул по модулю скорости. Опыт Ламмерта
- •*2.8. Опыты Перрена по определению постоянной Авогадро
- •2.9. Основные понятия равновесной термодинамики
- •Лекция 3
- •2.10. Внутренняя энергия системы, работа, теплообмен
- •2.10.1. Внутренняя энергия системы
- •2.10.2. Работа
- •2.10.3. Теплообмен, теплоемкость системы
- •2.11. Первый закон (начало) термодинамики
- •2.12. Второе начало (закон) термодинамики. Термодинамические формулировки
- •2.13. Энтропия в термодинамике
- •Лекция 4
- •2.14. Качественный пример изменения энтропии при неравновесном процессе
- •2.15. Коэффициент полезного действия (кпд) идеального теплового двигателя
- •2.16. Число степеней свободы молекулы. Закон о равномерном распределении энергии по степеням свободы. Теплоемкость идеального газа
- •2. Молекула, состоящая из двух атомов
- •2.17. Применение первого и второго закона термодинамики к изопроцессам в идеальном газе
- •Лекция 5 *2.18. Примеры расчета изменения энтропии для неравновесных процессов.
- •2.19. Термодинамическая вероятность. Статистический смысл понятия энтропии.
- •2.20. Оценка термодинамической вероятности неравновесного и равновесного состояний.
- •Лекция 6
- •2.23. Основы физической кинетики
- •2.23.1. Уравнения для явлений переноса. Линейная неравновесная термодинамика
- •2.23.2. Формулы для коэффициентов переноса в случае идеального газа
- •2. Формулы для коэффициентов переноса
- •2.23.3. Зависимость коэффициентов переноса от параметров состояния идеального газа при протекании различных изопроцессов в идеальном газе
- •Лекция 7
- •2.24. Реальные газы. Уравнение Ван – дер - Ваальса
- •2.25. Экспериментальные и теоретические изотермы для реальных газов. Критическая точка
- •2.26. Внутренняя энергия реального газа
- •2.27. Жидкое состояние. Строение жидкости
2.16. Число степеней свободы молекулы. Закон о равномерном распределении энергии по степеням свободы. Теплоемкость идеального газа
Ч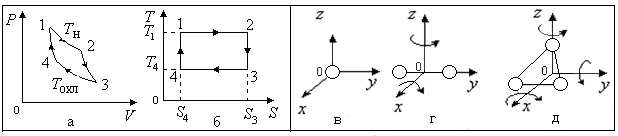 ислом
ислом![]() степеней свободы в механике называют
число независимых между собой возможных
перемещений механической системы,
оно зависит от числа материальных точек,
образующих систему, а также от числа и
характера
степеней свободы в механике называют
число независимых между собой возможных
перемещений механической системы,
оно зависит от числа материальных точек,
образующих систему, а также от числа и
характера
Рис. 2.11
наложенных на систему механических связей. За счет возбуждения таких степеней свободы у системы появляется энергия, в основном эта энергия будет представлять собой энергию кинетического движения.
Для
свободной материальной точки число
степеней свободы равно трем (![]() )
- это степени свободы поступательного
движения, которое для своего описания
требует трех координат (
)
- это степени свободы поступательного
движения, которое для своего описания
требует трех координат (![]() ),
с этими степенями свободы связана
кинетическая энергия поступательного
движения. Число степеней свободы
вращательного движения для материальной
точки отсутствует (
),
с этими степенями свободы связана
кинетическая энергия поступательного
движения. Число степеней свободы
вращательного движения для материальной
точки отсутствует (![]() ),
так как вращение материальной точки
относительно взаимно перпендикулярных
осей (
),
так как вращение материальной точки
относительно взаимно перпендикулярных
осей (![]() ),
проходящих через нее, не вызывает ее
перемещения в пространстве, т.е. не
требует дополнительной энергии.
),
проходящих через нее, не вызывает ее
перемещения в пространстве, т.е. не
требует дополнительной энергии.
Для твердого тела, которое может свободно перемещаться в пространстве, число степеней свободы равно шести. К трем степеням свободы поступательного движения центра масс тела прибавляется три степени свободы вращательного движения тела относительно трех взаимно перпендикулярных осей, проходящих через центр масс - каждое такое вращение требует сообщения телу кинетической энергии. Как показывает эксперимент, с достаточной степенью точности можно рассматривать атом как материальную точку. Это позволяет оценить число степеней свободы молекулы, состоящей из нескольких атомов. Рассмотрим конкретные примеры.
Молекула, состоящая из одного атома
![]() .
(2.51)
.
(2.51)
Число степеней свободы равно трем, они соответствуют поступательному движению молекулы. Число степеней свободы вращательного движения нет
(рис. 2.11,в).
2. Молекула, состоящая из двух атомов
а)
молекула является жесткой (расстояние
между атомами в ней не изменяется -
![]() ),
для нее число степеней свободы будет
складываться из трех степеней свободы
поступательного движения и двух степеней
свободы вращательного движения:
),
для нее число степеней свободы будет
складываться из трех степеней свободы
поступательного движения и двух степеней
свободы вращательного движения:
![]() ,
,
![]() ,
,![]() .
(2.52)
.
(2.52)
В
этом случае вращение вокруг оси,
проходящей через ось молекулы (вокруг
оси
![]() ,
рис. 2.11,г), теряет свой смысл - при таком
вращении положение молекулы в пространстве
не изменяется и момент инерции такой
молекулы относительно этой оси вращения
равен нулю;
,
рис. 2.11,г), теряет свой смысл - при таком
вращении положение молекулы в пространстве
не изменяется и момент инерции такой
молекулы относительно этой оси вращения
равен нулю;
б) нежесткая молекула - расстояние между атомами может изменяться (между атомами возникают силы упругости), тогда возможно колебательное движение атомов в молекуле, оно будет происходить по гармоническому закону, при этом у атомов помимо кинетической энергии появляется и потенциальная энергия. Следовательно, такая молекула будет обладать шестью степенями свободы, причем одна из них будет соответствовать колебательной степени свободы:
![]() ,
,
![]() ,
,![]() ,
,![]() .
(2.53)
.
(2.53)
3.
Многоатомная молекула (число
молекул
![]() ).
).
а) для жесткой молекулы, как и для твердого тела, число степеней свободы равно шести - три степени свободы поступательного движения и три степени свободы вращательного движения относительно трех взаимно перпендикулярных осей (рис. 2.12,в):
![]() ,
,
![]() ,
,![]() ,
,![]() ;
(2.54)
;
(2.54)
б)
нежесткая
молекула.
Между атомами
действуют упругие силы, число степеней
свободы для молекулы будет равно
![]() ,
из которых три степени свободы приходится
на поступательное движение, три степени
свободы на вращательное движение
равновесной конфигурации молекулы и
(
,
из которых три степени свободы приходится
на поступательное движение, три степени
свободы на вращательное движение
равновесной конфигурации молекулы и
(![]() )
степеней свободы на колебательное
движение
)
степеней свободы на колебательное
движение
![]() ,
,
![]() ,
,![]() ,
,![]() .
(2.55)
.
(2.55)
Представляет
интерес оценить, какая средняя энергия
приходится на одну степень свободы
любого вида движения. Максвелл
сформулировал закон
о равномерном распределении энергии
хаотического теплового движения молекул
по степеням свободы,
согласно которому на
одну степень свободы поступательного
и вращательного движения в среднем
приходится энергия, равная
![]() ,
а на каждую степень свободы колебательного
движения - энергия
,
а на каждую степень свободы колебательного
движения - энергия
![]() .
.
Как уже было отмечено выше, возбуждение степени свободы колебательного движения молекулы требует сообщения кинетической и потенциальной энергии атомам молекулы. Известно, что при гармонических колебаниях среднее значение кинетической и потенциальной энергии совпадают, поэтому среднее значение энергии, приходящееся на одну степень свободы колебательного движения, удваивается.
Можно
качественно показать справедливость
этого закона. Действительно, из формулы
(2.20) для средней энергии поступательного
движения молекулы, участвующей в тепловом
движении (![]() ),
и из равноправия поступательного
движения по координатным осям (
),
и из равноправия поступательного
движения по координатным осям (![]() )
следует, что на одну степень свободы
поступательного движения приходится
энергия, равная
)
следует, что на одну степень свободы
поступательного движения приходится
энергия, равная![]() .
Обобщая это утверждение на все степени
свободы, Максвелл и сформулировал этот
закон.
.
Обобщая это утверждение на все степени
свободы, Максвелл и сформулировал этот
закон.
Итак, согласно закону о равномерном распределении энергии по степеням свободы, средняя энергия молекулы, участвующей в тепловом движении, определяется формулой
![]() .
(2.56)
.
(2.56)
Н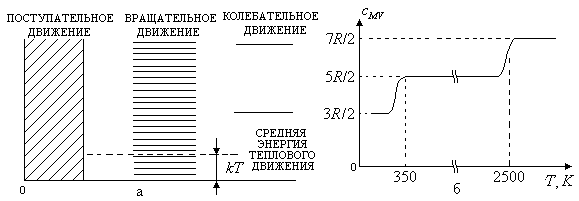 ужно
отметить, что этот закон является
приближенным, что связано с квантованием
энергии вращательного и колебательного
движения молекул. В отличие от
поступательного движения, энергия
которого принимает
ужно
отметить, что этот закон является
приближенным, что связано с квантованием
энергии вращательного и колебательного
движения молекул. В отличие от
поступательного движения, энергия
которого принимает
Рис. 2.12
непрерывный
набор значений (рис. 2.12,а), энергии
вращательного и колебательного движения
молекул квантуются, т.е. принимают
дискретный набор значений. Причем
расстояние между соседними уровнями
энергии для колебательного движения
существенно превышает расстояние между
соседними уровнями энергии для
вращательного движения (![]() ,
рис. 2.12,а).
,
рис. 2.12,а).
Такие особенности энергетического спектра молекул приводят к зависимости числа степеней свободы молекулы от температуры. Наглядным подтверждением этому факту являются экспериментально полученные зависимости теплоемкости идеальных газов от температуры.
Рассмотрим
температурную зависимость молярной
теплоемкости
![]() идеального газа при постоянном объеме
(
идеального газа при постоянном объеме
(![]() ,
см. формулу (2.59,б)).
,
см. формулу (2.59,б)).
1.
Одноатомная молекула.
В области низких температур, превышающих
температуру кипения (например, для
аргона она составляет
![]() ),
молекулы газа участвуют только в тепловом
поступательном движении, для них число
степеней свободы молекулы равно трем.
При дальнейшем нагревании это число не
изменяется, поэтому для одноатомного
газа
),
молекулы газа участвуют только в тепловом
поступательном движении, для них число
степеней свободы молекулы равно трем.
При дальнейшем нагревании это число не
изменяется, поэтому для одноатомного
газа![]() ,
что согласуется с экспериментом.
,
что согласуется с экспериментом.
2.
Двухатомная молекула
(молекула водорода). При низких температурах
(![]() )
молекулы газа участвуют только в тепловом
поступательном движении, поэтому
молярная теплоемкость газа при постоянном
объеме будет равна
)
молекулы газа участвуют только в тепловом
поступательном движении, поэтому
молярная теплоемкость газа при постоянном
объеме будет равна![]() .
Это подтверждает экспериментальная
зависимость
.
Это подтверждает экспериментальная
зависимость![]() от температуры для водорода (рис. 2.12,б,
температура кипения для водорода
составляет
от температуры для водорода (рис. 2.12,б,
температура кипения для водорода
составляет![]() ).
).
В этой области температур энергии теплового движения еще недостаточно, чтобы возбудить вращательное и колебательное движение молекул.
При
дальнейшем повышении температуры у
молекул начинают возбуждаться вращательные
степени свободы. При температуре
![]() все молекулы принимают участие во
вращательном движении, это приводит к
плавному увеличению
все молекулы принимают участие во
вращательном движении, это приводит к
плавному увеличению![]() до значения, равного
до значения, равного![]() .
.
Возбуждение
колебательного движения в молекулах
требует существенно большей энергии
теплового движения и только при
температуре порядка
![]() и выше начинается заметное участие
молекул в колебательном тепловом
движении и
и выше начинается заметное участие
молекул в колебательном тепловом
движении и![]() приближается к значению
приближается к значению![]() .
.
Итак,
на температурной зависимости
![]() имеются участки, на которых значение
имеются участки, на которых значение![]() остается неизменным, и участки, где
происходит рост
остается неизменным, и участки, где
происходит рост![]() .
.
Такое поведение теплоемкости газов находится в резком несоответствии с классической теорией теплоемкости газов, утверждающей независимость теплоемкости идеальных газов от температуры.
