
- •Модуль 2. Молекулярная физика Лекция 1
- •2.1. Статистический и термодинамический методы описания свойств
- •Макроскопических систем
- •2.2. Функции распределения
- •2.2.1. Общий подход
- •2.2.2. Функция распределения молекул идеального газа по модулю скорости молекул
- •2.2.3. График функции распределения молекул идеального газа по модулю скорости для двух температур
- •2.2.4. Функция распределения молекул идеального газа по кинетическим энергиям поступательного движения молекул
- •2.2.5. Средние характеристики молекул
- •Лекция 2
- •2.3. Основное уравнение мкт идеального газа для давления
- •2.4. Молекулярно-кинетический смысл температуры
- •2.5. Распределение Больцмана
- •2.5.1. Функция распределения Больцмана
- •2.5.2. Барометрическая формула
- •*2.7. Экспериментальная проверка распределения молекул по модулю скорости. Опыт Ламмерта
- •*2.8. Опыты Перрена по определению постоянной Авогадро
- •2.9. Основные понятия равновесной термодинамики
- •Лекция 3
- •2.10. Внутренняя энергия системы, работа, теплообмен
- •2.10.1. Внутренняя энергия системы
- •2.10.2. Работа
- •2.10.3. Теплообмен, теплоемкость системы
- •2.11. Первый закон (начало) термодинамики
- •2.12. Второе начало (закон) термодинамики. Термодинамические формулировки
- •2.13. Энтропия в термодинамике
- •Лекция 4
- •2.14. Качественный пример изменения энтропии при неравновесном процессе
- •2.15. Коэффициент полезного действия (кпд) идеального теплового двигателя
- •2.16. Число степеней свободы молекулы. Закон о равномерном распределении энергии по степеням свободы. Теплоемкость идеального газа
- •2. Молекула, состоящая из двух атомов
- •2.17. Применение первого и второго закона термодинамики к изопроцессам в идеальном газе
- •Лекция 5 *2.18. Примеры расчета изменения энтропии для неравновесных процессов.
- •2.19. Термодинамическая вероятность. Статистический смысл понятия энтропии.
- •2.20. Оценка термодинамической вероятности неравновесного и равновесного состояний.
- •Лекция 6
- •2.23. Основы физической кинетики
- •2.23.1. Уравнения для явлений переноса. Линейная неравновесная термодинамика
- •2.23.2. Формулы для коэффициентов переноса в случае идеального газа
- •2. Формулы для коэффициентов переноса
- •2.23.3. Зависимость коэффициентов переноса от параметров состояния идеального газа при протекании различных изопроцессов в идеальном газе
- •Лекция 7
- •2.24. Реальные газы. Уравнение Ван – дер - Ваальса
- •2.25. Экспериментальные и теоретические изотермы для реальных газов. Критическая точка
- •2.26. Внутренняя энергия реального газа
- •2.27. Жидкое состояние. Строение жидкости
2.2.3. График функции распределения молекул идеального газа по модулю скорости для двух температур
Для
того чтобы качественно пояснить изменение
графика функции распределения
![]() при повышении температуры идеального
газа, необходимо выяснить, как изменяется
максимум функции
при повышении температуры идеального
газа, необходимо выяснить, как изменяется
максимум функции![]() .
Для этого необходимо взять производную
по модулю скорости от функции
.
Для этого необходимо взять производную
по модулю скорости от функции![]() и приравнять ее нулю при значении
скорости
и приравнять ее нулю при значении
скорости![]() .
Это позволяет получить следующие
формулы:
.
Это позволяет получить следующие
формулы:
![]() ,
(2.12)
,
(2.12)
![]() ~
~![]() .
(2.13)
.
(2.13)
В
формулу (2.12) входит универсальная газовая
постоянная R
(![]() )
и молярная массаM
(
)
и молярная массаM
(![]() )
газа.
)
газа.
Как
видно из формул (2.12) и (2.13), при повышении
температуры максимум функции![]() становится меньше и смещается в сторону
больших скоростей.
становится меньше и смещается в сторону
больших скоростей.
На
рис. 2.3,б приведены графики функции
![]() для двух температур (
для двух температур (![]() >
>![]() ).
При построении графиков было также
учтено, что согласно формуле (2.11) площадь
под графиком функции при повышении
температуры не изменяется и остается
равной единице.
).
При построении графиков было также
учтено, что согласно формуле (2.11) площадь
под графиком функции при повышении
температуры не изменяется и остается
равной единице.
Как
следует из графиков, приведенных на
рис. 2.3,б, увеличение
температуры идеального газа приводит
к возрастанию числа молекул с повышенными
скоростями.
Так, повышение температуры приводит к
возрастанию числа молекул, попадающих
в приведенный на рис.2.3,б интервал
скоростей (![]() ,
,![]() ).
).
2.2.4. Функция распределения молекул идеального газа по кинетическим энергиям поступательного движения молекул
Функция
распределения молекул идеального газа
по кинетическим энергиям
![]() вводится аналогично функции распределения
по модулю скорости
вводится аналогично функции распределения
по модулю скорости![]()
![]() ,
(2.14)
,
(2.14)
где
![]() -
число молекул, кинетические энергии
которых попадают в бесконечно малый
интервал (
-
число молекул, кинетические энергии
которых попадают в бесконечно малый
интервал (![]() ,
,![]() +
+![]() ),
а
),
а![]() -
вероятность того, что кинетическая
энергия молекулы в отдельном опыте
попадает в бесконечно малый интервал
(
-
вероятность того, что кинетическая
энергия молекулы в отдельном опыте
попадает в бесконечно малый интервал
(![]() ,
,![]() +
+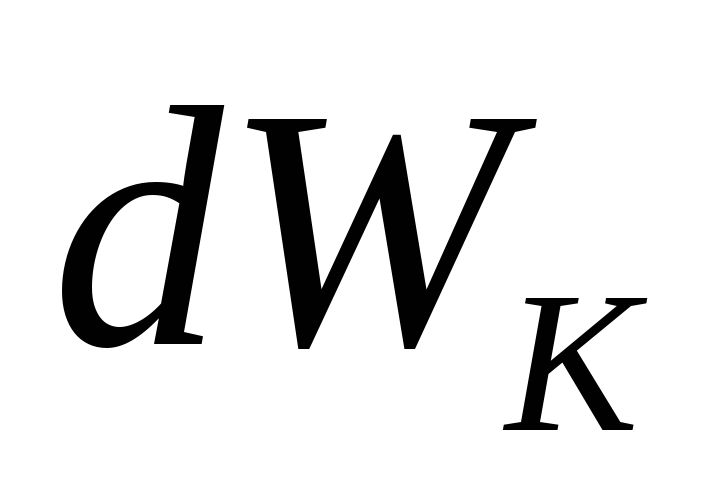 ).
).
Формулу
для функции
![]() можно получить из того условия, что
число молекул, кинетические энергии
которых попадают в интервал энергий
(
можно получить из того условия, что
число молекул, кинетические энергии
которых попадают в интервал энергий
(![]() ,
,![]() +
+![]() ),
равно числу молекул, скорости которых
попадают в интервал скоростей (
),
равно числу молекул, скорости которых
попадают в интервал скоростей (![]() ,
,![]() +
+![]() ).
Это является следствием формулы для
кинетической энергии молекулы
).
Это является следствием формулы для
кинетической энергии молекулы![]() .
Итак,
.
Итак,
![]()
![]() .
.
Заменяя
в полученном выражении скорость
![]() через кинетическую энергию молекулы
(
через кинетическую энергию молекулы
(![]() ),
для функции распределения молекул по
их кинетическим энергиям получим
),
для функции распределения молекул по
их кинетическим энергиям получим
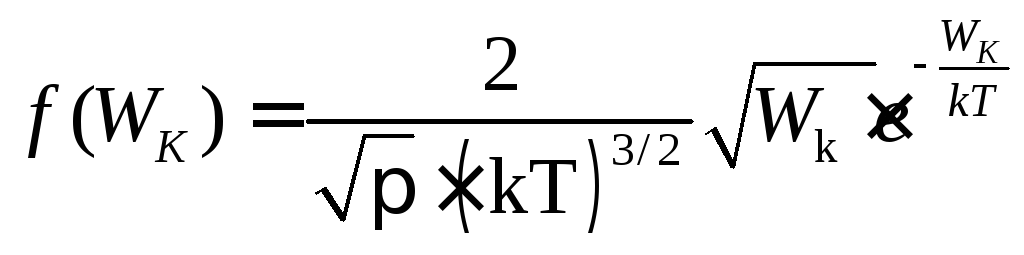 .
(2.15)
.
(2.15)
Из
рис. 2.3,в следует, что поведение зависимостей
![]() от
от![]() и
и![]() от
от![]() в общих чертах одинаковы.
в общих чертах одинаковы.
Таким
же способом можно получить функцию
распределения молекул по относительным
скоростям (![]() )
)
![]() .
(2.16)
.
(2.16)
Эта
функция удобна тем, что параметры
конкретного идеального газа (![]() )
входят в формулу (2.16) через наиболее
вероятную скорость молекул.
)
входят в формулу (2.16) через наиболее
вероятную скорость молекул.
2.2.5. Средние характеристики молекул
Функции
распределения позволяют рассчитать
средние свойства молекул, характеризующие
всю совокупность молекул в целом. Оценим
среднюю арифметическую скорость <![]() >
молекул, которая согласно ее определению
равна сумме модулей всех скоростей
молекул, взятых в какой-то момент времени,
деленной на их число
>
молекул, которая согласно ее определению
равна сумме модулей всех скоростей
молекул, взятых в какой-то момент времени,
деленной на их число
<![]() >=
>=![]() .
(2.17)
.
(2.17)
Сумма
модулей скоростей всех молекул
рассчитывается следующим образом.
Сначала оценивается сумма модулей
скоростей всех молекул в бесконечно
малом интервале скоростей (![]() ,
,![]() +
+![]() ),
она будет равна произведению числа
молекул
),
она будет равна произведению числа
молекул![]() на их скорость
на их скорость![]() :
:![]()
![]() .
Проводя суммирование по всем интервалам
(
.
Проводя суммирование по всем интервалам
(![]() ,
,![]() +
+![]() )
в пределах значений от нуля (
)
в пределах значений от нуля (![]() )
до бесконечности (
)
до бесконечности (![]() ),
получим
),
получим
![]() .
(2.18).
.
(2.18).
Аналогично можно оценить среднюю квадратичную скорость молекул
<![]() >=
>=![]() (2.19)
(2.19)
и среднюю кинетическую энергию поступательного их движения
<![]() >=
>=![]() .
(2.20)
.
(2.20)
Помимо
скоростей <![]() >
и
>
и![]() всю совокупность молекул также описывает
наиболее вероятная скорость
всю совокупность молекул также описывает
наиболее вероятная скорость![]() молекул (2.12).
молекул (2.12).
