
- •Модуль 2. Молекулярная физика Лекция 1
- •2.1. Статистический и термодинамический методы описания свойств
- •Макроскопических систем
- •2.2. Функции распределения
- •2.2.1. Общий подход
- •2.2.2. Функция распределения молекул идеального газа по модулю скорости молекул
- •2.2.3. График функции распределения молекул идеального газа по модулю скорости для двух температур
- •2.2.4. Функция распределения молекул идеального газа по кинетическим энергиям поступательного движения молекул
- •2.2.5. Средние характеристики молекул
- •Лекция 2
- •2.3. Основное уравнение мкт идеального газа для давления
- •2.4. Молекулярно-кинетический смысл температуры
- •2.5. Распределение Больцмана
- •2.5.1. Функция распределения Больцмана
- •2.5.2. Барометрическая формула
- •*2.7. Экспериментальная проверка распределения молекул по модулю скорости. Опыт Ламмерта
- •*2.8. Опыты Перрена по определению постоянной Авогадро
- •2.9. Основные понятия равновесной термодинамики
- •Лекция 3
- •2.10. Внутренняя энергия системы, работа, теплообмен
- •2.10.1. Внутренняя энергия системы
- •2.10.2. Работа
- •2.10.3. Теплообмен, теплоемкость системы
- •2.11. Первый закон (начало) термодинамики
- •2.12. Второе начало (закон) термодинамики. Термодинамические формулировки
- •2.13. Энтропия в термодинамике
- •Лекция 4
- •2.14. Качественный пример изменения энтропии при неравновесном процессе
- •2.15. Коэффициент полезного действия (кпд) идеального теплового двигателя
- •2.16. Число степеней свободы молекулы. Закон о равномерном распределении энергии по степеням свободы. Теплоемкость идеального газа
- •2. Молекула, состоящая из двух атомов
- •2.17. Применение первого и второго закона термодинамики к изопроцессам в идеальном газе
- •Лекция 5 *2.18. Примеры расчета изменения энтропии для неравновесных процессов.
- •2.19. Термодинамическая вероятность. Статистический смысл понятия энтропии.
- •2.20. Оценка термодинамической вероятности неравновесного и равновесного состояний.
- •Лекция 6
- •2.23. Основы физической кинетики
- •2.23.1. Уравнения для явлений переноса. Линейная неравновесная термодинамика
- •2.23.2. Формулы для коэффициентов переноса в случае идеального газа
- •2. Формулы для коэффициентов переноса
- •2.23.3. Зависимость коэффициентов переноса от параметров состояния идеального газа при протекании различных изопроцессов в идеальном газе
- •Лекция 7
- •2.24. Реальные газы. Уравнение Ван – дер - Ваальса
- •2.25. Экспериментальные и теоретические изотермы для реальных газов. Критическая точка
- •2.26. Внутренняя энергия реального газа
- •2.27. Жидкое состояние. Строение жидкости
2.26. Внутренняя энергия реального газа
Внутренняя энергия реального газа будет равна сумме кинетических энергий движения молекул и потенциальной энергии их взаимодействия
![]() ,
,
где
сумма кинетических энергий реального
газа совпадает с внутренней энергией
![]() идеального газа, которуюдля
одного моля газа
можно записать в следующем виде (см.
формулы (2.58а) и (2.59б)):
идеального газа, которуюдля
одного моля газа
можно записать в следующем виде (см.
формулы (2.58а) и (2.59б)):
![]() .
.
Выведем
формулу для потенциальной энергии
взаимодействия
![]() молекул. Это взаимодействие обусловлено
появлением сил притяжения между
молекулами, и оно приводит к возникновению
внутреннего давления
молекул. Это взаимодействие обусловлено
появлением сил притяжения между
молекулами, и оно приводит к возникновению
внутреннего давления![]() газа. Используя теорему о потенциальной
энергии, согласно которой работа
консервативной силы осуществляется за
счет убыли потенциальной энергии газа,
можно записать
газа. Используя теорему о потенциальной
энергии, согласно которой работа
консервативной силы осуществляется за
счет убыли потенциальной энергии газа,
можно записать
![]() .
.
Интегрируя полученное выражение, запишем
![]()
![]() ,
,
где
постоянная величина была выбрана так,
чтобы при увеличении объема, занимаемого
газом, потенциальная энергия взаимодействия
молекул стремилась к нулю:
![]() .
.
Итак, окончательное выражение для внутренней энергии реального газа (для одного моля газа) будет выглядеть следующим образом:
![]() .
(2.90)
.
(2.90)
Для
произвольного количества газа нужно
вместо молярного объема
![]() подставить в формулу величину
подставить в формулу величину![]() .
.
Полученная формула (2.90) свидетельствует о том, что внутренняя энергия реального газа будет зависеть не только от температуры газа, но и от его объема.
2.27. Жидкое состояние. Строение жидкости
Как уже отмечалось, молекулы в газе при высоких температурах движутся поступательно от одного столкновения до другого. При понижении температуры средняя скорость движения молекул и их средняя длина свободного пробега уменьшаются, и все большее время молекулы проводят на расстояниях, попадающих в область действия сил молекулярного притяжения. Это приводит к возрастанию роли сил притяжения между молекулами, к отклонению поведения реальных газов от поведения идеальных газов.
При
понижении температуры качественный
скачок в поведении молекул будет
наблюдаться тогда, когда полная энергия
молекул станет меньше нуля (![]() ),
т.е. средняя кинетическая энергия
молекулы будет меньше потенциальной
энергии их взаимодействия. В этом случае
поступательное движение молекул
переходит в колебательное движение в
потенциальных ямах (рис. 2.21,а, они созданы
взаимодействием молекул, находящихся
достаточно близко друг к другу, что
приводит к малой сжимаемости жидкости).
),
т.е. средняя кинетическая энергия
молекулы будет меньше потенциальной
энергии их взаимодействия. В этом случае
поступательное движение молекул
переходит в колебательное движение в
потенциальных ямах (рис. 2.21,а, они созданы
взаимодействием молекул, находящихся
достаточно близко друг к другу, что
приводит к малой сжимаемости жидкости).
При
этом наблюдаются достаточно частые
переходы молекул из одной потенциальной
ямы в другую. Это связано с тем, что
потенциальная яма является несимметричной,
молекулы при своих колебаниях могут
удаляться друг от друга на расстояния,
которые позволяют им легко преодолевать
потенциальный барьер и переходить в
другую потенциальную яму (соседняя
потенциальная яма находится на расстоянии
![]() ,
рис. 2.21,а). Все это говорит о том, что
жидкость обладает свойством текучести,
т.е. она принимает форму сосуда, в котором
она находится.
,
рис. 2.21,а). Все это говорит о том, что
жидкость обладает свойством текучести,
т.е. она принимает форму сосуда, в котором
она находится.
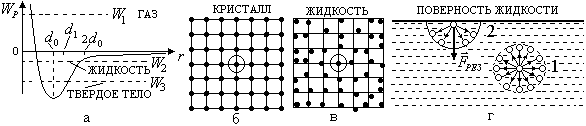
Рис. 2.21
Дальнейшее понижение температуры приводит к тому, что вероятность перехода молекул в соседние потенциальные ямы будет уменьшаться (понижается полная энергия молекул и соответственно возрастает высота и ширина потенциальных барьеров) и молекула в основном будет совершать колебания только в своей потенциальной яме. При этом происходит качественный переход (скачок) к твердому телу (к кристаллу), он осуществляется при определенной температуре, называемой температурой плавления.
Однако имеются вещества (их называют аморфными веществами), которые не имеют температуры плавления. Для них с понижением температуры происходит плавное уменьшение интенсивности теплового движения без образования кристаллической структуры. К ним можно отнести такие вещества, как янтарь, смолы, битумы и полимеры.
Для того чтобы отличать жидкости, аморфные и кристаллические твердые вещества друг от друга с точки зрения их строения, вводится понятие ближнего и дальнего порядка. Под ближним порядком понимают упорядоченное расположение, т.е. на определенных расстояниях и в определенных направлениях, ближайших соседних атомов какого-либо произвольного атома в веществе, принятого за центральный атом (относительно него рассматривается расположение атомов в веществе). Под дальним порядком понимают упорядоченное расположение (на определенных расстояниях и в определенных направлениях) дальних соседей центрального атома. На рис. 2.21,б приведено расположение атомов относительно центрального атома (он обведен окружностью) в кристаллической решетке. Видно, что здесь наблюдается как ближний, так и дальний порядок. В жидкости молекулы отклоняются от своих положений равновесия, но как следует из рис. 2.21,б, все же в них сохраняется ближний порядок (хотя он и будет меньше, чем в кристалле), а дальний порядок отсутствует (рис. 2.21,б). В аморфных телах, как и в жидкости, наблюдается только ближний порядок в расположении атомов, а дальнего порядка нет.
Можно отметить, что неопределенность в строении жидкости, ее текучесть приводят к тому, что теория жидкого состояния разработана сравнительно хуже, чем теория газов и твердых тел, поэтому для жидкости достаточно трудно провести количественный расчет многих физико-химических свойств.

