
- •Л.И. Андрианова, а.П. Пнева, е.В. Рогалева общая химия
- •Глава 1. Основные понятия. Классы неорганических соединений…......5
- •Глава 1. Основные понятия химии
- •Важнейшие классы неорганических соединений
- •1.1. Оксиды
- •Классификация оксидов
- •Способы получения оксидов
- •1.2. Основания
- •1.3. Кислоты
- •1.4. Соли
- •Глава 2. Строение вещества
- •2.1. Строение атома
- •Квантово – механическая модель атома
- •Квантовые числа
- •Распределение электронов по уровням, подуровням и орбиталям во многоэлектронном атоме
- •Электронные формулы
- •2.2. Периодический закон и система д.И. Менделеева
- •Электронные аналоги
- •Свойства элементов
- •2.3. Химическая связь. Строение молекулы
- •Основные параметры химических связей
- •Метод валентных связей. Ковалентная связь
- •Гибридизация электронных облаков
- •Поляризуемость ковалентной связи Полярные и неполярные молекулы. Дипольный момент
- •Ионная связь
- •Металлическая связь
- •2.4. Агрегатное состояние вещества
- •Глава 3. Основные закономерности протекания химических процессов
- •Термодинамика химических процессов
- •Единицей измерения внутренней энергии является джоуль /Дж/.
- •3.2. Кинетика химических процессов
- •3.3. Химическое равновесие
- •Глава 4. Растворы
- •Истинные растворы
- •Способы выражения состава растворов
- •4.2. Жидкие растворы (на примере водных растворов)
- •Тепловой эффект растворения (энтальпия растворения)
- •4.3. Общие свойства растворов
- •Неэлектролиты и электролиты
- •Диссоциация кислот, оснований, солей
- •Сильные и слабые электролиты
- •4.6. Электролитическая диссоциация молекул воды. Ионное произведение воды
- •Глава 5. Реакции в растворах
- •5.1. Реакции ионного обмена
- •Гидролиз солей
- •5.3. Окислительно-восстановительные процессы Cтепень окисления. Окисление и восстановление
- •Составление уравнений окислительно-восстановительных реакций (овр)
- •1) В кислой среде:
- •2) В нейтральной среде:
- •Нейтральная срела
- •3) В щелочной среде:
- •Глава 5. Электрохимические процессы
- •6.1. Двойной электрический слой. Электродный потенциал
- •6.2. Химические источники электрической энергии
- •Концентрационные гальванические элементы
- •6.3. Аккумуляторы
- •6.4. Электролиз
- •Электролиз расплавов солей
- •Электролиз растворов солей
- •Процессы на катоде
- •Процессы на аноде
- •Глава 7. Cвойства металлов Общая характеристика металлов
- •7.1. Физические свойства металлов
- •7.2. Химические свойства металлов
- •Взаимодействие с простыми веществами
- •Взаимодействие металлов с водой
- •Взаимодействие металлов с кислотами
- •Взаимодействие металлов с раствором щелочи
- •Взаимодействие металлов с растворами солей
- •Глава 8. Коррозия металлов. Методы защиты металлов от коррозии
- •8.1. Виды коррозионных процессов
- •8.2. Методы защиты металлов от коррозии
- •Защита поверхности металла
- •Глава 9. Высокомолекулярные соединения (вмс)
- •9.1. Классификация полимеров
- •9.2. Методы получения полимеров
- •9.3. Физико – химические свойства полимеров
- •9.4. Материалы, получаемые на основе полимеров
- •9.5. Применение некоторых полимеров
- •Глава10. Краткие сведения по аналитической химии и методам физико-химического анализа Идентификация
- •10.1. Качественный анализ
- •10.2. Количественный анализ
- •625000Г. Тюмень, ул. Володарского, 38
- •625039 Г. Тюмень, ул. Киевская, 52
3.3. Химическое равновесие
Протекание химических реакций заключается во взаимодействии исходных веществ (реагентов) с образованием продуктов реакции. Химические реакции могут протекать и в прямом, и в обратном направлениях.
прямая реакция
Р
 ЕАГЕНТЫПРОДУКТЫ
ЕАГЕНТЫПРОДУКТЫ
обратная реакция
Все химические реакции подразделяются на необратимые реакции, которые протекают только в одном направлении и до полного расходования одного из реагентов, и на обратимые реакции, которые протекают в двух противоположных направлениях и ни одно из реагирующих веществ не расходуется до конца.
В обратимых реакциях прямая и обратная реакции протекают одновременно.
Например: реакция образования паров воды обратима.
2H2(г) + O2(г) ↔ 2H2O(г)
← →
∆ Н> 0 ∆Н < 0
← →
∆ S > 0 ∆S< 0.
Протеканию реакции в прямом направлении способствует энтальпийный фактор (∆Н < 0) протекания, в обратном направлении - энтропийный (∆S > 0). При равенстве энтальпийного и энтропийного факторов ∆Н = Т∙∆S (∆G = 0) наступает химическое равновесие, при котором скорости прямой и обратной реакций становятся равными.
При химическом равновесии обе реакции (прямая и обратная) продолжают протекать, однако количество образующихся веществ равно количеству расходуемых за это же время тех же веществ. Количественно химическое равновесие характеризуется константой равновесия Кравн., которая представляет собой отношение констант скоростей прямой реакции и обратной (то есть отношение произведений концентраций реагирующих веществ к произведению концентраций продуктов реакции с учетом стехиометрических коэффициентов).
Например: для гомогенной реакции 2Н2 + О2 = 2Н2О
→ → ← ←
υ = k·[H2]2·[O2], υ = k·[H2O]2 , тогда
→ ←
k · [H2]2 ∙ [O2] = k ∙ [H2O]2, следовательно
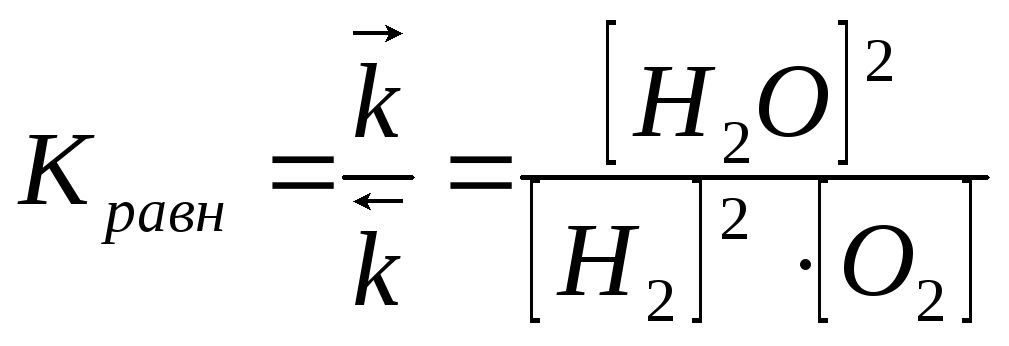 ,
,
где [H2], [O2] и [Н2О] – равновесные концентрации водорода, кислорода и воды.
Для гетерогенных систем в выражение константы равновесия входят концентрации только тех веществ, которые находятся в растворе или в газообразном состоянии. Это объясняется тем, что концентрация веществ в твердом состоянии остается все время постоянной.
Например: С(тв) + СО2(г) = 2СО(г).
→ ←
При состоянии химического равновесия k · [CO2] = k ∙ [CO]2
→ ←
K = k / k = [CO]2 / [CO2].
Константа химического равновесия – величина постоянная при постоянной температуре. Зависит от природы реагирующих веществ и температуры.
Константа равновесия показывает направление протекания реакции:
при К > 1 преобладают в системе продукты - реакция смещена в сторону прямой реакции;
при К < 1 преобладают в системе реагенты - реакция смещена в сторону обратной реакции.
Химическое равновесие – динамическое равновесие. В системе присутствуют как реагенты, так и продукты, и состав определяется условиями состояния системы.
Состояние химического равновесия зависит от:
концентрации веществ;
температуры системы;
давления системы (для газофазных процессов).
При изменении параметров системы нарушается состояние системы. Скорость прямой или обратной реакции изменяется. Однако через некоторое время равновесие устанавливается снова при других концентрациях реагентов и продуктов. Переход системы из одного равновесного состояния в другое равновесное состояние называется смещением химического равновесия.
Направление смещения химического равновесия в зависимости от изменения параметров состояния системы определяется принципом Ле Шателье: “если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние равновесия так, чтобы уменьшить эффект внешнего воздействия”.
Влияние концентрации веществ на смещение равновесия
При повышении концентрации реагентов или продуктов реакции в системе равновесие сдвигается в направлении расходования этих веществ, а при понижении концентрации реагентов или продуктов реакции в системе равновесие смещается в направлении образования этих веществ.
Например: 2Н2(г) + О2(г) ↔ 2Н2О(г).
Для прямой реакции кинетическое уравнение имеет вид
→ →
υ = k ∙ [H2]2 [O2],
← ←
а для обратной реакции υ = k · [H2O]2.
Если в реакционной смеси увеличивается концентрация кислорода за счет подачи извне, то состояние равновесия нарушается. Скорость прямой реакции будет больше скорости обратной реакции. В этом случае равновесие сместится в сторону образования продуктов реакции (Н2О).
Влияние температуры на смещение равновесия
При повышении температуры системы химическое равновесие смещается в направлении эндотермической реакции, что ведет к охлаждению системы, а при понижении температуры системы химическое равновесие смещается в направлении экзотермической реакции, что ведет к нагреву системы.
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое – эндотермическому процессу.
Например: для обратимой реакции 2Н2(г) + О2(г) ↔ 2Н2О(г), ∆Н° < 0
прямая реакция 2Н2(г) + O2(г) → 2Н2О(г) идет с выделением тепла (∆Н° < 0), а обратная 2Н2О(г) ← 2H2(г) + O2(г) - с поглощением тепла (∆H° > 0). При понижении температуры данной системы равновесие смещается в сторону экзотермической реакции, т.е. в сторону образования продуктов реакции; при повышении температуры данной системы равновесие смещается в сторону эндотермической реакции, т.е. в сторону образования реагентов.
Влияние давления в системе на смещение равновесия
При повышении давления в системе равновесие смещается в направлении образования веществ (реагентов или продуктов) с меньшим объемом (меньшим числом молей (молекул) веществ в газообразном состоянии), а при понижении давления в системе равновесие смещается в направлении образования веществ с большим объемом (большим числом молей веществ в газообразном состоянии). При равенстве объемов исходных веществ и продуктов реакции равновесие не смещается (изменение давления не влияет на смещение равновесия).
Например: для реакции 2Н2(г) + О2(г) ↔ 2Н2О(г) объем газообразных реагентов составляет 3 моля (2моля Н2 и 1 моль О2), что больше, чем 2моля - объем продуктов реакции (2Н2О), следовательно, при повышении давления в системе усилится прямая реакция (равновесие сместится вправо), а при понижении давления усилится обратная реакция, то есть равновесие сместится влево.
Примеры расчетных задач
Концентрации веществ, соответствующие состоянию равновесия системы, называют равновесными концентрациями. Они взаимно связаны друг с другом уравнением реакции и законом действующих масс. Эту взаимосвязь можно рассмотреть на примерах.
Задача 1
Вычислить константу равновесия и равновесные концентрации [H2] и [J2] в реакции H2 + J2 ↔ 2HJ ,если их начальные концентрации составляли по 0,02 моль/л, а равновесная концентрация [HJ] – 0,03 моль/л.
Из уравнения реакции видно, что если на образование 2 моль/л HJ расходуется по 1 моль водорода и 1 моль йода, то на образование 0,03 моль HJ будет потрачено по 0,03/2 = 0,015 моль водорода и йода. Следовательно, их равновесные концентрации составляют:
0,020 – 0,015 = 0,005 моль, а константа равновесия
Kравн = [HJ]2 / [H2] · [J2] = (0,03)2/0,005 · 0,005 = 36.
Задача 2
В системе СО + Сl2 = СОСl2 равновесные концентрации составили: хлора – 0,3 моль/л, оксида углерода – 0,2 моль/л и фосгена – 1,2 моль/л. Вычислить константу равновесия системы и начальные концентрации хлора и оксида углерода.
Из уравнения реакции видим, что на образование 1 моль фосгена расходуется по 1 моль оксида углерода и 1 моль хлора. Следовательно, на образование 1,2 моль/л фосгена потребуется по 1,2 моль хлора и оксида углерода. Находим исходные концентрации:
для Сl2: 0,3 + 1,2 = 1,5 моль/л,
для СО: 0,2 + 1,2 = 1,4 моль/л.
Константа равновесия равна [CОСl2] / [CO] · [Сl2] = 1,2 / 0,3 · 0,2 = 20.
