
Malashonok_Neorganicheskaya_khimia_2014
.pdf2KBr + Cl2 = 2KCl + Br2;
2KI + Cl2 = 2KCl + I2;
2NaI + 2H2O |
Электролиз |
2NaOH + H2 + I2. |
Из иодатов иод получают восстановлением:
5NaHSO3 + 2NaIO3 = 2Na2SO4 + 3NaHSO4 + I2 + H2O.
Br2 и I2 могут быть получены в лаборатории при окислении га- логенид-ионов неорганическими окилителями:
K2Cr2O7 + 6KBr + 7H2SO4 = 2Cr2(SO4)3 + 4K2SO4 + 3Br2 + 7H2O;
8NaI + 5H2SO4(конц) = Na2SO4 + 4I2 + H2S + 4H2O; 4KI + 2СuSO4 = 2СuI + I2 + 2K2SO4.
Химические свойства галогенов
Галогены обладают большим сродством к электрону и являются сильными окислителями. Окислительные свойства их возрастают от иода к фтору. Они активно взаимодействуют почти со всеми элементами периодической системы.
Фтор реагирует практически со всеми металлами и неметаллами, кроме He, Ne, Ar. Реакции протекают очень бурно, часто сопровождаются взрывом, образуются соединения, в которых элементы, как правило, находятся в высшей степени окисления, например:
2Na + F2 = 2NaF (на холоде); 2Au + 3F2 = 2AuF3;
2P + 5F2 = 2PF5;
3F2 + S = SF6;
3F2 + Xe = XeF6.
Фтор при обычной температуре не взаимодействует с некоторыми металлами (Fe, Cu, Ni, A1, Zn), на поверхности этих металлов образуется защитная фторидная пленка.
В виде порошка железо горит в хлоре без предварительного нагревания, компактное железо реагирует при нагревании:
2Fe + 3Cl2 t 2FeCl3.
11
Однако в отсутствие воды на поверхности металлов может образоваться плотная солевая пленка, предохраняющая металл от разрушения, поэтому сжиженный сухой хлор перевозят в стальных баллонах. С помощью сухого хлора извлекают олово из отходов белой жести, используемой главным образом для приготовления консервных банок. Сухой хлор не реагирует с железом, но взаимодействует с оловом, образуя жидкий SnС14.
С неметаллами:
2P + 3Cl2(недост) t 2PCl3; 2P + 5Cl2(изб) t 2PCl5; 2Cl2 + S = SCl4.
Активность брома и иода значительно ниже, но и они со многими металлами и неметаллами могут реагировать при обычных условиях:
2А1 + 3I2 = 2А1I3 (Н2О – катализатор); 2P + 3Br2 = 2PBr3;
2P + 3I2 t 2PI3.
Галогенывступаютвреакциюсводородом, образуясоединенияНГ: Н2 + Г2 = 2НГ.
Реакция взаимодействия фтора с водородом сопровождается взрывом, при этом выделяется большое количество энергии. Хлор при обычных условиях очень медленно взаимодействует с водородом, но на прямом солнечном свету или при нагревании реакция идет также со взрывом. Реакция водорода и хлора протекает по цепному механизму, поэтому для нее необходимо инициирование (нагревание или освещение):
Н + Сl hν 2НCl.
2 2
Взаимодействие брома и иода с водородом происходит лишь при нагревании. Иод с водородом реагирует незначительно, так как образующийся в условиях синтеза иодоводород легко разлагается, и равновесие сильно смещено в сторону исходных веществ. Поэтому только НCl в промышленности получают из простых веществ.
Азот и кислород непосредственно с галогенами не взаимодействуют. Лишь фтор взаимодействует с кислородом в тлеющем разряде, образуя при низких температуpax фториды кислорода: O2F2, O3F2 и другие.
12

Взаимодействие с водой. Фтор энергично разлагает воду, продукты реакции зависят от температуры:
(H2O) + F2 = 2HF + 0,5O2 (t > 90°С, с водяным паром – с взрывом);
{2Н2О} + 4F2 = 4НF + 2ОF2 (при t = 0–90°С).
Фтор активно взаимодействует со спиртом, ацетоном, бензолом. Поэтому эти вещества не могут быть использованы в качестве растворителей фтора.
Хлор, бром и иод растворяются в воде, причем их растворимость в воде при 20ºС характеризуется следующими значениями, моль/л: хлор – 0,103, бром – 0,225, то есть растворимость брома несколько выше растворимости хлора. Растворимость иода в воде значительно меньше – 0,0013 моль/л. Растворы хлора и брома в воде носят название хлорной и бромной воды. Эти растворы обладают всеми свойствами хлора и брома соответственно. Их окислительные свойства превосходят окислительные свойства сухих хлора и брома. Это объясняется тем, что в водных растворах галогенов (за исключением фтора) происходят реакции диспропорционирования, например, для хлора при стандартных условиях:
Cl2 + Н2О НClО + НCl.
При переходе от хлора к иоду равновесие все больше смещается в сторону исходных веществ, о чем свидетельствуют значения констант равновесий данных реакций:
Галоген |
С12 |
Br2 |
I2 |
Константа равновесия Кс |
4 · 10–4 |
7 · 10–9 |
2 · 10–13 |
Как видно из приведенных значений констант, рассматриваемые равновесия существенно смещены влево и, наряду с продуктами взаимодействия галогенов с водой, в растворах галогенов присутствуют преимущественно молекулярные формы галогенов.
Бактерицидное действие водных растворов хлора связано как с образованием атомарного кислорода, образующегося при разложении НClО, так и с хлорирующим действием хлорноватистой кислоты. Образующаяся в хлорированной воде соляная кислота безвредна, поэтому вода пригодна для употребления.
Растворимость I2 в воде можно повысить, если добавить к ней KI. В результате образуется красно-бурый раствор хорошо растворимых (но нестойких) полииодидов калия (KI3 и др.):
nI2 + KI = KI2n+1 (n = 1–7).
13

Бром и иод лучше растворяются в органических растворителях. Это свойство брома и иода используется в качественном анализе.
Взаимодействие со щелочами. При взаимодействии фтора со щелочами продукты реакции зависят от концентрации щелочи:
2F2 + 2NaOH(разб) = 2NaF + OF2 + H2O;
2F2 + 4NaOH(конц) = 4NaF + O2 + 2H2O.
Продукты взаимодействия хлора со щелочами зависят от температуры:
Сl2 + 2KОН= KСlО+ KСl + Н2О; 3Сl2 + 6KОН t KСlО3 + 5KСl + 3Н2О.
Раствор, полученный при пропускании хлора через раствор гидроксида натрия, называют «жавелевой водой». Он обладает окислительными свойствами и применяется для отбеливания тканей, бумаги и т. д. Отбеливающее действие «жавелевой воды» связано с поглощением ею углекислого газа из воздуха, который переводит гипохлоритионы в молекулы слабой хлорноватистой кислоты:
NaС1О + СО2 + H2O NaНСО3 + НС1О;
С1О– + СО2 + H2O НСО3 + НС1О.
Молекулы хлорноватистой кислоты неустойчивы и легко отщепляют кислород, который отбеливает материал, окисляя окрашенные примеси.
При взаимодействии хлора с гашеной известью Ca(OH)2 образуется хлорная (белильная) известь CaOCl2:
C12 + Ca(OH)2 = CaOCl2 + H2O.
Хлорную известь можно рассматривать как смесь СаС12 и Са(С1О)2 или как смешанную соль соляной и хлорноватистой кислот:
OCl
Ca
Cl
При взаимодействии щелочи с I2 уже при обычных условиях образуется NaIO3:
6I2 + 12NaOH = 10NaI + 2NaIO3 + 6H2O.
Взаимодействие с сероводородом. Галогены способны отнимать водород от других веществ:
H2S + Br2 = S + 2HBr.
14
Реакция замещения водорода в предельных углеводородах:
CH + Cl hν CH Cl + HCl (радикальный механизм).
4 2 3
Реакция присоединения к непредельным углеводородам: C2H4 + Cl2 = C2H4Cl2.
В ряду Cl2 – Br2 – I2 неметаллические свойства ослабевают. У I2 появляются приметы металлических свойств. I2 реагирует с концентрированной HNO3, в неводном растворе образует катион I+:
I2 + 10HNO3(конц) = 2HIO3 + 10NO2 + 4H2O;
I + AgNO Эфир AgI + INO .
2 3 3
Для иода характерна особая реакция – он соединяется с крахмалом с образованием синего продукта:
(С6Н10O5)n + I2 (С6Н10O5)n · I2.
белый синий
При нагревании равновесие смещается влево, и синяя окраска исчезает. Крахмал применяют как индикатор для обнаружения иода, присутствующего в малых концентрациях.
Особые свойства фтора. Из всех галогенов у фтора наименьший радиус. Это самый электроотрицательный элемент, во всех соединениях имеет степень окисления –1. Исключительная химическая активность фтора обусловлена, с одной стороны, большой прочностью образуемых им связей: так, например, энергия связи H–F равна 566 кДж/моль, с другой стороны – низкой энергией связи в молекуле F2 (159 кДж/моль). Большая энергия связей Э–F является следствием значительной электроотрицательности фтора и малого размера его атома. Низкое значение энергии связи в молекуле F2, объясняется сильным отталкиванием электронных пар, находящихся на р-орбиталях, обусловленным малой длиной связи F–F. Благодаря малой энергии связи молекулы F2 легко диссоциируют на атомы, и энергия активации реакций с участием фтора обычно невелика, поэтому реакции протекают с большой скоростью.
Фтор в реакциях проявляет только окислительные свойства. В атмосфере фтора горят H2O, песок (SiO2):
SiO2 + 2F2 = Si+4F4 + O2.
15
Эта реакция происходит вследствие того, что тетрафторид кремния – более прочное соединение, чем оксид. Нf , 298 (SiO2) = –910,9 кДж/моль,
а Нf , 298 (SiF4) = –1614,9 кДж/моль, кроме того, реакция сопровождается увеличением энтропии.
Галогеноводороды
Получение галогеноводородов. Поскольку взаимодействие про-
стых веществ H2 + F2 = 2HF сопровождается взрывом, фтороводород получают из фторидов:
СaF2 + H2SO4 = CaSO4 + 2HF ; KHF2 t KF + HF.
В промышленности HCl получают взаимодействием простых веществ, хлорированием углеводородов:
Н + Сl hν 2НCl;
2 2
CH + Cl hν CH Cl + НСl.
4 2 3
В лаборатории HCl получают взаимодействием концентрированной сернойкислотынатвердыехлориды, гидролизомкислотныхгалогенидов:
NaCl(тверд) + Н2SO4(конц) t NaНSO4 + НСl ; BCl3 + 3H2O = H3BO3 + 3HCl .
Поскольку восстановительные свойства бромоводорода и иодоводорода более ярко выражены, HI и HBr нельзя получить реакциями обменного взаимодействия соответствующих галогенидов с концентрированной серной кислотой. NaBr и NaI окисляются H2SO4(конц):
2NaBr + 2H2SO4(конц) = Br2 + SO2 + Na2SO4 + 2H2O;
8NaI + 5H2SO4(конц) = 4I2 + H2S + 4Na2SO4 + 4H2O. HBr и HI получают гидролизом галогенидов фосфора:
PBr3 + 3H2O = 3HBr + H3PO3;
PI3 + 3H2O = H3PO3 + 3HI.
При стандартных условиях галогеноводороды – газообразные вещества с резким запахом, хорошо растворимые в воде. Водные растворы галогеноводородов являются кислотами. Характеристика галогеноводородов следующая.
16
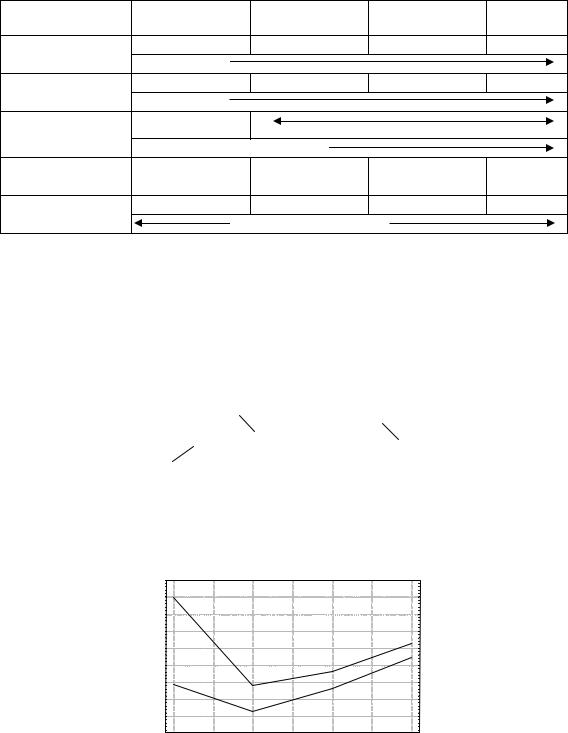
|
Характеристика галогенводородов |
|
|||
Характеристика |
HF |
HCl |
HBr |
HI |
|
Длина связи |
0,092 |
0,128 |
0,141 |
0,160 |
|
H–Г, нм |
Увеличение |
|
|
|
|
Энергия связи, |
565 |
431 |
304 |
297 |
|
кДж/моль |
Уменьшение |
|
|
|
|
Кдис в водных |
6,61·10−4 |
|
Сильные килоты |
|
|
растворах |
Возрастание силы кислот |
|
|
||
Температура |
–83,35 |
–114,17 |
–86,8 |
–50,76 |
|
плавления, °С |
|||||
20 |
–85 |
–66,38 |
–35,55 |
||
Температура |
|||||
кипения, °С |
|
Возрастание от HCl |
|
||
В молекулах галогеноводородов образуется ковалентная полярная связь. Общая электронная пара, за счет которой осуществляется связь, сильно смещена в сторону галогена. Особенно сильно происходит поляризация связи в HF, что обусловлено самой высокой электроотрицательностью фтора. Вследствие этого между молекулами HF образу-
ются прочные водородные связи:
.. |
|
...F |
|
Н |
|
. |
|
|
|
F |
|
Н...F 
Н
.
..
F
Н...
Наличие водородных связей объясняет аномально высокие температуры плавления и кипения фтороводорода (рис. 1.4). От НСl к HBr и HI температурыплавленияикипенияувеличиваются.
t,°C
20 |
|
22 |
|
|
–20 |
|
|
|
|
|
|
|
|
|
–60 |
1 |
|
|
|
|
1 |
|
|
|
–100 |
|
|
|
|
–140 |
HF |
HCl |
HBr |
HI |
Рис. 1.4. Температуры плавления (1) и кипения (2) НГ
17

Жидкий HF образует цепочки, состоящие из молекул HF: (HF)4, (HF)6, (HF)8. Вследствие наличия сильной водородной связи даже в парах молекулы HF ассоциированы. При t = 3500ºС связь H–F разрывается.
HF может смешиваться с Н2О в неограниченном количестве, образуя раствор слабой плавиковой кислоты. Между молекулами HF и Н2О также возникают водородные связи.
Безводный HF – неэлектролит, а в водном растворе возможны процессы ионизации:
HF + H2O H3O+ + F–;
F– + HF HF 2 ;
2HF + H2O H3O+ + HF2 .
HF хранят в сосудах из платины или полиэтилена. В стеклянном сосуде плавиковую кислоту хранить нельзя, т. к. основным компонентом стекла является SiO2, и стекло разрушается:
SiO2 + 4HF = SiF4 + 2H2O (реакция травления стекла).
В избытке плавиковой кислоты образуется гексафторокремниевая кислота:
SiF4 + 2HF = H2[SiF6].
Водные растворы НCl, НBr, НI – сильные кислоты. Галогенидионы проявляют восстановительные свойства, например:
4HCl + O2 2H2O + 2Cl2 (процесс Дикона)
Нf , 298 , кДж/моль –91,8 |
0 |
–241,82 |
0 |
S 298 , Дж/(моль К) 186,8 |
205,04 |
188,72 |
222,9 |
Н298 = –116,44 кДж; S 298 = –129 Дж/К;
G о298 = Н298 – 298 · S о298 = –77 998 Дж.
Расчет показывает, что процесс может протекать как в прямом направлении (при t > 903 К), так и обратном (при t < 903 К). Однако при обычных условиях кислород не взаимодействует с HCl с заметной скоростью, для ускорения реакции смесь хлороводорода и кислорода необходимо нагревать и использовать катализатор (хлориды меди (II) и железа (III)). Ранее процесс Дикона использовали для получения хлора.
18
Восстановительные свойства НГ усиливаются. Иодоводород окисляется на воздухе до иодноватой кислоты:
2HI + 3O2 2HI+5O3.
Усиление восстановительных свойств НГ прослеживается в реакциях с H2SO4:
HCl + H2SO4(конц) – реакция не идет; 2HBr + H2SO4(конц) = Br2 + SO2 + 2H2O; 8HI + H2SO4(конц) = 4I2 + H2S + 4H2O.
НCl при взаимодействии с сильными окислителями окисляется до свободного хлора:
PbO2 + 4HCl = PbCl2 + Cl2 + 2H2O.
Соляная кислота представляет собой бесцветную, дымящую на воздухе жидкость. Она проявляет свойства, характерные для кислот.
Химические свойства соляной кислоты
Реагенты. Характерные реакции |
Примеры реакций |
Спростыми |
веществами |
Реагирует с металлами, расположенными |
2HCl + Mg = MgCl2 + H2↑; |
вэлектрохимическомрядудоводорода |
2HCl + Fe = FeCl2 + H2↑ |
|
|
Сосложными |
веществами |
1. Сосновнымииамфотернымиоксидами |
2HCl + CuO = CuCl2 + H2O |
|
|
2. С основаниями и амфотерными гид- |
2HCl + Cu(OH)2 = CuCl2 + 2H2O; |
роксидами |
3HCl + Fe(OH)3 = FeCl3 + 3H2O |
|
|
3. С аммиаком |
HCl + NH3 = NH4Cl |
|
|
4. C cолями, если образуется газ, осадок |
2HCl + Na2CO3 = 2NaCl + CO2↑+ H2O; |
или слабый электролит |
HCl + AgNO3 = AgCl↓ + HNO3; |
|
|
|
2HCl + K2SiO3 = 2KCl + H2SiO3↓ |
Для HF также характерны реакции с металлами, с основными оксидами, с основаниями и некоторыми солями, например:
Zn + 2HF = ZnF2 + H2; |
3HF + Al(OH)3 = AlF3 + 3H2O; |
NH3 + 2HF = NH4HF2; |
2HF + KOH = KHF2 + H2O. |
Как и в случае других бинарных соединений, выделяют фториды различной природы: основные – фториды металлов; амфотерные – фториды Al, Zn, Be, Sn; кислотные – соединения фтора с неметаллами:
19

NaF |
MgF2 |
AlF3 |
SiF4 |
PF5 |
SF6 |
|
основные |
амфотерный |
|
кислотные |
|
(ионный тип связи) |
(ионно- |
(ковалентный тип связи) |
|||
|
|
ковалентный |
|
|
|
|
|
тип связи) |
|
|
|
Галогениды различной природы могут реагировать между собой: 2KF + SiF4 = K2[SiF6];
3NaF + AlF3 = Na3[AlF6];
2KF + BeF2 = K2[BeF4];
2AlF3 + 3SiF4 = Al2[SiF6]3.
Основные фториды гидролизуются, если они растворимы в воде: 2NaF + H2O = NaHF2 + NaOH.
Кислотные фториды гидролизуются с образованием двух кислот: SiF4 + 3H2O = H2SiO3 + 4HF;
2SiF4 + 4HF = 2H2 SiF6 ; 3SiF4 + 3H2O = H2SiO3 + 2H2 SiF6 .
Аналогичная классификация на основные, амфотерные и кислотные существует у хлоридов, бромидов, иодидов:
|
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
PCl3 |
SCl2 |
tпл, ºС |
801 |
708 |
190 |
58 |
–112 |
–78 |
|
|
основные |
амфотерный |
|
кислотные |
|
|
(ионный тип связи) |
(ионно- |
(ковалентный тип связи) |
|||
|
|
|
ковалентный |
|
|
|
|
|
|
тип связи) |
|
|
|
2KI + HgI2 = K2[HgI4];
KBr + AlBr3 = K[AlBr4].
С увеличением степени ионности повышается термическая устойчивость галогенидов. Гидролиз галогенидов протекает по различным схемам. Подвергающиеся гидролизу основные хлориды, бромиды, иодиды гидролизуют по катиону:
MgCl2 + HOH MgOHCl + HCl.
Кислотные галогениды гидролизуют с образованием двух кислот:
20
