
- •1. Основные классы неорганических соединений. Номенклатура
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Кислоты
- •1.4. Соли
- •1.5. Задачи для решения
- •2. Строение атома
- •1S2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f (лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
- •2.1. Примеры решения задач
- •2.2. Задачи для решения
- •4. Основные понятия и законы химии
- •4.1. Моль, молярная масса
- •4.2. Основные газовые законы
- •4.3. Закон эквивалентов
- •4.4. Примеры решения задач
- •4.5. Задачи для решения
- •5. Растворы
- •5.1. Концентрации растворов
- •5.1.1. Примеры решения задач
- •5.1.2. Задачи для решения
- •Задачи на приготовление раствора
- •5.2. Коллигативные свойства растворов
- •5.2.1. Закон Рауля
- •5.2.2. Изменение температур фазовых переходов растворов
- •5.2.3. Осмотическое давление
- •5.2.4. Примеры решения задач
- •5.2.5. Задачи для решения
- •5.3. Водородный показатель
- •5.3.1. Расчет рН в растворах сильных кислот и оснований
- •5.3.2. Расчет рН в растворах слабых кислот и оснований
- •5.3.3. Примеры решения задач
- •5.3.4. Задачи для решения
- •5.4. Гидролиз
- •Соль образована одним слабым электролитом
- •5.4.1. Примеры решения задач
- •5.4.2. Задачи для решения
- •5.5. Равновесия в буферных растворах
- •5.5.1. Примеры решения задач
- •5.5.2. Задачи для решения
- •5.6. Равновесия в насыщенных растворах
- •5.6.1. Растворимость в бинарной системе соль - вода
- •5.6.2. Растворимость в многокомпонентной системе с одноименными ионами
- •5.6.3. Условия образования осадков
- •5.6.4. Примеры решения задач
- •5.6.5. Задачи для решения
- •6.Окислительно-восстановительные реакции
- •6.1. Примеры решения задач
- •6.2. Задачи для решения
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Оглавление
5.2. Коллигативные свойства растворов
Свойства растворов (температура замерзания и кипения, давление насыщенного пара, осмотическое давление) находятся в зависимости от природы растворителя и концентрации раствора и называются коллигативными свойствами, т.к. не зависят от природы растворенного вещества.
5.2.1. Закон Рауля
Из закона Рауля “относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе” следует, что понижение парциального равновесного давления насыщенного пара растворителя над раствором является линейной функцией мольной доли растворенного вещества в растворе:
|
|
(40) |
|
или
|
(41) |
где
![]() давление насыщенного
пара растворителя над раствором;
давление насыщенного
пара растворителя над раствором;![]() давление насыщенного
пара над индивидуальным растворителем;х1их2 – мольные
доли растворителя и растворенного
вещества в растворе.
давление насыщенного
пара над индивидуальным растворителем;х1их2 – мольные
доли растворителя и растворенного
вещества в растворе.
5.2.2. Изменение температур фазовых переходов растворов
Повышение температуры кипения кипТ:
|
|
(42) |
где
![]() соответственно
температуры кипения раствора и
индивидуального растворителя;Сm– моляльная концентрация растворенного
вещества, моль/кг;Kэб– эбуллиоскопическая константа
растворителя,
соответственно
температуры кипения раствора и
индивидуального растворителя;Сm– моляльная концентрация растворенного
вещества, моль/кг;Kэб– эбуллиоскопическая константа
растворителя,![]() .
.
Изменение температуры кристаллизации крТ:
|
|
(43) |
где
![]() соответственно
температуры кристаллизации раствора
и чистого растворителя;Сm– моляльная концентрация растворенного
вещества;Kкр– криоскопическая постоянная
растворителя,
соответственно
температуры кристаллизации раствора
и чистого растворителя;Сm– моляльная концентрация растворенного
вещества;Kкр– криоскопическая постоянная
растворителя,![]() .
.
5.2.3. Осмотическое давление
Процесс самопроизвольного перехода растворителя в раствор через полупроницаемую мембрану называется осмосом. Давление , которое нужно приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением.
|
|
(44) |
где
![]() – объем одного моля растворителя, м3.
– объем одного моля растворителя, м3.
Для электролитов необходим поправочный множитель i,названный изотоническим коэффициентом:
|
|
(45) |
|
|
(46) |
|
|
(47) |
|
|
(48) |
Изотонический коэффициент – показатель увеличения (уменьшения) числа частиц вследствие диссоциации (ассоциации). Значение i>1 свидетельствует о наличии процесса диссоциации, аi< 1 – о процессе ассоциации. Численное значение изотонического коэффициента позволяет для случая диссоциации вычислить степень диссоциации :
|
|
(49) |
где z– число частиц, получающихся из одной частицы при диссоциации;z’– число частиц, объединяющихся в одну при ассоциации.
5.2.4. Примеры решения задач
Пример 1. относительное понижение упругости пара над раствором тростникового сахара (С12Н22О11) в воде составляет 2 %. Определить осмотическое давление этого раствора при температуре 47ºС. Плотность раствора 1,15 г/см3. Определить также изменение температуры плавления и кристаллизации.Kэб= 0,52K·кг/моль;Kкр = 1,86K·кг/моль.

Решение. 1. Из закона Рауля (40, 41) следует, что мольная доля сахара в растворе составляет 0,02.
2.
По формуле (42) определим величину
повышения температуры кипения раствора: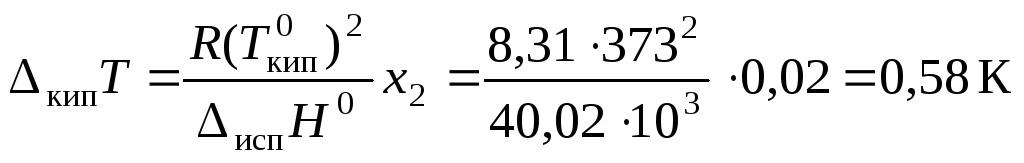 .
.
3.
По формуле (43) определим величину
понижения температуры замерзания
раствора:
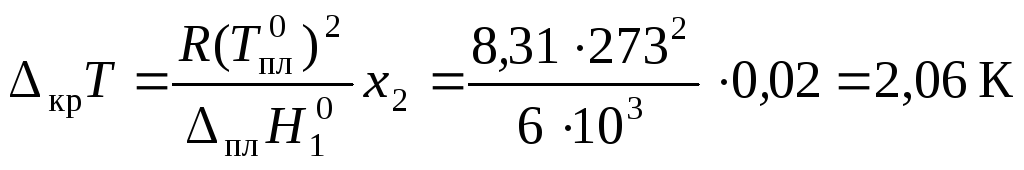 .
.
величину
осмотического давления определим по
формуле (44):![]() .
.
Пример 2. Раствор магния в олове содержит 0,833 г магния в 100 г олова. Температура плавления олова 505 К, а теплота плавления – 7200 Дж/моль. Определить температуру начала кристаллизации этого раствора.
Решение. определим
мольную долюх2магния в
олове: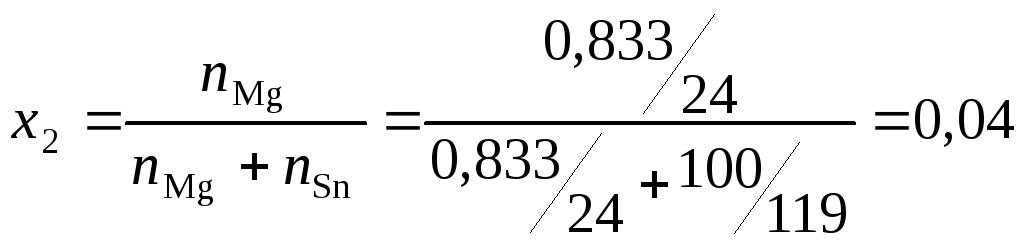 .
.
по уравнению (42) вычислим температуру кристаллизации расплава:
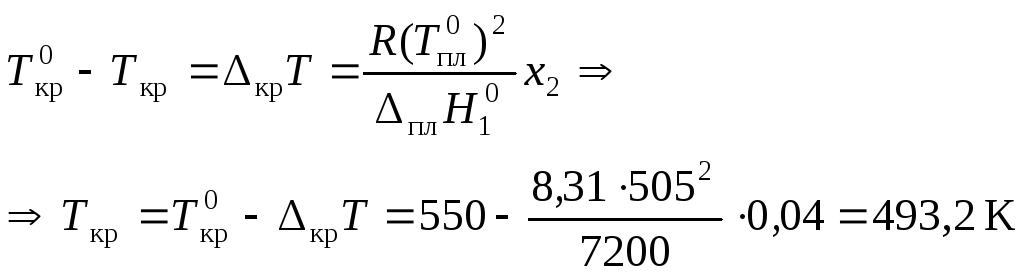
Пример 3. В системе свинец (2)-серебро (1) приТ= 1490 К закон Рауля справедлив для растворов, содержащих менее 18 % свинца. Давление насыщенного пара над чистым серебром равняется 7,47 Па. Вычислить давление пара серебра над раствором, содержащим 17,5 % свинца.
Решение. выделим
мысленно 100 г расплава и примем их
за 100 %, тогда![]() .
.
мольная доля свинца в сплавеx2составит:
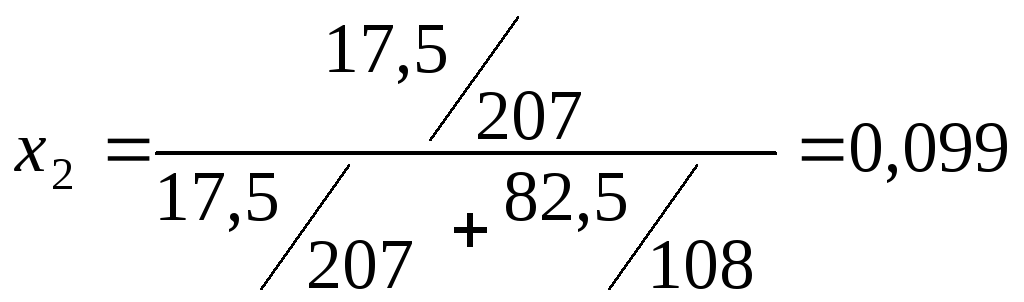 .
.
из
уравнения (41) вычислим давление пара
серебрар1над расплавом: .
.
Пример 4.Давление насыщенного пара над раствором, содержащим 5 г едкого натра в 180 г воды, при 100ºС составляет 0,99·105Па. Давление насыщенного пара над чистой водой при 100ºС составляет 1,01·105Па. Определить состояние едкого натра в растворе.
Решение. Состояние едкого натра в растворе можно оценить по величине изотонического коэффициентаi. По закону Рауля:
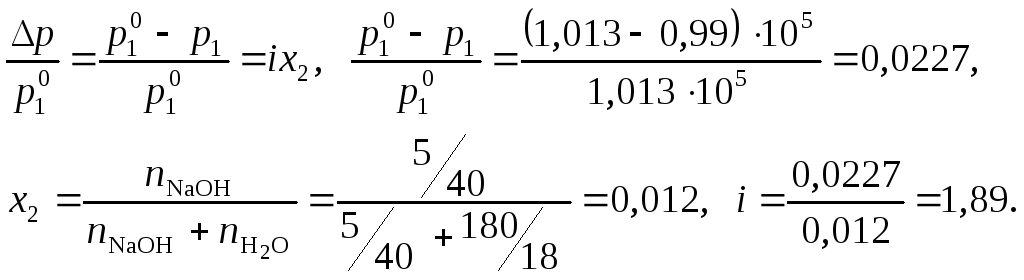
полученное значениеi> 1 указывает на наличие диссоциации NaOH.
Кажущуюся степень диссоциации определим по уравнению:
![]()

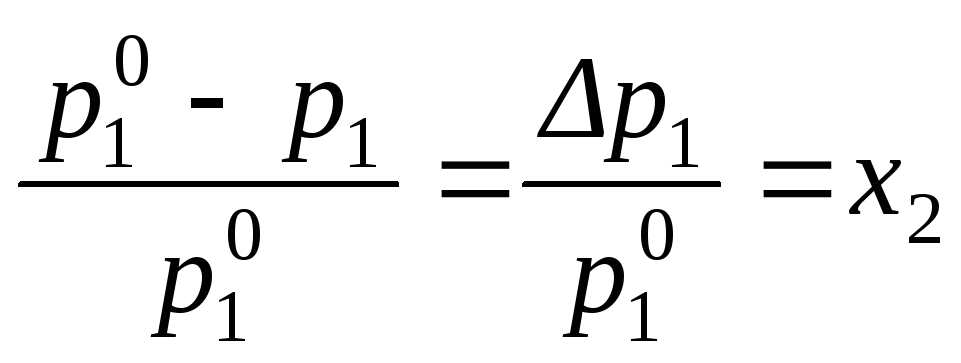 (приn2<<n1),
(приn2<<n1),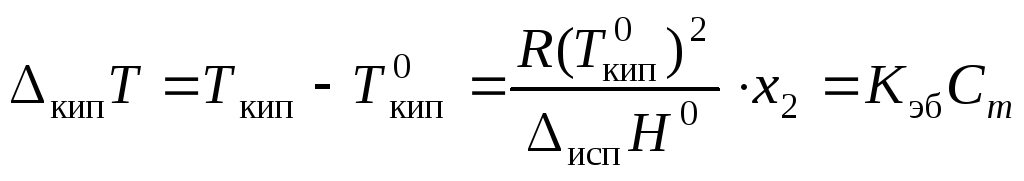 ,
,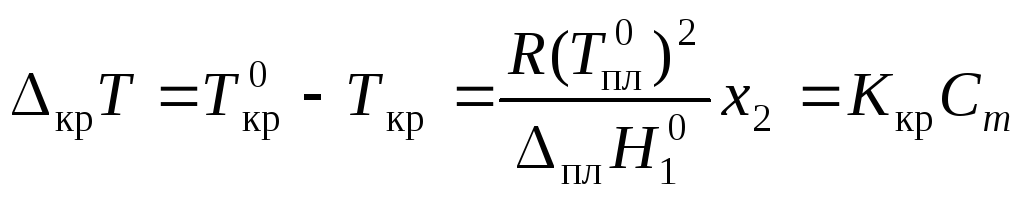 ,
,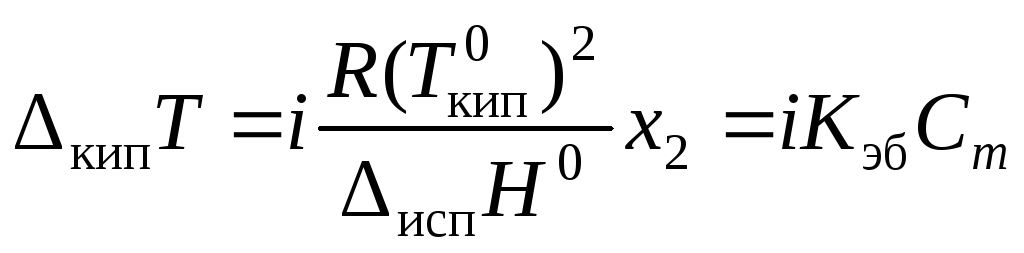 ;
;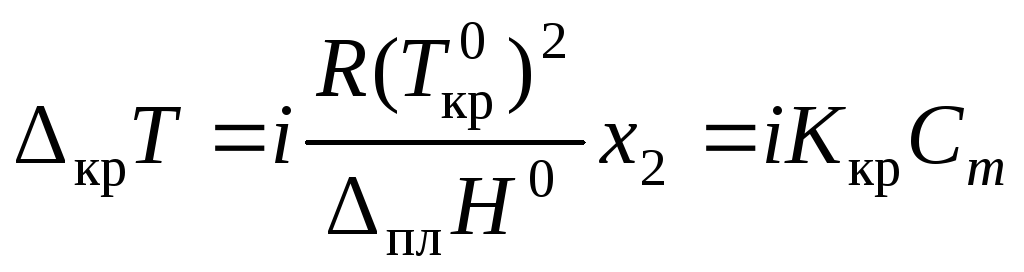 ;
;