
- •1. Основные классы неорганических соединений. Номенклатура
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Кислоты
- •1.4. Соли
- •1.5. Задачи для решения
- •2. Строение атома
- •1S2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f (лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
- •2.1. Примеры решения задач
- •2.2. Задачи для решения
- •4. Основные понятия и законы химии
- •4.1. Моль, молярная масса
- •4.2. Основные газовые законы
- •4.3. Закон эквивалентов
- •4.4. Примеры решения задач
- •4.5. Задачи для решения
- •5. Растворы
- •5.1. Концентрации растворов
- •5.1.1. Примеры решения задач
- •5.1.2. Задачи для решения
- •Задачи на приготовление раствора
- •5.2. Коллигативные свойства растворов
- •5.2.1. Закон Рауля
- •5.2.2. Изменение температур фазовых переходов растворов
- •5.2.3. Осмотическое давление
- •5.2.4. Примеры решения задач
- •5.2.5. Задачи для решения
- •5.3. Водородный показатель
- •5.3.1. Расчет рН в растворах сильных кислот и оснований
- •5.3.2. Расчет рН в растворах слабых кислот и оснований
- •5.3.3. Примеры решения задач
- •5.3.4. Задачи для решения
- •5.4. Гидролиз
- •Соль образована одним слабым электролитом
- •5.4.1. Примеры решения задач
- •5.4.2. Задачи для решения
- •5.5. Равновесия в буферных растворах
- •5.5.1. Примеры решения задач
- •5.5.2. Задачи для решения
- •5.6. Равновесия в насыщенных растворах
- •5.6.1. Растворимость в бинарной системе соль - вода
- •5.6.2. Растворимость в многокомпонентной системе с одноименными ионами
- •5.6.3. Условия образования осадков
- •5.6.4. Примеры решения задач
- •5.6.5. Задачи для решения
- •6.Окислительно-восстановительные реакции
- •6.1. Примеры решения задач
- •6.2. Задачи для решения
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Оглавление
5.6. Равновесия в насыщенных растворах
Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора.
Рассмотрим равновесие между солью, состоящей из катионов металла Mz+и анионов кислотного остаткаAz, и ее насыщенным раствором. При этом учтем, что все соли - сильные электролиты, полностью диссоциирующие в растворе.
|
М+А(т)+Мz+(р-р)+Аz(р-р). |
(96) |
Константу данного равновесия называют произведением растворимости соли и обозначают L. Запишем ее выражение согласно закону действующих масс:
|
L=Mz++Az, |
(97) |
Выражение (97) используют для расчета концентрации ионов в насыщенных растворах. Значения произведений растворимости обычно берут в справочнике.
5.6.1. Растворимость в бинарной системе соль - вода
В этом случае, согласно уравнению (96),
Mz+=+SиAz=S.
Подставим эти соотношения в (97).
L = (+S)+(S)= (S),
где = (++)1/, а=++
Отсюда получаем формулу для расчета растворимости соли в воде:
|
|
(98) |
5.6.2. Растворимость в многокомпонентной системе с одноименными ионами
Рассмотрим расчет растворимости соли М+Ав системе, содержащей хорошо растворимую соль МАс одноименным анионом. Пример такой системы:BaSO4–Na2SO4–H2O. КатионыMz+ переходят в раствор только из осадка, поэтому их концентрация определена растворимостью:Mz+=+S. Концентрация анионов в растворе складывается из двух составляющих: растворимость труднорастворимой солиS, и концентрация соли М, которую обозначимС.После подстановки в формулу (97) получаем:
|
L = (S)(S + C). |
(99) |
Растворимость находят путем решения степенного уравнения (99). Если растворимость меньше концентрации соли с одноименным ионом в 100 и более раз, то есть S0,01C, то пренебрегают в сумме меньшим слагаемым и получают:
|
|
(100) |
Аналогично вычисляют растворимость в присутствии одноименного катиона. Следует запомнить, что растворимость в присутствии одноименных ионов всегда понижается.
5.6.3. Условия образования осадков
Если произведение концентраций ионов, образующих труднорастворимую соль, выше равновесного значения, то есть правая часть в формуле (97) больше левой, то в системе будет происходить образование осадка. При противоположном знаке неравенства осадок будет растворяться.
Значение рН, при котором из данного раствора начинает выпадать осадок гидроксида, называют рН гидратообразования. Для расчета этой характеристики используют следующие формулы:
|
М(ОН)z(т)Мz+(р-р)+zOH(р-р); |
(101) |
|
L=Mz+OHz. |
(102) |
Из формулы (102) находят концентрацию ионов гидроксила, а затем рН гидратообразования.
5.6.4. Примеры решения задач
Пример 1. Рассчитать растворимость флюоритаCaF2в воде, в 0,1 моль/л раствореNaF.
Решение. 1. Запишем уравнение диссоциацииCaF2, отвечающее равновесному растворению флюорита:
CaF2(т) Сa2+(p-p) + 2F(p-p),
согласно которому Ca2+=S;F= 2S.
2. Составим уравнение произведения растворимости CaF2:L=Ca2+F2=S(2S)2= 4S3, из которого вычислим растворимость флюорита в воде:
![]() моль/л.
моль/л.
3. Для расчета растворимости в 0,1 М растворе NaF, которую обозначимS1, произведем следующие подстановки в уравнение произведения растворимости:L=Ca2+F2;
Ca2+ = S1; F = 2S1 + CNaF = 0,1 моль/л, так как S1 0,1.
Получаем: L=S1(0,1)2, откуда
![]() моль/л.
моль/л.
Пример 2.Вычислить рН гидратообразования для
раствора сульфата никеля с концентрацией
0,01 моль/л (![]() =
1,21016).
=
1,21016).
Решение.1. Осадок гидроксида образуется из раствораNiSO4в результате установления следующего равновесия:
Ni(OH)2Ni2++ 2OH.
2. Гидратообразование начинается при условии:
Ni2+OH2=L, откуда
![]()
рОН = lg[OH] =lg1,09107= 6,96; рH= 14 - рОН = 7,04.
Пример 3. Произойдет ли осаждение малорастворимогоAgNO2(L= 1,6104) по реакцииAgNO3+KNO2AgNO2+KNO3при смешивании равных объемов 0,02 М растворовAgNO3иKNO2?
Решение. 1. Для образования осадкаAgNO2должно выполняться условие [Ag+][NO2] ≥L. Проверим, выполняется ли это условие в нашей задаче.
2. После смешивания равных объемов растворов AgNO3иKNO2общий объем раствора будет в два раза больше каждого из исходных, и концентрацииAgNO3иKNO2соответственно уменьшатся в два раза, т. е. будут равны 0,01 моль/л. [Ag+][NO2] = 0,010,01 = 1104>L, следовательно, осадок образуется.

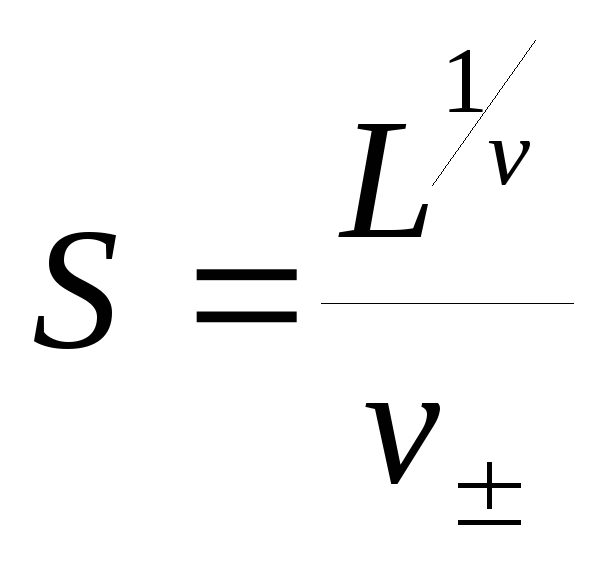 .
.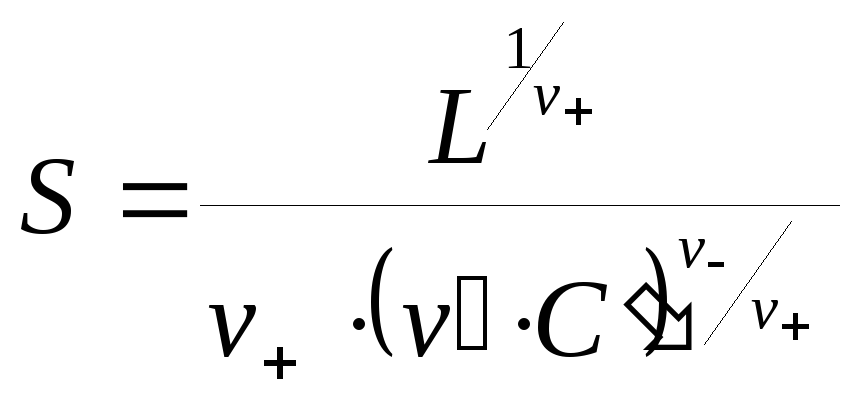 .
.