
- •1. Основные классы неорганических соединений. Номенклатура
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Кислоты
- •1.4. Соли
- •1.5. Задачи для решения
- •2. Строение атома
- •1S2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f (лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
- •2.1. Примеры решения задач
- •2.2. Задачи для решения
- •4. Основные понятия и законы химии
- •4.1. Моль, молярная масса
- •4.2. Основные газовые законы
- •4.3. Закон эквивалентов
- •4.4. Примеры решения задач
- •4.5. Задачи для решения
- •5. Растворы
- •5.1. Концентрации растворов
- •5.1.1. Примеры решения задач
- •5.1.2. Задачи для решения
- •Задачи на приготовление раствора
- •5.2. Коллигативные свойства растворов
- •5.2.1. Закон Рауля
- •5.2.2. Изменение температур фазовых переходов растворов
- •5.2.3. Осмотическое давление
- •5.2.4. Примеры решения задач
- •5.2.5. Задачи для решения
- •5.3. Водородный показатель
- •5.3.1. Расчет рН в растворах сильных кислот и оснований
- •5.3.2. Расчет рН в растворах слабых кислот и оснований
- •5.3.3. Примеры решения задач
- •5.3.4. Задачи для решения
- •5.4. Гидролиз
- •Соль образована одним слабым электролитом
- •5.4.1. Примеры решения задач
- •5.4.2. Задачи для решения
- •5.5. Равновесия в буферных растворах
- •5.5.1. Примеры решения задач
- •5.5.2. Задачи для решения
- •5.6. Равновесия в насыщенных растворах
- •5.6.1. Растворимость в бинарной системе соль - вода
- •5.6.2. Растворимость в многокомпонентной системе с одноименными ионами
- •5.6.3. Условия образования осадков
- •5.6.4. Примеры решения задач
- •5.6.5. Задачи для решения
- •6.Окислительно-восстановительные реакции
- •6.1. Примеры решения задач
- •6.2. Задачи для решения
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Оглавление
2. Строение атома
Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом же атом – система электронейтральная. Заряд ядра равен порядковому номеру элемента в таблице Д.И. Менделеева. Состояние электрона в атоме описывается при помощи набора четырех квантовых чисел: главного n, орбитальногоl, магнитногоmlи спиновогоms. Определенные значения трех квантовых чисел (n, l ,ml) описывают состояние электрона называемое атомной орбиталью (АО).
Главное квантовое число nопределяет энергию АО и номер энергетического уровня, на котором находится электрон, может принимать целочисленные значения от единицы до бесконечности.
Орбитальное квантовое число lопределяет форму АО и энергетический подуровень, может принимать значения от нуля доn-1.Исторически атомным орбиталям со значениямиl, равным 0, 1, 2, 3 присвоены буквенные обозначенияs-,p-,d-,f-. В графических схемах электронного строения атомов каждая орбиталь обозначается символомра
Магнитное квантовое число mlопределяет пространственную ориентацию данной АО и отчасти ее форму, может принимать значения от –l…0…+l.
Спиновое квантовое число msхарактеризует собственный момент импульса и связанный с ним магнитный момент, может принимать значения ±1/2.
Последовательность распределения электронов в атоме по мере увеличения значений lиnвыражается электронными или электронно-графическими формулами.
При заполнении АО действует принцип Паули, из которого следует, чтов атоме не может быть двух электронов, характеризующихся одинаковым набором значений четырех квантовых чисел. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа.
Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которомуэлектроны в основном состоянии в атоме располагаются так, чтобы модуль суммарного спина всех электронов подуровня был максимальным.Например, четыре валентныхp-электрона атома кислорода размещаются в квантовых ячейках следующим образом:
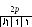
Последовательность заполнения энергетических уровней и подуровней в атомах выражается правилом Клечковкого:порядок заполнения определяется возрастанием суммы n+l, а при одинаковом ее значении первым заполняется подуровень с меньшим значением n в этой сумме:
1S2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f (лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
Принадлежность
элемента к электронному семейству
определяется характером заполнения
энергетических подуровней: s-элементы
– заполнение внешнегоs-подуровня,
например: Li: 1s22s2;р-элементы – заполнение внешнегоp-подуровня, например: F: 1s22s22p5;d-элементы – заполнение предвнешнегоd-подуровня, например: V: 1s2
2s2 2p6 3s2
3p6 4s2 3d3;f-элементы – заполнениеf-подуровня
второго снаружи уровня, например:Nd:
1s2 2s2
2p2 2p6
3s2 3p6
4s2 3d10
4p6 5s2
4d10 5p6
6s2 4f4.
Для d- иf-элементов имеются отклонения от описанного способа заполнения АО – так называемыйпровал электрона. Это явление связано с тем, что для атома устойчивым состоянием является полностью или на половину заполненная АО, т. е.d10,d5,f14,f7. В ситуации, когда до достижения такого состояния не хватает одного электрона, он переходит («проваливается») с предыдущего уровня, например электронный паспорт серебра 1s22s22p63s23p64s23d104p65s24d9с учетом провала электрона: 1s22s22p63s23p64s23d104p65s14d10.
Если на валентных энергетических уровнях имеются вакантные АО, то при получении электронами порции энергии (возбуждении атома) становится возможным «разъединение» валентных электронов, то есть их переходы с тех подуровней, где все АО заняты полностью () или частично () на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т. е. возможно несколько возбужденных состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов).
