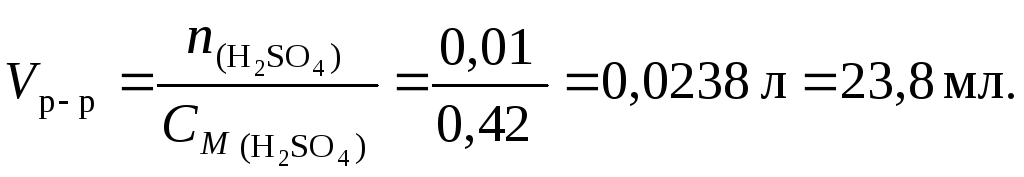- •1. Основные классы неорганических соединений. Номенклатура
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Кислоты
- •1.4. Соли
- •1.5. Задачи для решения
- •2. Строение атома
- •1S2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f (лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
- •2.1. Примеры решения задач
- •2.2. Задачи для решения
- •4. Основные понятия и законы химии
- •4.1. Моль, молярная масса
- •4.2. Основные газовые законы
- •4.3. Закон эквивалентов
- •4.4. Примеры решения задач
- •4.5. Задачи для решения
- •5. Растворы
- •5.1. Концентрации растворов
- •5.1.1. Примеры решения задач
- •5.1.2. Задачи для решения
- •Задачи на приготовление раствора
- •5.2. Коллигативные свойства растворов
- •5.2.1. Закон Рауля
- •5.2.2. Изменение температур фазовых переходов растворов
- •5.2.3. Осмотическое давление
- •5.2.4. Примеры решения задач
- •5.2.5. Задачи для решения
- •5.3. Водородный показатель
- •5.3.1. Расчет рН в растворах сильных кислот и оснований
- •5.3.2. Расчет рН в растворах слабых кислот и оснований
- •5.3.3. Примеры решения задач
- •5.3.4. Задачи для решения
- •5.4. Гидролиз
- •Соль образована одним слабым электролитом
- •5.4.1. Примеры решения задач
- •5.4.2. Задачи для решения
- •5.5. Равновесия в буферных растворах
- •5.5.1. Примеры решения задач
- •5.5.2. Задачи для решения
- •5.6. Равновесия в насыщенных растворах
- •5.6.1. Растворимость в бинарной системе соль - вода
- •5.6.2. Растворимость в многокомпонентной системе с одноименными ионами
- •5.6.3. Условия образования осадков
- •5.6.4. Примеры решения задач
- •5.6.5. Задачи для решения
- •6.Окислительно-восстановительные реакции
- •6.1. Примеры решения задач
- •6.2. Задачи для решения
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Оглавление
5. Растворы
5.1. Концентрации растворов
Раствором называется гомогенная (однородная) система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в определенных пределах. По агрегатному состоянию растворы могут быть газообразными, жидкими и твердыми.
В растворах выделяют растворитель и растворенное вещество. Растворителемназывают компонент, который образует непрерывную среду.остальные компоненты, которые распределены в среде растворителя в виде дискретных частиц, называютсяраствореннымивеществами. Состав раствора (концентрация) чаще всего выражается следующими способами.
Массовая доля или процентное содержание– соотношение масс растворенногоmввещества и раствораmр-р, выраженное в долях или процентах.
|
|
(34) |
Концентрация, выраженная в граммах на литр, Сг/л – показывает, какая масса растворенного веществаmв, выраженная в граммах, содержится в единице объема раствораVр-р:
|
|
(35) |
Молярная концентрацияилимолярность,СМ–число молей растворенного веществаnвв одном дм3 (л) раствора:
|
|
(36) |
Моляльная концентрацияилимоляльность,Сm– число молей растворенного вещества, приходящееся на одинкилограммрастворителя:
|
|
(37) |
Мольнаядоляили мольные процентыxi – число молей компонента (растворителя или растворенного вещества) содержащееся в одном моле раствора:
|
|
(38) |
5. Нормальная концентрацияилинормальность, CN– количество эквивалентов,nэврастворенного вещества, содержащееся в одном литре раствора:
|
|
(39) |
где z– количество обменных эквивалентов растворенного вещества, содержащееся в одном его моле.
Для кислот zсоответствует основности кислоты, т. е. числу атомов водорода в составе кислоты, обмениваемых в данной реакции на металл или нейтрализуемых основанием.
Для оснований zсоответствует кислотности основания, т.е. числу гидроксильных групп в составе основания, обмениваемых на кислотный остаток или нейтрализуемых кислотой.
Для солей zрассчитывают как произведение числа атомов и степени окисления металла в составе соли.
Для окислителей и восстановителей в окислительно-восстановительных реакциях z– изменение их степени окисления в ходе реакции.
5.1.1. Примеры решения задач
Пример 1. Раствор серной кислоты в воде с концентрацией 16 % (мас.) имеет плотностьd= 1,109 г/см3. Выразить концентрацию этого раствора всеми способами.
Решение.1.
Выделим мысленно 1 кг раствора и
найдем его объем:![]()
![]() .
.
2. Найдем массу
растворенного вещества (H2SO4)
по формуле (34):![]()
3. По формуле
(35) вычислим концентрацию раствора
серной кислоты в г/л:
![]()
4. Найдем количество молей серной кислоты:
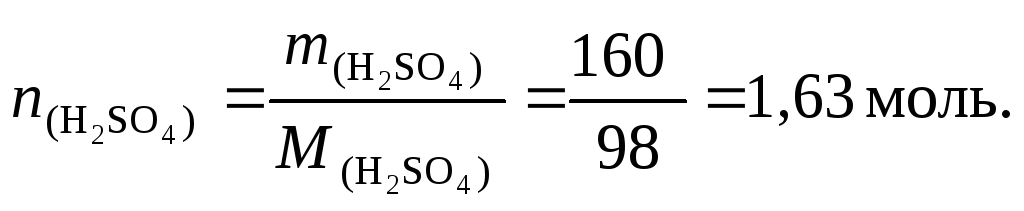
5. По формуле (36) вычислим молярную концентрацию раствора серной кислоты:
![]()
6. Найдем массу растворителя (Н2О):
![]()
7. По формуле
(37) вычислим моляльную концентрацию
раствора серной кислоты:
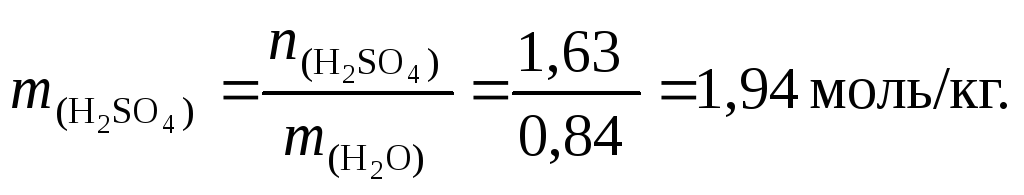
8. Найдем количество молей воды:
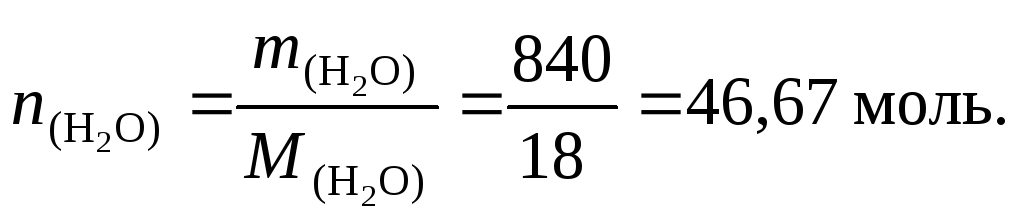
9. По формуле
(38) найдем мольную долю серной кислоты:
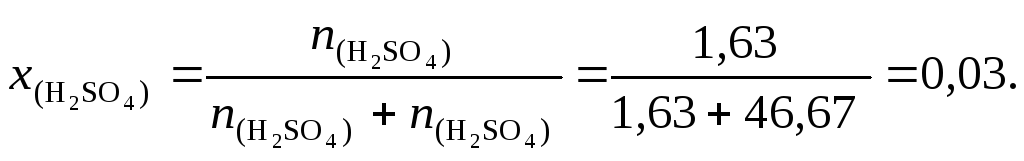
10. По формуле (39) определим нормальную концентрацию раствора серной кислоты (для серной кислоты количество обменных эквивалентов в одном моле вещества z= 2):
![]()
Пример 2.Какой объем раствора серной кислоты концентрацией 10 % (d= 1,066 г/см3) требуется для приготовления 200 мл 1 н. раствора?
Решение.
1.найдем массу
серной кислоты, содержащейся в 200 мл
1 н. раствора. Для этого вычислим
молярную концентрацию раствора по
формуле (39):![]() количество
вещества серной кислоты по формуле
(36)
количество
вещества серной кислоты по формуле
(36)
![]() и ее массу
и ее массу
![]() .
.
2. Подставим найденную массу серной кислоты в уравнение (34) и вычислим объем 10 % раствора
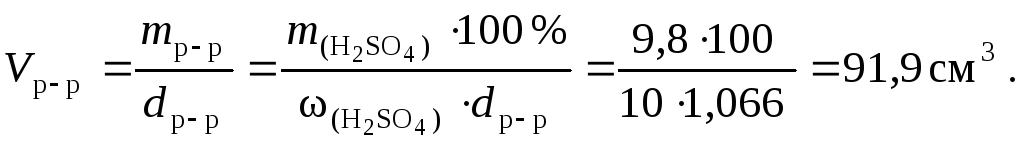
Пример 3. Какой объем воды следует прибавить к 500 мл раствора, содержащего 40 г сульфата никеля, чтобы понизить его концентрацию до 0,05 моль/л?
Решение. 1. По
уравнению (36) найдем объем 0,05 М
раствора (V2):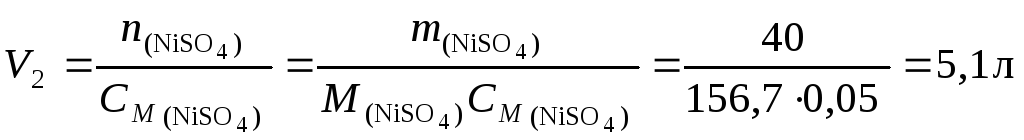 .
.
2. Найдем объем
воды:
![]() .
.
Пример 4. Найти молярную концентрацию раствора карбоната натрия, полученную при смешивании 600 мл 2,15 % раствора (d = 1,02 /см3) и 200 мл 8,82 % раствора (d= 1,09 г/см3).
Решение. 1. Найдем количество вещества карбоната натрия в каждом из смешиваемых растворов:
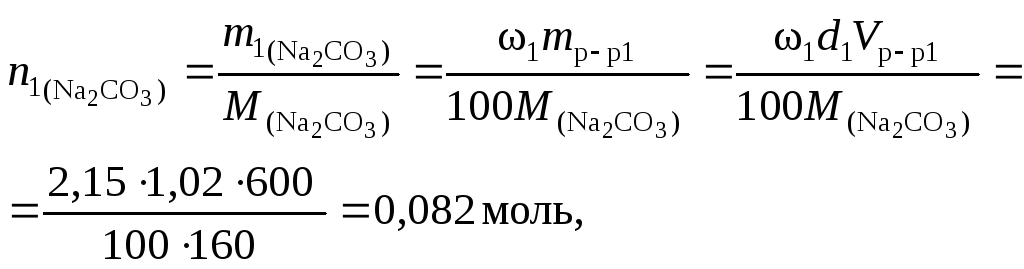
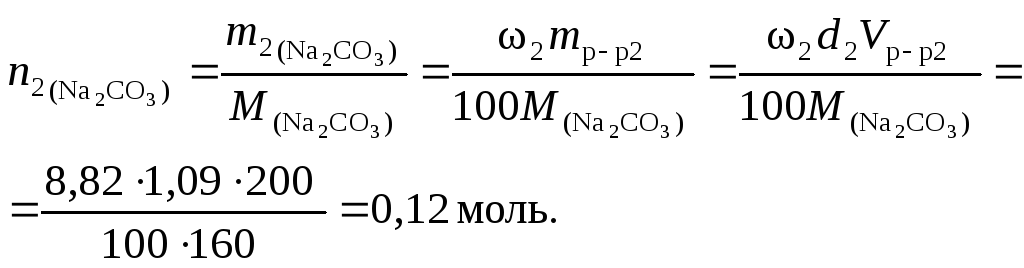
2. Вычислим
молярную концентрацию полученного
раствора:
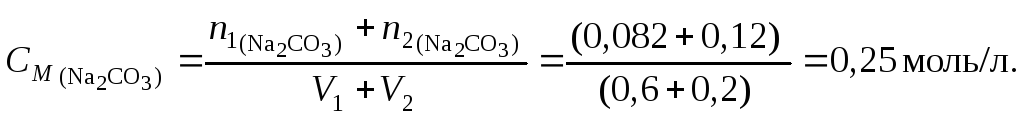
Пример 5.Какой объем раствора серной кислоты концентрацией 0,42 моль/л потребуется для нейтрализации 20 мл раствора гидроксида калия концентрацией 6 % (d= 1,053 г/см3)?
Решение. 1. Составим уравнение реакции:
2KOH+H2SO4K2SO4+ 2H2O
2. По уравнению (34) найдем количество вещества KOH
![]()
3. По уравнению реакции на 2 моль KOHприходится 1 моль Н2SO4, следовательно, для реакции с 0,02 моль гидроксида калия требуется 0,01 моль серной кислоты.
4. По уравнению
(36) найдем объем раствора серной кислоты: