
- •1. Основные классы неорганических соединений. Номенклатура
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Кислоты
- •1.4. Соли
- •1.5. Задачи для решения
- •2. Строение атома
- •1S2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f (лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
- •2.1. Примеры решения задач
- •2.2. Задачи для решения
- •4. Основные понятия и законы химии
- •4.1. Моль, молярная масса
- •4.2. Основные газовые законы
- •4.3. Закон эквивалентов
- •4.4. Примеры решения задач
- •4.5. Задачи для решения
- •5. Растворы
- •5.1. Концентрации растворов
- •5.1.1. Примеры решения задач
- •5.1.2. Задачи для решения
- •Задачи на приготовление раствора
- •5.2. Коллигативные свойства растворов
- •5.2.1. Закон Рауля
- •5.2.2. Изменение температур фазовых переходов растворов
- •5.2.3. Осмотическое давление
- •5.2.4. Примеры решения задач
- •5.2.5. Задачи для решения
- •5.3. Водородный показатель
- •5.3.1. Расчет рН в растворах сильных кислот и оснований
- •5.3.2. Расчет рН в растворах слабых кислот и оснований
- •5.3.3. Примеры решения задач
- •5.3.4. Задачи для решения
- •5.4. Гидролиз
- •Соль образована одним слабым электролитом
- •5.4.1. Примеры решения задач
- •5.4.2. Задачи для решения
- •5.5. Равновесия в буферных растворах
- •5.5.1. Примеры решения задач
- •5.5.2. Задачи для решения
- •5.6. Равновесия в насыщенных растворах
- •5.6.1. Растворимость в бинарной системе соль - вода
- •5.6.2. Растворимость в многокомпонентной системе с одноименными ионами
- •5.6.3. Условия образования осадков
- •5.6.4. Примеры решения задач
- •5.6.5. Задачи для решения
- •6.Окислительно-восстановительные реакции
- •6.1. Примеры решения задач
- •6.2. Задачи для решения
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Оглавление
5.3. Водородный показатель
Для характеристики кислотно-основных свойств растворов используют водородный показатель рН, равный отрицательному значению десятичного логарифма концентрации ионов водорода. Аналогично рассчитывают гидроксильный показатель рОН, равный отрицательному значению десятичного логарифма концентрации ионов гидроксила.
|
|
(50) |
Концентрации ионов водорода и гидроксила связаны между собой равновесием диссоциации воды:
Н2ОН++ ОН.
Константу равновесия называют ионным произведением воды. При 298 К она равна 1014.
|
|
(51) |
Логарифмированием уравнения (51) получаем:
|
рН + рОН = 14. |
(52) |
В чистой воде (нейтральная среда) рН = рОН = 7.В кислой среде рН7, в щелочной среде рН7.
5.3.1. Расчет рН в растворах сильных кислот и оснований
Для сильных кислот и щелочей, полностью диссоциированных на ионы,
|
Н+ =zCкиОН=zCщ, |
(53) |
где СкиСщмоляльные концентрации кислоты и, соответственно, щелочи,zосновность кислоты или кислотность основания.
Разбавление растворасильного электролита учитывают по уравнениям:
|
в кислой среде: рН2= рН1+lgn, |
(54) |
|
в щелочной среде: рН2= рН1–lgn, |
(55) |
где индекс 1 относится к исходному раствору (до разбавления), индекс 2 – к конечному раствору (после разбавления).
В среде, близкой к нейтральной, необходимо принять во внимание диссоциацию воды, в результате которой образуются ионы Н+ и ОН.
|
|
(56) |
|
|
(57) |
При смешивании растворовсильных кислот и оснований возможны два варианта.
1. рН17 и рН27 или рН27 и рН27, то есть смешивают два кислых или два щелочных раствора:
|
|
(58) |
|
|
(59) |
2. рН17, а рН27, то есть смешивают кислый и щелочной растворы. В этом случае конечную концентрацию раствора рассчитывают по веществу, взятому в избытке.
|
В
избытке взята кислота:
|
(60) |
|
В
избытке взята щелочь:
|
(61) |
5.3.2. Расчет рН в растворах слабых кислот и оснований
Диссоциация многих электролитов протекает не полностью. Отношение числа диссоциированных молей к общему числу молей электролита в растворе называют степенью диссоциации. Для его количественного описания используют константу равновесия, называемую константой диссоциации. Для одноосновной кислоты, диссоциирующей по уравнению:
|
НАnН++ Аn, где Аn- кислотный остаток, |
|
|
|
(62) |
Т.к.
[An–]
= [H+]
и [An]
= C
то
![]() и
и
|
|
(63) |
где С– концентрация слабой кислоты, моль/лKd– константа диссоциации (приводится в справочниках).
Для растворов слабых оснований:
|
|
(64) |
где С- концентрация слабого основания, моль/л.
По значению константы диссоциации можно рассчитать степень диссоциации слабого электролита:
|
|
(65) |
Многоосновные кислоты диссоциируют ступенчато, например: Н2SНS+ Н+ (1-ая ступень); НSS+ Н+(2-ая ступень).
При расчетах рН обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями. Таким образом, уравнения (62 и 64) справедливы и для многоосновных кислот при использовании первой константы диссоциации Kd1.

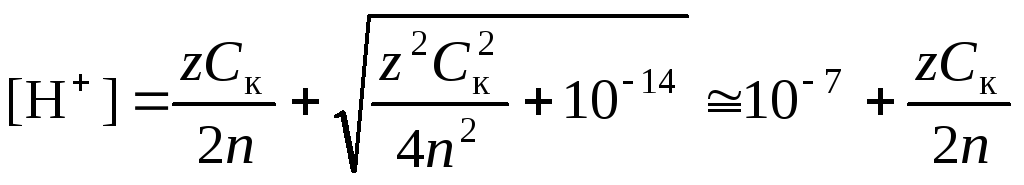 .
.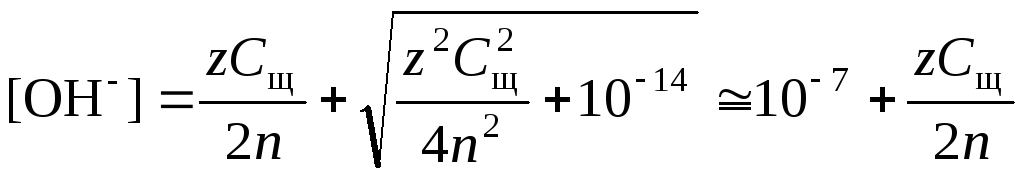 .
.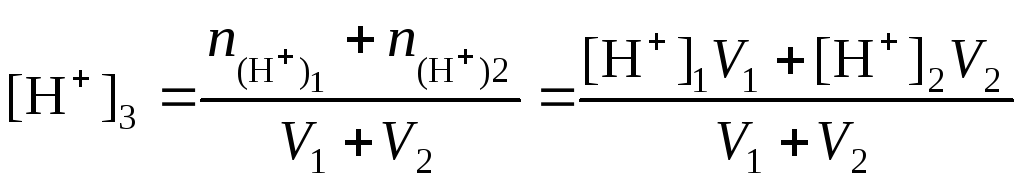 ,
,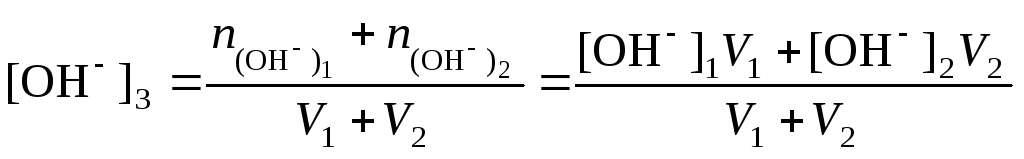 .
.