
- •1. Основные классы неорганических соединений. Номенклатура
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Кислоты
- •1.4. Соли
- •1.5. Задачи для решения
- •2. Строение атома
- •1S2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f (лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
- •2.1. Примеры решения задач
- •2.2. Задачи для решения
- •4. Основные понятия и законы химии
- •4.1. Моль, молярная масса
- •4.2. Основные газовые законы
- •4.3. Закон эквивалентов
- •4.4. Примеры решения задач
- •4.5. Задачи для решения
- •5. Растворы
- •5.1. Концентрации растворов
- •5.1.1. Примеры решения задач
- •5.1.2. Задачи для решения
- •Задачи на приготовление раствора
- •5.2. Коллигативные свойства растворов
- •5.2.1. Закон Рауля
- •5.2.2. Изменение температур фазовых переходов растворов
- •5.2.3. Осмотическое давление
- •5.2.4. Примеры решения задач
- •5.2.5. Задачи для решения
- •5.3. Водородный показатель
- •5.3.1. Расчет рН в растворах сильных кислот и оснований
- •5.3.2. Расчет рН в растворах слабых кислот и оснований
- •5.3.3. Примеры решения задач
- •5.3.4. Задачи для решения
- •5.4. Гидролиз
- •Соль образована одним слабым электролитом
- •5.4.1. Примеры решения задач
- •5.4.2. Задачи для решения
- •5.5. Равновесия в буферных растворах
- •5.5.1. Примеры решения задач
- •5.5.2. Задачи для решения
- •5.6. Равновесия в насыщенных растворах
- •5.6.1. Растворимость в бинарной системе соль - вода
- •5.6.2. Растворимость в многокомпонентной системе с одноименными ионами
- •5.6.3. Условия образования осадков
- •5.6.4. Примеры решения задач
- •5.6.5. Задачи для решения
- •6.Окислительно-восстановительные реакции
- •6.1. Примеры решения задач
- •6.2. Задачи для решения
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Оглавление
4.3. Закон эквивалентов
Эквивалентомвещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.Эквивалентной массой Эназывается масса одного эквивалента вещества. Для газовэквивалентным объемомназывается объем, занимаемый при данных условиях одним эквивалентом вещества. Эквивалент (эквивалентную массу) можно вычислить по составу соединения данного элемента с любым другим, эквивалент (эквивалентная масса) которого известны пользуясьзаконом эквивалентов: массы взаимодействующих веществ пропорциональны их эквивалентным массам:
A+BC+D
|
|
(32) |
На основе закона эквивалентов можно вывести следующие формулы для вычисления эквивалентных масс веществ:
|
|
(33) |
где М– молярная масса элемента, оксида, кислоты, основания или соли, г/моль;Z– степень окисления элемента в продукте реакции, произведение числа атомов элемента и степени окисления элемента в оксидах, основность кислоты, кислотность основания, произведение числа атомов металла и степени окисления металла в соли.
4.4. Примеры решения задач
Пример 1. Определить массовую долю алюминия в его оксиде и вычислить, сколько алюминия теоретически можно выделить из боксита массой 15 т с содержаниемAl2O387 %.
Решение. 1. Найдем молярную массуAl2O3:
![]() .
.
2. Примем количество вещества Al2O3равным 1 моль, тогда количество вещества алюминия будет равно 2 моль. Масса оксида алюминия составит 102 г, а масса алюминия составит 227 = 54 г.
3. Вычислим массовую долю алюминия в его оксиде:
![]() .
.
4. Вычислим массу чистого Al2O3в боксите:
![]() .
.
5. Масса алюминия, которую можно получить из боксита:
![]() .
.
Пример 2. При прокаливании 10 г некоторого вещества было получено 6,436 гCuOи 3,564 гCO2. Вывести формулу соединения.
Решение. 1. Найдем количество вещества оксида меди (II):
![]()
В 1 моль CuOсодержится по 1 мольCuи О, следовательноn(Cu)=n(O, CuO)= 0,081 моль.
2. Найдем количество вещества оксида углерода (IV):
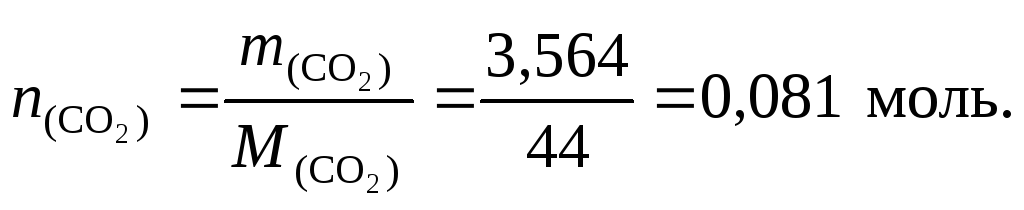
В 1 моль CO2содержится 1 мольCuи 2 моль О, следовательноn(C)= 0,081 моль,
![]() = 20,081
= 0,162 моль.
= 20,081
= 0,162 моль.
3. Общее количество вещества кислорода n(O)= 0,081 + 0,162 = 0,243 моль.
4. Сопоставим количества вещества элементов между собой:
n(Cu):n(C):n(O)= 0,081:0,081:0,243 = 1:1:(0,243/0,081) = 1:1:3.
Полученные целые числа представляют собой стехиометрические индексы формулы вещества, химическая формула которого: CuCO3.
Пример 3. Соединение серы с фтором содержит 62,8 % серы и 37,2 % фтора. Данное соединение при объеме 118 мл в газообразном состоянии (температура 7°С, давление 96,34 кПа) имеет массу 0,51 г. Какова истинная формула соединения?
Решение.
1. Рассчитаем истинную молярную массу
соединения по уравнению Менделеева –
Клапейрона (26):![]() г/моль.
г/моль.
2. Обозначим x
и y количество атомов серы и фтора
в молекуле соответственно (SxFy).
Зная процентное содержание каждого
элемента в соединении и его молярную
массу, получим![]()
3. Таким образом, простейшая формула соединения – SF. Его молярная масса:М = 32+19=51 г/моль.
Соотношение молярных масс, истинной и простейшей:
![]() ,
следовательно, в искомой формуле
содержится в 2 раза больше атомов каждого
вида и ее формула S2F2.
,
следовательно, в искомой формуле
содержится в 2 раза больше атомов каждого
вида и ее формула S2F2.
Пример 4.При окислении 2,81 г кадмия получено 3,21 г оксида кадмия. Вычислить эквивалентную массу кадмия и определить его валентность.
Решение. 1. По массе кадмия и массе его оксида найдем массу кислорода:m(O)=m(CdO)m(Cd)= 3,212,81 = 0,4 г.
2. Образование оксида кадмия можно записать в виде схемы реакции Cd+OCdO, для которой составим пропорцию согласно закону эквивалентов (32):
![]()
![]()
3. Сравнивая
численные значения эквивалентной массы
и молярной массы кадмия, находим:
![]() ,
следовательно, валентность кадмия
равна 2.
,
следовательно, валентность кадмия
равна 2.
Пример 5. Оксид марганца (IV) при прокаливании теряет кислород, образуяMn3O4. Какой объем кислорода при температуре 27°С и давлении 1,1 атм. выделится из 0,58 кгMnO2?
Решение. Запишем уравнение реакции разложения:
![]() ,
,
из которого следует, что 3 моль MnO2дают 1 моль кислорода.
Найдем количество вещества MnO2
![]()
![]()
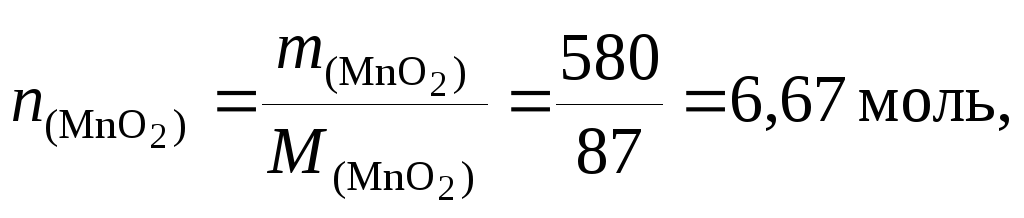
следовательно,
образуется
![]() .
.
2. Учитывая, что 1 атм. = 101325 Па, по уравнению Менделеева-Клапейрона (26) получим:
![]()
Пример 6. К раствору, содержащему 0,2 моль хлорного железа (FeCl3) прибавили 0,24 моль гидроксида натрия. Какое количество гидроксида железа при этом получилось?
Решение. 1. Составим уравнение реакции:FeCl3+ 3NaOHFe(OH)3+ 3 NaCl, из которого следует, что 1 мольFeCl3взаимодействует с 3 мольNaOH, следовательно, для реакции с 0,2 моль хлорного железа требуется гидроксида натрия: 0,23 = 0,6 моль.
2. По условию задачи, количество вещества NaOHсоставляет 0,24 моль, т. е. он в недостатке. Дальнейший расчет ведем по гидроксиду натрия.
3. Составим пропорцию:
3 моль NaOH1 мольFeCl3
0,24 моль NaOHх мольFeCl3,
из
которой вычислим количество вещества
гидроксида железа (III):![]()
