
- •1. Основные классы неорганических соединений. Номенклатура
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Кислоты
- •1.4. Соли
- •1.5. Задачи для решения
- •2. Строение атома
- •1S2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f (лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
- •2.1. Примеры решения задач
- •2.2. Задачи для решения
- •4. Основные понятия и законы химии
- •4.1. Моль, молярная масса
- •4.2. Основные газовые законы
- •4.3. Закон эквивалентов
- •4.4. Примеры решения задач
- •4.5. Задачи для решения
- •5. Растворы
- •5.1. Концентрации растворов
- •5.1.1. Примеры решения задач
- •5.1.2. Задачи для решения
- •Задачи на приготовление раствора
- •5.2. Коллигативные свойства растворов
- •5.2.1. Закон Рауля
- •5.2.2. Изменение температур фазовых переходов растворов
- •5.2.3. Осмотическое давление
- •5.2.4. Примеры решения задач
- •5.2.5. Задачи для решения
- •5.3. Водородный показатель
- •5.3.1. Расчет рН в растворах сильных кислот и оснований
- •5.3.2. Расчет рН в растворах слабых кислот и оснований
- •5.3.3. Примеры решения задач
- •5.3.4. Задачи для решения
- •5.4. Гидролиз
- •Соль образована одним слабым электролитом
- •5.4.1. Примеры решения задач
- •5.4.2. Задачи для решения
- •5.5. Равновесия в буферных растворах
- •5.5.1. Примеры решения задач
- •5.5.2. Задачи для решения
- •5.6. Равновесия в насыщенных растворах
- •5.6.1. Растворимость в бинарной системе соль - вода
- •5.6.2. Растворимость в многокомпонентной системе с одноименными ионами
- •5.6.3. Условия образования осадков
- •5.6.4. Примеры решения задач
- •5.6.5. Задачи для решения
- •6.Окислительно-восстановительные реакции
- •6.1. Примеры решения задач
- •6.2. Задачи для решения
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Оглавление
5.4.1. Примеры решения задач
Пример 1.составить молекулярное и ионное уравнения гидролиза, указать характер среды для сульфата железа (II).
Решение. 1. Напишем уравнение диссоциации соли:
FeSO4Fe2++SO42
2. Определим сильный и слабый электролиты. ИонуFe2+соответствует слабое основаниеFe(OH)2, ионуSO42соответствует сильная кислотаH2SO4, следовательно гидролиз идет по катиону.
3. Составим ионное уравнение гидролиза (по первой ступени!):Fe2++HOHFeOH++H+.
В ходе гидролиза образуются ионы H+, среда кислая.
4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
2 FeSO4 + 2H2O (FeOH)2SO4 + H2SO4.
Пример 2.составить молекулярное и ионное уравнения гидролиза, указать характер среды для карбоната калия.
Решение. 1. Напишем уравнение диссоциации соли:
K2CO3K++CO32
2. Определим сильный и слабый электролиты. ИонуK+соответствует сильное основаниеKOH, ионуCO32соответствует слабая кислотаH2CO3, следовательно гидролиз идет по аниону.
3. Составим ионное уравнение гидролиза (по первой ступени!):CO32+HOHHCO3+OH.
В ходе гидролиза образуются ионы OH, среда в растворе щелочная.
4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
K2CO3 + H2O KHCO3+ KOH.
Пример 3. составить молекулярное и ионное уравнения гидролиза, указать характер среды для нитрита аммония.
Решение. 1. Напишем уравнение диссоциации соли:
NH4NO2NH4++NO2.
2. Определим сильный и слабый электролит. ИонуNH4+соответствует слабое основаниеNH4OH, ионуNO2соответствует слабая кислотаHNO2, следовательно гидролиз идет как по катиону так и по аниону.
3. Составим ионное уравнение гидролиза:
NH4++NO2+HOHNH4OH+HNO2.
4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
NH4NO2 + H2O NH4OH + HNO2.
Пример 4. Вычислить рН раствора сульфата аммония, концентрацией 0,1 моль/л.
Решение. 1. Составим ионное уравнение гидролиза:
NH4++H2ONH4OH+H+.
2. Значение константы диссоциации гидроксида аммония Kd= 1,76105. Вычислим константу гидролиза:
![]()
3. Найдем концентрацию ионов аммония. Согласно уравнению диссоциации сульфата аммония
(NH4)2SO42NH4++SO42,
![]()
4. Вычислим концентрацию ионов [H+]:
![]()
и значение рН: рН = -lg[H+] = -lg(1,066105) = 4,97.
Пример 5.вычислить степень гидролиза карбоната натрия в растворе с рН = 12.
Решение. 1. Составим ионное уравнение гидролиза:
CO32+H2OHCO3+OH.
2. Значение второй константы диссоциации угольной кислоты Kd2= 4,691011. Вычислим первую константу гидролиза:
![]()
3. Из формулы
![]() найдем
концентрацию карбонат-иона:
найдем
концентрацию карбонат-иона:![]() ,
,
где [OH] = 10pOH= 10(14-12)= 102
4. Вычислим степень гидролиза
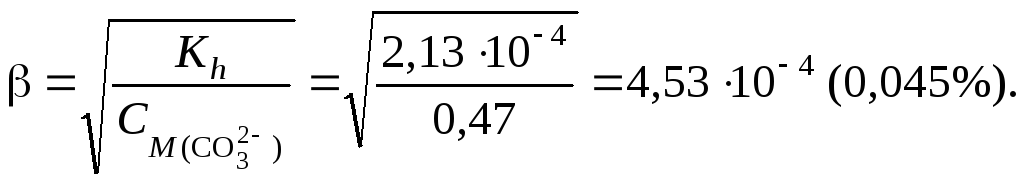
5.4.2. Задачи для решения
I. Составить молекулярные и ионные уравнения гидролиза, указать характер среды
(NH4)2S
(NH4)2SO3
(NH4)3PO4
(ZnOH)2SO4
Al(NO3)3
Al2(SO4)3
Al2S3
AlCl3
Be(NO3)2
Ca(NO3)2
CdCl2
CH3COONH4
CoCl2
Cr(NO3)3
Cr2(SO4)3
CrCl3
Cs2SO4
CsF
CuSO4
Fe2(SO4)3
FeCl3
Fr2S
Ga(NO3)3
HCOOK
HCOONH4
K2SiO3
K2SO3
K3AsO4
KClO4
KCN
KH2AsO4
KHCO3
KMnO4
LiCN
MgCl2
MgSO4
MnCl2
Na2CO3
Na2HAsO4
Na2S
Na2SiO3
Na2WO4
Na3PO4
NaAlO2
NaCl
NaClO4
NaCN
NaH2PO4
NaHCO3
NaI
NaNO2
NH4Cl
NH4CNS
NH4HCO3
NH4NO2
NiSO4
Pb(CH3COO)2
Pb(NO3)2
PbCl4
Rb2S
Rb3PO4
Rb3SbO4
SbCl3
SnCl2
SnCl4
SnSO4
SrSO3
Zn(CH3COO)2
ZnBr
II. Написать в молекулярном и ионном виде реакции взаимоусиления гидролиза
Ацетат меди + сульфит лития.
Ацетат свинца + карбонат натрия.
Ацетат цинка + сульфит натрия.
Нитрат алюминия + карбонат натрия.
Нитрат висмута + сульфид калия.
Нитрат железа (III) + сульфид рубидия.
Нитрат свинца + карбонат стронция.
Нитрат серебра + карбонат натрия.
Нитрат хрома (III) + сульфид меди.
Сульфат алюминия + сульфид натрия.
Сульфат бария + сульфит цезия.
Сульфат кобальта + карбонат калия.
Сульфат олова + карбонат цезия.
Формиат алюминия + карбонат натрия.
Формиат меди + сульфит лития.
Формиат цинка + сульфид лития.
Фосфат алюминия + карбонат калия.
Хлорид железа (II) + сульфид натрия.
Хлорид магния + сульфит рубидия.
Хлорид марганца + сульфит натрия.
Хлорид никеля + карбонат цезия.
III. Найти неизвестные величины
|
№ задачи |
Электролит |
Концентрация раствора |
рН |
|
d р-ра, г/см3 |
|
|
Na2SO3 |
0,008 М |
? |
? |
- |
|
|
Pb(NO3)2 |
? |
5,25 |
? |
- |
|
|
Na2CO3 |
0,006 н. |
? |
? |
- |
|
|
Na2C2O4 |
0,02 М |
? |
? |
- |
|
|
Na3PO4 |
0,02 М |
? |
? |
- |
|
|
C6H5ONa |
? |
? |
5 % |
- |
|
|
Na2S |
0,03 М |
? |
? |
- |
|
|
(NH4)2SO4 |
? |
5,48 |
? |
- |
|
|
NaNO2 |
0,02 н. |
? |
? |
- |
|
|
K2C2O4 |
0,008 М |
? |
? |
- |
|
|
C6H5OK |
? |
? |
0,02 % |
- |
|
|
K2HPO4 |
? |
7,5 |
? |
- |
|
|
NH2OCl |
? |
5,5 |
? |
- |
|
|
Na2S |
0,01 М |
? |
? |
- |
|
|
ZnSO4 |
2 % |
? |
? |
1,019 |
|
|
Na2CO3 |
? |
11,2 |
? |
- |
|
№ задачи |
Электролит |
Концентрация раствора |
рН |
|
d р-ра, г/см3 |
|
|
(CH3COO)2Ba |
0,005 М |
? |
? |
- |
|
|
Na3PO4 |
0,03 н. |
? |
? |
- |
|
|
CdSO4 |
3 % |
? |
? |
1,028 |
|
|
KCN |
0,02 М |
? |
? |
- |
|
|
CuSO4 |
0,1 М |
? |
? |
- |
|
|
ZnCl2 |
? |
5,84 |
? |
- |
|
|
Na2C2O4 |
0,02 М |
? |
? |
- |
|
|
K2HPO4 |
0,03 М |
? |
? |
- |
|
|
HCOONa |
0,02 М |
? |
? |
- |
|
|
Na2CO3 |
? |
? |
0,5 % |
- |
|
|
CdSO4 |
? |
5,6 |
? |
- |
|
|
NaBO2 |
1 г/л |
? |
? |
- |
|
|
NaNO2 |
5 % |
? |
? |
1,01 |
|
|
NH4Cl |
? |
5,48 |
? |
- |
|
|
ZnCl2 |
2 % |
? |
? |
1,016 |
|
|
CH3COONa |
0,01 М |
? |
? |
- |
|
|
HCOONa |
1 % |
? |
? |
1,03 |
|
|
NH4Cl |
% |
5,63 |
? |
1,02 |
|
|
KCN |
0,002 н. |
? |
? |
- |
|
|
C6H5OK |
0,2 М |
? |
? |
- |
|
|
HCOOK |
1 % (мольн.) |
? |
? |
1,02 |
|
|
CH3COONa |
? |
8,72 |
? |
- |
|
|
NH4Cl |
? |
5,41 |
? |
- |
|
|
C6H5ONa |
? |
? |
5,6 % |
- |
|
|
HCOONa |
0,01 н. |
? |
? |
- |
|
|
NH4CN |
? |
9,175 |
? |
- |
|
|
CH3COONH4 |
? |
? |
0,563 % |
- |
|
|
CrCl3 |
2 % |
? |
? |
1,014 |
|
|
Na2Se |
11,36 % |
? |
? |
1,1 |
|
|
Na2SiO3 |
1 г/л |
? |
? |
- |
|
|
Na3BO3 |
1 г/л |
? |
? |
- |
|
|
K2GeO3 |
18,22 % |
? |
? |
1,1 |
|
|
NaBrO |
1 М |
? |
? |
- |
|
|
CoCl2 |
2,6 % |
? |
? |
1,02 |
