
- •Введение
- •Общие сведения о методах и средствах исследования пищевых продуктов
- •Тема 1. Отбор и подготовка пробЫ к анализу
- •Тема 2. Погрешности анализа, обработка результатов измерений, методы оценки точности методик
- •2.1. Аналитический сигнал. Методы измерения
- •2.2. Погрешности анализа. Представление результатов анализа
- •2.3. Статистическая обработка результатов прямых равноточных наблюдений (определений)
- •2.4. Оценка грубых погрешностей (промахов)
- •Тема 3. Титриметрический анализ
- •3.1. Характеристика титриметрического метода. Кривые титрования
- •3.2. Классификация титриметрических методов анализа
- •3.3. Кислотно-основное титрование
- •3.4. Комплексонометрическое титрование
- •3.5. Окислительно-восстановительное титрование
- •3.6. Осадительное титрование
- •Тема 4. Радиометрический анализ и радиационный контроль
- •Тема 5. Электрохимические методы анализа
- •5.1. Потенциометрический метод анализа
- •5.2. Кондуктометрический метод анализа
- •5.3. Кулонометрический метод анализа
- •5.4. Вольтамперометрический метод анализа
- •Тема 6. Оптические методы исследования
- •6.1. Рефрактометрический анализ
- •6.2. Поляризационный анализ
- •6.3. Нефелометрический и турбидиметрический анализы
- •Тема 7. Спектроскопические методы исследования
- •7.1. Понятие спектроскопии. Типы спектров
- •7.2. Фотометрический метод анализа
- •7.3. Радиоспектроскопия, ядерный магнитный и электронный парамагнитный резонансы
- •7.4. Инфракрасная спектроскопия
- •7.5. Ультрафиолетовая спектроскопия
- •7.6. Лазерная спектроскопия
- •7.7. Масс-спектрометрия
- •7.8. Атомно-абсорбционная спектроскопия
- •7.9. Атомно-эмиссионная спектроскопия
- •7.10. Люминесцентный анализ
- •Тема 8. Рентгеновские методы исследования
- •8.1. Рентгеновская спектроскопия
- •8.2. Рентгеновский структурный анализ
- •8.3. Рентгеновский фазовый анализ
- •Тема 9. Хроматография и родственные методы
- •9.1. Понятие, особенности и классификация хроматографии
- •9.2. Газовая хроматография
- •9.3. Жидкостная хроматография
- •9.4. Ионная хроматография
- •9.5. Капиллярный электрофорез
- •Тема 10. Микроскопические методы исследования
- •10.1. Понятие микроскопии
- •10.2. Световая микроскопия
- •10.3. Электронная микроскопия
- •Тема 11. Физические методы исследования
- •11.1. Термический анализ
- •Отклонение стрелок гальванометров
- •11.2. Методы измерения тепловых и термоэлектрических характеристик
- •11.3. Методы измерения электрофизических характеристик проводящих материалов
- •11.4. Методы измерения диэлектрических свойств
- •11.5. Электрические измерения неэлектрических величин
- •11.6. Измерение магнитных свойств материалов
- •11.7. Электрические и магнитные методы контроля состава и свойств материалов. Устройства и методы неразрушающего контроля
- •Тема 12. Электронные датчики химического состава (Химические сенсоры)
- •12.1. Классификация датчиков
- •12.2. Химические датчики (сенсоры)
- •12.3. Биосенсоры
- •12.4. Оптические химические сенсоры
- •12.5. Интеллектуальные сенсорные системы («электронный нос» и «электронный язык»)
- •Список литературы
- •Содержание
5.2. Кондуктометрический метод анализа
Кондуктометрический метод анализа основан на измерении электропроводности анализируемого раствора – величины, обратной электрическому сопротивлению (R):
R = (l : S), (5.3)
где – удельное сопротивление, Ом·см.
При l = 1 см и S = 1 см2 имеем R = , следовательно, удельное сопротивление равно сопротивлению 1 см3 раствора, находящегося между двумя параллельными пластинами площадью 1 см2, отстоящими друг от друга на 1 см.
Величину, обратную удельному сопротивлению, называют удельной электропроводностью (= 1 : ).
Электропроводность разбавленных растворов электролитов зависит от концентрации ионов в растворе, заряда иона и скорости движения одинаково заряженных ионов к катоду или аноду под действием электрического поля. С учетом всех этих факторов электропроводящие свойства ионов характеризуют эквивалентной ионной электри- ческой проводимостью (подвижностью). Она равна произведению абсолютной скорости движения иона на константу Фарадея.
Эквивалентной электрической проводимостью (λ) называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми составляет 1 см. Удельная и эквивалентная проводимости связаны соотношением:
= 1 000 : с, (5.4)
где с – молярная концентрация эквивалента, моль-экв/л.
Эквивалентная электропроводность (подвижность) уменьшается с повышением концентрации раствора. При повышении концентрации электролита увеличивается ионная сила, а скорость движения ионов уменьшается за счет межионных взаимодействий. При нулевой концентрации (бесконечное разбавление) подвижности ионов становятся постоянными и максимальными, и эквивалентная электропроводность раствора электролита при бесконечном разбавлении равна сумме подвижностей ионов, отнесенных к единичному заряду:
![]() (5.5)
(5.5)
Ячейка для измерения электропроводности состоит из двух платиновых электродов Э1 и Э2, впаянных в стеклянный сосуд, в который помещают анализируемый раствор (рисунок 5.1).
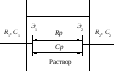
Рисунок 5.1 – Ячейка для кондуктометрических измерений
Электропроводность растворов зависит от температуры и увеличивается на 1–2% при повышении температуры на 1 °С, поэтому изме- рения рекомендуется проводить в термостатированной ячейке.
Различают прямую и косвенную кондуктометрию и кондуктометрическое титрование.
Методы прямой кондуктометрии основываются на том, что в области разбавленных и умеренно концентрированных растворов электрическая проводимость растет с увеличением концентрации электролита.
В практической работе обычно используют заранее построенную градуировочную кривую зависимости электрической проводимости раствора от концентрации тех или иных электролитов. В связи с относительно близкими значениями подвижностей ионов кондуктометрические измерения дают информацию главным образом лишь об общей концентрации ионов в растворе. Малая селективность кондуктометрического метода существенно ограничивает его применение. Прямые кондуктометрические измерения можно использовать для контроля качества воды, применяемой в химической лаборатории; современные установки для перегонки или деминерализации воды снабжаются кондуктометрическими датчиками – кондуктометрами для измерения удельной электропроводности растворов. Детекторы по электропроводности применяются в современном и перспективном методе анализа – ионной хроматографии.
Измерения электрической проводимости растворов широко применяют в титрометрическом анализе для определения ТЭ (кондуктометрическое титрование). В методах кондуктометрического титрования измеряют электрическую проводимость раствора после добавления небольших определенных порций титранта и находят точку эквивалентности графическим методом с помощью кривой в координатах – Vтитранта (удельная электропроводность – объем раствора титранта). В этом методе могут быть использованы такие химические реакции, в ходе которых происходит резкое изменение (обычно возрастание) электрической проводимости после ТЭ (реакции кислотно-основного взаимодействия, осаждения и т. д.) (рисунок 5.2).
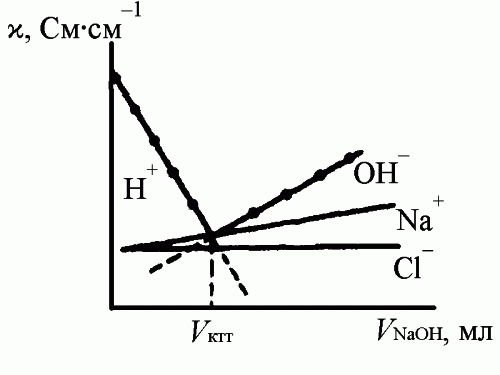
Рисунок 5.2 – Кривая кондуктометрического титрования соляной кислоты раствором гидроксида натрия и вклад отдельных ионов в электропроводность раствора
К достоинствам метода кондуктометрического титрования относится возможность проводить измерения с высокой точностью даже в очень разбавленных растворах, а также при анализе окрашенных или мутных растворов и последовательном определении компонентов смеси, например, титровать кислоты с различающимися константами диссоциации.
